
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
2.3.3. Химические свойства солей
1) Более активные металлы (стоящие левее в ряду стандартных электродных потенциалов) вытесняют менее активные металлы из растворов их солей:
Zn + 2AgNO3 = 2Ag + Zn(NO3)2
2) Более активные неметаллы (cтоящие выше в подгруппе) вытесняют менее активные из растворов их солей:
Br2 + 2NaI = I2 + 2NaBr
3) Соли взаимодействуют со щелочами:
CuSO4 + 2NaOH = Cu(OH)2↓ + 2Na2SO4
4) Cоли взаимодействуют с кислотами:
CuSO4 + H2S = CuS↓ + H2SO4
5) Многие соли взаимодействуют между собой:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Реакции обмена 3-5 проводятся обычно в растворах.
Они протекают необратимо (до конца) лишь в том случае, если реагенты растворимы, а один из образующихся продуктов уходит из сферы реакции, т.е. выпадает в виде осадка малорастворимого вещества или выделяется в виде газа.
6) Гидролиз солей, т.е. обменное взаимодействие солей с водой, характерен для большинства солей.
Гидролизу подвергаются соли, в состав которых входят катионы слабых оснований и/или анионы слабых кислот. Соли, образованные сильными кислотами и сильными основаниями (например, NaCl), гидролизу не подвергаются.
Гидролиз, как правило, протекает обратимо и приводит к частичному разложению средней соли либо с образованием кислоты и основания:
NaCN + H2O ⇄ NaOH + HCN
либо с образованием кислой или основной соли:
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
MgCl2 + H2O ⇄ Mg(OH)Cl + HCl
Вследствие образования кислоты или щелочи растворы гидролизующихся солей обычно имеют кислую или щелочную реакцию, которую можно установить с помощью индикатора.
В ряде случаев гидролиз проходит необратимо до полного разложения соли:
Al2S3 + 6H2O 2Al(OH)3↓ + 3H2S↑
Напротив таких солей в таблице растворимости стоит прочерк.
Подробнее гидролиз солей будет рассмотрен в главе 7.
Задание для самостоятельной работы
1. Некоторые оксиды, способные к взаимодействию с водой, используют в качестве осушителей. Определить, какие из перечисленных оксидов можно использовать как осушители:
а) оксид кальция; б) оксид меди (II); в) оксид кремния (IV); г) оксид фосфора (V); д) оксид бария; е) оксид железа (III). Ответ подтвердить уравнениями реакций.
2. Определить, какие оксиды могут быть получены при разложении следующих веществ;
а) кремниевая кислота; б) гидроксид железа (III); в) карбонат бария; г) гидроксид магния; д) азотистая кислота; е) фосфорная кислота; ж) сернистая кислота; з) гидроксид марганца (II). Ответ подтвердить уравнениями реакций.
3. Определить, с какими оксидами реагирует соляная кислота:
а) оксид кремния (IV); б) оксид меди (II); в) оксид серы (IV); г) оксид железа (III); д) оксид натрия; е) оксид алюминия.
4. Определить пары оксидов, которые могут реагировать между собой:
а) оксид кремния (IV); б) оксид кальция; в) оксид серы (IV); г) оксид серы (VI); д) оксид железа (III); е) оксид кадмия; ж) оксид фосфора (V); з) оксид углерода (IV); и) оксид бария. Ответ подтвердить уравнениями реакций.
5. Определить, какие из перечисленных веществ будут реагировать с раствором гидроксида калия:
а) соляная кислота; б) сульфат железа (III); в) оксид магния; г) гидроксид алюминия; д) гидросульфид калия. Ответ подтвердить уравнениями реакций.
6. Определить, с какими из перечисленных веществ реагирует серная кислота:
а) сульфид калия; б) гидроксид меди (II); в) оксид магния; г) оксид алюминия; д) оксид фосфора (V); е) хлорид бария. Ответ подтвердить уравнениями реакций.
7. Написать уравнения реакций, протекающих по схеме:
а) FeCl2 Fe(OH)2 FeSO4 BaSO4
б) Cu X CuCl2 Y CuSO4
в) Zn ZnSO4 Zn(OH)2 Na2[Zn(OH)4]
г) S SO2 SO3 H2SO4 Al2(SO4)3 Al(OH)3 Al2O3
д) KOH K3PO4 KH2PO4 K2HPO4 K3PO4 Mg3(PO4)2
е) CaO CaCO3 Ca(HCO3)2 CaCO3 CO2 Na2CO3
ж) Na NaOH Fe(OH)3 Fe2(SO4)3 BaSO4
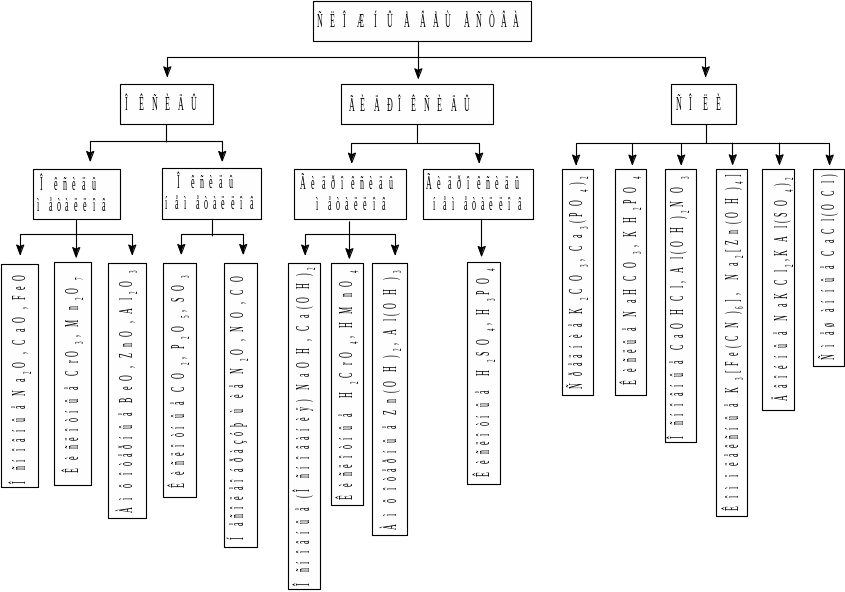
Схема. 1. Основные классы неорганических соединений.
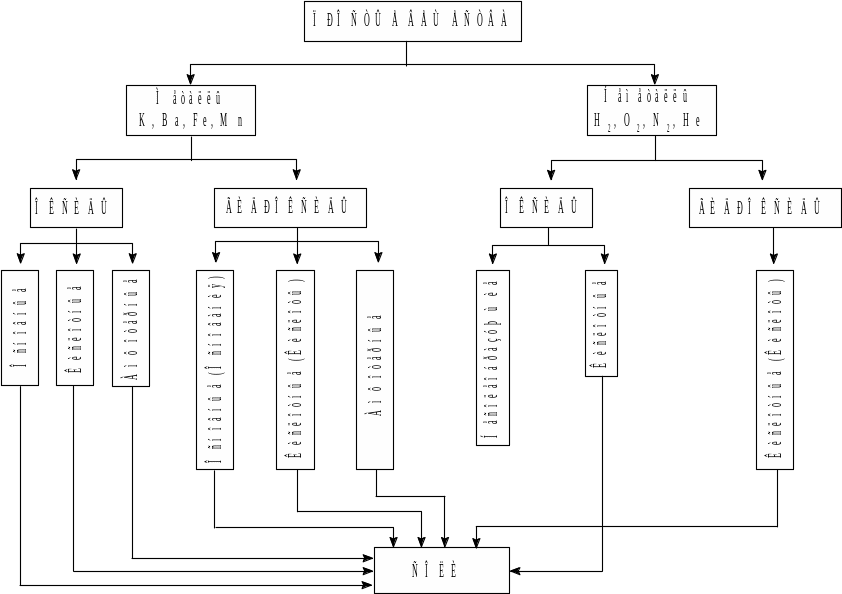
Схема. 2. Взаимосвязь между основными классами неорганических соединений.
