
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
7.2.1. Факторы, влияющие на степень диссоциации электролитов
В первую очередь степень диссоциации определяется природой электролита:
Диссоциации подвергаются вещества с ионным или близким к ионному типом химической связи.
Особую роль играет растворитель:
Диссоциация сильнее протекает в полярном растворителе и слабее в неполярном растворителе.
Действительно, при замене растворителя степень диссоциации электролитов может резко возрасти или уменьшиться.
Процесс диссоциации, как правило, является эндотермическим, поэтому:
С ростом температуры степень диссоциации увеличивается.
При постоянной
температуре сравнительную силу слабых
электролитов определяют две величины:
степень диссоциации
и константа диссоциации
![]() .
Эти величины являются взаимо-связанными.
.
Эти величины являются взаимо-связанными.
|
(27) |
Данное соотношение выражает закон разведения Оствальда.
Для слабых электролитов << 1, поэтому можно записать:
![]()
или:
|
(28) |
Таким образом, закон Оствальда можно сформулировать следующим образом:
Степень диссоциации слабого электролита возрастает с разбавлением раствора.
Наконец, на степень диссоциации слабого или среднего электролита может оказать влияние состав раствора.
Пример 1. Определить, как изменится степень и константа диссоциации уксусной кислоты, если к ее раствору добавить небольшое количество ацетата натрия.
Решение.
Уксусная кислота слабый электролит, который диссоциирует обратимо:
CH3COOH ⇄ H+ + CH3COO.
Ацетат натрия CH3COONa сильный электролит и диссоциирует полностью:
CH3COONa Na+ CH3COO.
Согласно принципу Ле Шателье при повышении концентрации ионов CH3COO равновесие диссоциации уксусной кислоты смещается влево, концентрация молекулярной формы увеличивается, а концентрация диссоциированной формы, наоборот, уменьшается. Таким образом, степень диссоциации кислоты снижается.
Константа диссоциации CH3COOH не изменяется, так как не зависит от концентрации вещества.
Таким образом можно заключить:
Присутствие в растворе одноименных ионов снижает степень диссоциации.
7.2.2. Реакции в растворах электролитов
Ранее отмечалось, что реакции обмена, протекающие в растворах, являются необратимыми, если в результате образуется газ, осадок или вода. Теория электролитической диссоциации позволяет сделать важное дополнение:
Реакция обмена, протекающая в растворе, является необратимой и в том случае, если в результате образуется слабый электролит.
Так, реакция между ацетатом натрия и соляной кислотой является практически необратимой (равновесие сильно смещено вправо), так как в результате образуется слабый электролит уксусная кислота:
CH3COONa + HCl NaCl CH3COOH.
Пример 1. Определить, какая из приведенных реакций является необратимой:
а) между сульфатом меди и хлоридом натрия;
б) между карбонатом натрия и хлоридом кальция.
Написать уравнения в молекулярном и ионном виде.
Решение.
Реакция между сульфатом меди и хлоридом натрия является обратимой, так как образующиеся вещества являются сильными электролитами.
В молекулярном виде уравнение выглядит так:
CuSO4 + 2NaCl ⇄ Na2SO4 + CuCl2
В ионном виде:
Cu2+ + SO42 + 2Na+ + 2Cl ⇄ 2Na+ + SO42 + Cu2+ + 2Cl
Реакция между карбонатом натрия и хлоридом кальция является необратимой, так как в результате образуется осадок:
Молекулярное уравнение:
CaCl2 + Na2CO3 CaCO3↓ 2NaCl
Полное ионное уравнение:
Ca2+ + 2Cl + 2Na+ + CO32 CaCO3↓ 2Na+ + 2Cl
Сокращенное ионное уравнение:
Ca2+ + CO32 CaCO3↓
Пример 2. Привести два молекулярных уравнения, соответс-твующих сокращенному ионному: Ba2+ + SO42 BaSO4↓.
Решение.
1) Ba(OH)2 + H2SO4 BaSO4↓ + 2H2O;
2) BaCl2 + Na2SO4 BaSO4↓ + 2NaCl.
Пример 3. Определить концентрации ионов в 1 л раствора, содержащего 0,05 моль K2SO4 и 0,1 моль Na3PO4.
Решение.
Обе соли являются растворимыми, следовательно, диссоциируют полностью:
K2SO4 2K+ + SO42
Na3PO4 3Na+ + PO43
Согласно закону стехиометрических соотношений:
C(K+) = 2C(K2SO4) = 20,05 = 0,1 моль/л;
C(SO42) = C(K2SO4) = 0,05 моль/л;
C(Na+) = 3C(Na3PO4) = 30,1 = 0,3 моль/л;
C(PO43) = C(Na3PO4) = 0,1 моль/л.
Примеры решения задач
Задача №1
Определить константу диссоциации кислоты HA, если в растворе этой кислоты с концентрацией 0,1 моль/л = 24%.
Решение.
По величине степени диссоциации можно определить, что данная кислота является электролитом средней силы. Следовательно, для расчета константы диссоциации кислоты используем закон разведения Оствальда в его полной форме:
![]()
Задача №2
Определить концентрацию электролита, если 10%, Kд 104.
Решение.
Из закона разведения Оствальда:
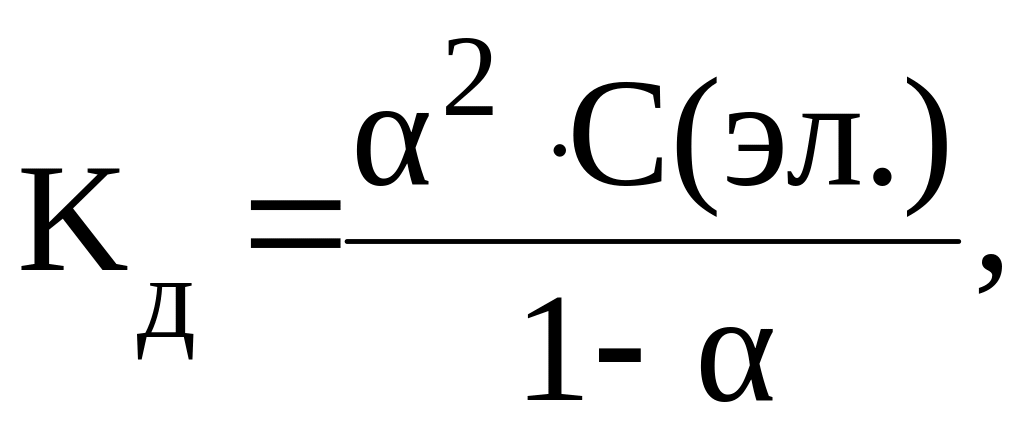
находим:
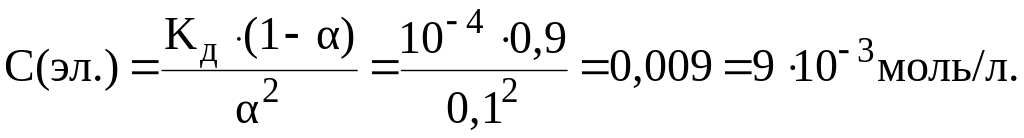
Задача №3
Степень диссоциации
одноосновной кислоты HA
не превышает 1%.
![]() (HA)
= 6,4107.
Определить степень диссоциации HA
в ее растворе с концентрацией 0,01 моль/л.
(HA)
= 6,4107.
Определить степень диссоциации HA
в ее растворе с концентрацией 0,01 моль/л.
Решение.
По величине степени диссоциации можно определить, что данная кислота является слабым электролитом. Это позволяет использовать приближенную формулу закона разведения Оствальда:
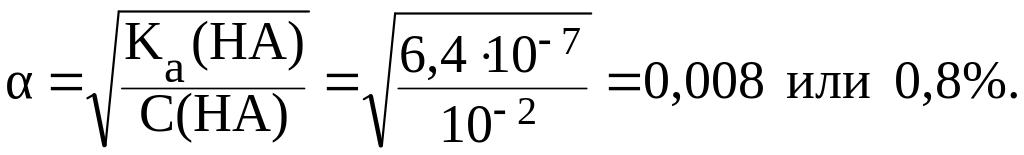
Задача №4
Степень диссоциации электролита в его растворе с концен-трацией 0,001 моль/л равна 0,009. Определить константу диссоциации этого электролита.
Решение.
Из условия задачи видно, что данный электролит является слабым ( 0,9%). Поэтому:
![]()
Задание для самостоятельной работы
1. Написать уравнение электролитической диссоциации: KBr, H2SO4, Cu(NO3)2, Fe2(SO4)3, H2SO3, Al(OH)3, NaH2PO4.
2. Определить концентрации ионов в 1 л раствора, содержащего 0,2 моль Al(NO3)3 и 0,4 моль Cr2(SO4)3.
3. Определить, какие из приведенных реакций являются необратимыми:
а) между сульфатом меди и хлоридом бария;
б) между карбонатом натрия и азотной кислотой;
в) между сульфатом натрия и бромидом калия;
г) между нитратом серебра и иодидом калия;
д) между гидроксидом кальция и соляной кислотой;
е) между сульфидом аммония и нитратом свинца;
ж) между хлоридом аммония и гидроксидом натрия.
Написать уравнения в молекулярном и ионном виде.
4. Привести два молекулярных уравнения, соответствующих сокращенному ионному:
а) Cu2+ + 2OH Cu(OH)2;
б) CO32 + 2H+ CO2 + H2O;
в) 3Ca2+ + 2PO43 Ca3(PO4)2;
г) 2Н+ + S2 H2S;
д) HCO3 + OH CO32 + H2O
4. Рассчитать
величину
![]() одноосновной кислоты HA,
если при С(HA)
0,12 моль/л степень диссоциации кислоты
равна 8%.
одноосновной кислоты HA,
если при С(HA)
0,12 моль/л степень диссоциации кислоты
равна 8%.
5. Вычислить
молярную концентрацию электролита в
растворе, если 0,75%,
а
![]()
105.
105.
6. (HNO2) 4104. Сравнить силу HNO2 с силой одноосновной кислоты HA, степень диссоциации которой в растворе с С(HA) 3,6105 моль/л равна 10%.


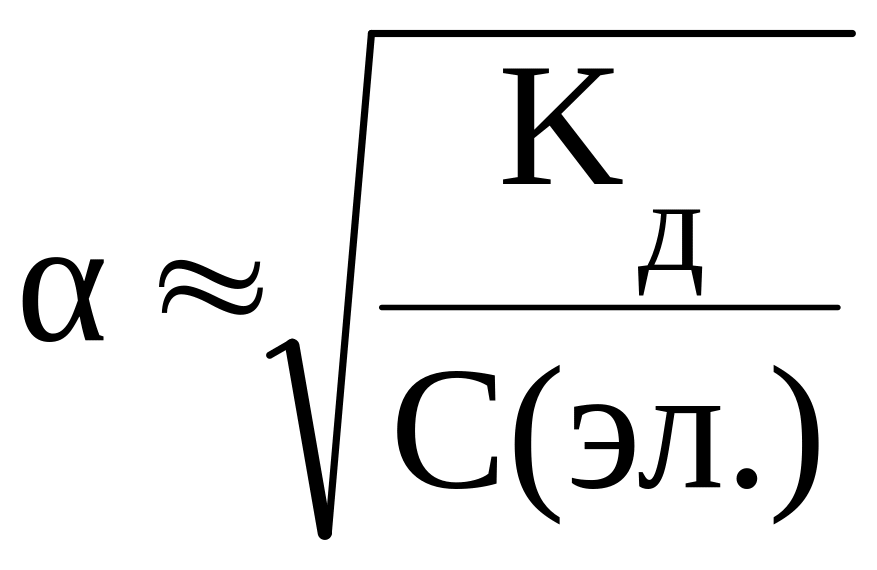 .
.