
Акушерство для студентов / Запоражан том 1
.pdf
Розділ 4
РЕПРОДУКТИВНА
ЕНДОКРИНОЛОГІЯ
Нейроендокринна регуляція репродуктивної системи
Нейроендокринна регуляція репродуктивної системи є надзвичайно складною. Всі органи, залучені у репродуктивний процес, мають прямі та зворотні зв’язки: 1) цент ральна нервова система та надгіпоталамічні структури мозку; 2) гіпоталамус; 3) гіпофіз; 4) яєчники; 5) матка та інші органи мішені. Протягом останніх трьох де сятиліть було отримано багато нової інформації, але дані щодо точного механізму складних нейроендокринних процесів постійно змінюються.
Гіпоталамус
Нейроендокринологія секреції ГнРГ
Гіпоталамічний контроль секреції гонадотропінів гіпофізом здійснюється за до помогою гонадотропін рилізинг гормону (ГнРГ).
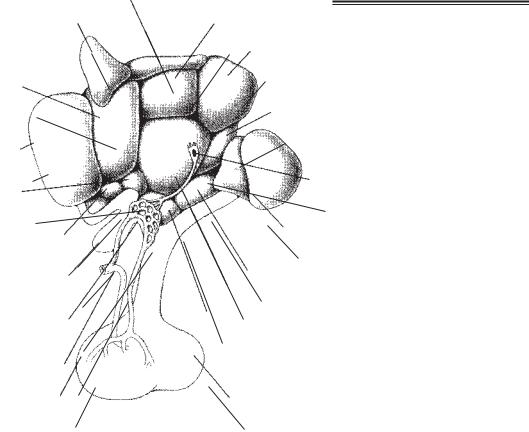
Утворення ГнРГ декапептиду кодується геном, локалізованим на короткому плечі хромосоми 8. ГнРГ рецептори локалізуються в гіпофізі та багатьох органах репро дуктивної системи. Нейрони, які секретують ГнРГ, знаходяться переважно у перед ньому, медіобазальному (горбовому) гіпоталамусі та аркуатних ядрах. По аксонах цих нейронів ГнРГ транспортується до медіального підвищення гіпофіза, де досягає капілярів первинного портального сплетення. Нервові клітини, які транспортують ГнРГ з аркуатних ядер гіпоталамуса до медіального підвищення гіпофіза, одержали назву горбо лійкового, або горбо гіпофізарного шляху.
Медіальне підвищення, або лійка, разом з лійковим стеблом і задньою часткою гіпофіза утворюють нейрогіпофіз. Ці три компоненти нейрогіпофіза утворюють за гальну капілярну сітку і мають пряме артеріальне кровопостачання з гіпофізарних артерій. Капіляри медіального підвищення мають фенестрований епітелій, як і пе риферичні тканини, що дозволяє пропускати великі молекули. Ці капіляри відрізня ються від капілярів головного мозку, отже медіальне підвищення гіпофіза знахо диться поза гематоенцефалічним бар’єром.
Нервові клітини з горбо гіпофізарного тракту секретують ГнРГ безпосередньо у портальну циркуляцію, звідки він переноситься в клітини передньої частки гіпофі за. Медіобазальна частина передньої частки гіпофіза (аденогіпофіз) одержує кров з портальних судин гіпофіза і локалізується близько до основи гіпоталамуса і гіпофі зарного стебла (рис. 4.1). На відміну від нейрогіпофіза, аденогіпофіз не має прямого
119
Акушерство і гінекологія. Том 1
10
9
8
7
6
5
4
3
2
1
11
12
13 |
Рис. 4.1. Ядерна структура |
|
|
|
гіпоталамуса (сагітальний роз |
|
різ у площині III шлуночка |
|
мозку; каудальна частина пра |
14 |
воруч): |
1 — передня частка гіпофі |
|
|
за; 2 — верхня гіпофізарна ар |
|
терія; 3 — медіальне підвищен |
|
ня; 4 —перехрестя зорових |
15нервів (хіазма); 5 — супрахіаз матизні ядра; 6 — супраоп
16 |
тичні ядра ; 7 — преоптичні |
|
ядра; 8 — передня зона гіпота |
||
17 |
ламуса; 9 — паравентрикуляр |
|
не ядро; 10 — дорсальна зона |
||
|
||
18 |
гіпоталамуса; 11 — дорсомеді |
|
|
альне ядро; 12 — заднє гіпота |
|
ламічне ядро; 13 — премамі |
|
|
лярне ядро; 14 — таніцит; 15 — |
|
|
мамілярне тіло; 16 — горбова |
|
|
зона; 17 — вентромедіальне |
|
19 |
ядро; 18 — аркуатне ядро; 19 — |
|
задня частка гіпофіза |
||
|
артеріального кровопостачання і одержує кров з портальних судин. Залишаючи аде ногіпофіз, судини повертаються до нейрогіпофізарного капілярного сплетення, доз воляючи гіпофізарним гормонам брати участь у регуляції секреції ГнРГ медіальним підвищенням.
Додатково до цього основного шляху існують альтернативні шляхи транспорту ГнРГ. Аксони горбо лійкового тракту можуть переносити ГнРГ прямо до третього шлуночка мозку. Спеціалізовані епендимальні клітини — таніцити — поширюються з порожнини третього шлуночка в найдальшу зону медіального підвищення (рис. 4.2). Якщо ГнРГ потрапляє у третій шлуночок, він транспортується у портальну систему через мікроворсинки таніцитів. Отже, ГнРГ виділяється двома шляхами: у великій кількості періодично через горбо лійковий тракт (циклічне виділення) і у незначній кількості постійно через трансепендимальну систему (тонічне виділення).
У жінки ГнРГ секретується в пульсаційному режимі і має період напівжиття 2– 4 хв. Амплітуда і частота імпульсів варіює протягом менструального циклу, частота є більшою у фолікулярну фазу (1 імпульс за 1 год) і меншою у лютеїнову фазу (1 імпульс за 2–3 год). Пульсація ГнРГ взаємодіє з секрецією гонадотропінів. Так, при щогодинному екзогенному введенні ГнРГ виникає пік секреції гонадотропінів, характерний для овуляторної фази менструального циклу, а при введенні ГнРГ з частотою 5 імпульсів за годину секреція гонадотропінів пригнічується. При змен шенні частоти введення ГнРГ до 3 імпульсів за годину рівень лютеїнізуючого гормо
120

Розділ 4. Репродуктивна ендокринологія
4
6
3 |
|
7 |
5 |
8
2
1 |
9 |
|
Рис. 4.2. Схематична діаграма таніцитів (8), які проходять між третім шлуноч ком і зовнішньою частиною медіального підвищення гіпоталамуса:
1 — горбова частина; 2 — базальна мембрана; 3 — нейро ендокринні клітини (шляхи виділення серотоніну); 4 — горбо лійковий (тубероінфундибулярний) тракт; 5 — третій шлуночок; 6 — аксони супраоптичних і паравентрикулярних ней ронів; 7 — медіальне підвищення; 8 — периваскулярний простір; 9 — портальні су дини
ну (ЛГ), або лютропіну, зменшується, а рівень фолікулостимулювального гормону (ФСГ), або фолітропіну, зростає; не виникає овуляторного піка секреції гонадотро пінів. Зменшення кількості екзогенного ГнРГ також пригнічує виділення гонадотро пінів гіпофізом.
Жінки з ановуляцією та гіпоталамічною аменореєю, а також з аменореєю нез’ясо ваного походження мають порушення частоти та (або) амплітуди виділення ГнРГ. Отже, контроль епізодичної секреції ГнРГ є дуже важливим для підтримання нор мальної овуляторної циклічності. Амплітуда і частота ГнРГ секреції гіпоталамусом регулюється зворотним зв’язком як з яєчниковими стероїдами — естрадіолом і прогес тероном, так і з гіпофізарними гонадотропінами гуморальним шляхом. Амплітуда і частота імпульсів ГнРГ регулюється також неврогенним шляхом за допомогою ней ротрансмітерів і нейромодуляторів головного мозку.
Нейротрансмітери
Найбільш важливими нейротрансмітерами, які беруть участь у регуляції функції репродуктивної системи, є два катехоламіни — допамін і норепінефрин а також один індоламін — серотонін. Усі три нейротрансмітери є моноамінами. Допамін і норепі
121

Акушерство і гінекологія. Том 1
нефрин утворюються шляхом конверсії тирозину в середньому мозку. Фермент ти розин гідроксилаза конвертує тирозин до (3,4 дигідроксифенілаланіну) (допа), який потім декарбоксилюється до допаміну. Важливим коферментом цього процесу є піри доксин. Допамін оксидаза конвертує допамін до норепінефрину. Норепінефрин потім конвертується у епінефрин шляхом додавання метилової групи за допомогою фер менту метилтрансферази (рис. 4.3).
Попередником серотоніну є триптофан, який спочатку конвертується до 5 гідрок ситриптофану за допомогою ензиму триптофан гідроксилази, що, в свою чергу, декар боксилюється з утворенням серотоніну. Основним метаболітом серотоніну є 5 гідроксиіндолоцтова кислота (5 HIAA), яка може бути визначена в сечі. Серотонін безпосередньо не впливає на виділення ГнРГ, але він сприяє виділенню пролактину, можливо, шляхом стимуляції секреції гіпоталамічного пролактин рилізинг фактора.
Сучасна точка зору щодо дії нейротрансмітерів полягає в тому, що біогенні кате холаміни модулюють пульсаційне виділення ГнРГ. Вважають, що норепінефрин сти мулює, а серотонін інгібує виділення ГнРГ шляхом впливу на частоту, і, можливо, амплітуду імпульсів ГнРГ. Отже, фармакологічні або фізіологічні агенти, які впли вають на функцію гіпофіза, можливо, діють шляхом порушення синтезу або метабо лізму катехоламінів, що регулюють пульсаційне виділення ГнРГ.
Внутрішньовенне введення допаміну як у чоловіків, так і в жінок, призводить до зменшення рівня циркулюючого пролактину і гонадотропінів. Допамін не чинить прямої дії на секрецію гонадотропінів передньою часткою гіпофіза, його дія моду люється шляхом інгібіції виділення ГнРГ гіпоталамусом. Хоча точна хімічна струк тура ендогенного пролактин інгібуючого гормону ще нез’ясована, вважають, що до фамін відіграє роль гіпоталамічного інгібітора секреції пролактину.
Вплив нейротрансмітерів на секрецію гіпоталамічних гормонів може здійснюва тися кількома механізмами. Одним із можливих механізмів є пряма міжклітинна взаємодія або мультисинаптичні зв’язки, де нейротрансмітери виділяються термі
1 |
2 |
Рис. 4.3. Біохімічна структура попередників стероїдних гормонів: 1 — фенант рен; 2 — циклопентанпергідрофенантрен (гонан, D додаткове 5 вуглецеве кільце); 3 — холестерол
122

Розділ 4. Репродуктивна ендокринологія
нальними нервами і деполяризують рецептори гіпоталамічних клітин. Деполяриза ція відбувається при вивільненні специфічного гормону гіпоталамічними клітина ми. Цей специфічний ефект нейротрансмітерів на гіпоталамічні клітини може бути ушкоджений системним призначенням деяких медикаментів. Так, метилдопа бло кує синтез допаміну і норепінефрину шляхом інгібіції ферменту тирозин гідрокси лази. І резерпін, і хлорпромазин діють із норепінефрином, допаміном і серотоніном, зв’язуючись і накопичуючись. Трициклічні антидепресанти інгібують нейротрансмі тери, тимчасом як такі препарати, як пропранолол, фентоламін, галоперидол діють шляхом блокування рецепторів на рівні гіпоталамуса. Отже, при застосуванні таких медикаментів у пацієнток можуть мати місце галакторея, оліго та аменорея. Цей клінічний ефект розвивається як внаслідок гіперпролактинемії, так і внаслідок по рушення секреції ГнРГ.
Нейромодулятори
Опіоїди. Рецептори до опіоїдних пептидів знаходяться у головному мозку. Виді ляють 3 групи опіатів: енкефаліни, ендорфіни (α , β , γ ) і динорфіни. β ендорфін (β EP) складається з 31 амінокислоти і в 5–10 разів активніший за морфін. Він концентрується переважно в аркуатних ядрах і медіальному підвищенні гіпоталаму са, а також у гіпофізі. β EP виявляють також у плаценті, підшлунковій залозі, шлун ково кишковому тракті і сім’яній рідині. Концентрація β EP у гіпофізі майже в 1000 разів вища, ніж у гіпоталамусі. Інфузія β EP спричинює зростання рівня пролакти ну і зменшення ЛГ; останній здійснює інгібіторний ефект на ГнРГ нейрони в гіпота ламусі. Вважають, що опіати пригнічують вивільнення ГнРГ шляхом впливу на син тез катехоламінів, особливо норепінефрину. Периферичний рівень β EP у плазмі крові не відповідає такому в судинах центральної нервової системи (ЦНС).
Введення антагоністів опіоїдів, наприклад, налоксону, дозою понад 1 мг/год бло кує мозкову опіоїдну активність і спричинює збільшення ЛГ у пізню фолікулінову і лютеїнову фазу, але не в ранню фолікулінову фазу і не в жінок у постменопаузі. Отже, естрогени і прогестерон сприяють зростанню рівня β EP у головному мозку. Зростання рівня β EP може бути пов’язане зі зменшенням пульсації ГнРГ у лютеї нову фазу.
Простагландини. Рівень простагландинів у гіпоталамусі може модулювати виді лення ГнРГ. Призначення простагландину Е2 призводить до значного підйому рівня ГнРГ у портальній циркуляції. Більше того, фізіологічна роль простагландинів у регуляції або модуляції секреції ГнРГ доводиться тим, що в експерименті на щурах і вівцях овуляторний пік ЛГ може бути ліквідований при призначенні аспірину або індометацину, які блокують синтез простагландинів. Дані щодо впливу інгібіторів простагландинів та інгібіторів простагландин синтетази на секрецію гонадотропінів у людини відсутні.
Катехолестрогени. Катехолестрогени — складні 2 гідроксиестрадіол і 2 гідрокси естрон, а також їх 3 метоксидеривати присутні в гіпоталамусі в більшій концент рації, ніж простагландини Е1 і Е2. Вважають, що ці речовини можуть діяти як нейро модулятори шляхом регуляції функції катехоламінів через інактивацію тирозин гідроксилази та активацію ензиму катехол О метилтрансферази. Але даних про те, що катехолестрогени мають значний вплив на нейромодуляцію репродуктивної функції, недостатньо.
123

Акушерство і гінекологія. Том 1
Мозкові пептиди
Численні пептиди можуть діяти як нейротрансмітери, але більшість з них діють на локальному рівні шляхом регуляції аутокринних і паракринних функцій. Хоча синтез і секреція гіпофізарних гормонів контролюються переважно класичною систе мою гормональних месенджерів, існують також суттєві локальні міжклітинні взаємо дії. До мозкових пептидів, які діють як нейротрансмітери, належать нейропептид Y, ангіотензин ІІ, соматостатин, активін, інгібін, фолістатин і галанін.
Нейропептид Y. Нейропептид Y стимулює пульсаційну секрецію ГнРГ і в гіпофізі потенціює відповідь гонадотропінів на ГнРГ. Таким чином, він може сприяти сек реції ГнРГ і гонадотропінів. За відсутності естрогенів нейропептид Y пригнічує сек рецію гонадотропінів. Збільшені рівні нейропептиду Y були виявлені у спинномоз ковій рідині жінок з нервовою анорексією та булімією, тому вважають, що нейро пептид Y є одним із факторів, що пов’язують порушення харчування з розладами репродуктивної функції.
Ангіотензин ІІ. Кілька компонентів ренін ангіотензинової системи присутні у го ловному мозку. Рецептори до ангіотензину ІІ знайдені в кількох типах гіпофізарних клітин. Це дає можливість припустити, що ангіотензин ІІ впливає на секрецію гіпо фізарних гормонів шляхом локальної дії. Крім того, в гіпоталамусі ангіотензин ІІ впливає на дію норепінефрину і допаміну щодо вивільнення факторів, контролюю чих секрецію гонадотропінів і пролактину.
Соматостатин. Соматостатин — це гіпоталамічний пептид, який пригнічує виді лення гормону росту, пролактину і тиреотропного гормону (ТТГ, або тиреотропіну), гіпофізом.
Активін та інгібін. Активін та інгібін — пептиди, які утворюються яєчниками і є пептидними представниками сімейства факторів росту β . Ці пептиди мають проти лежну дію на секрецію ФСГ. Інгібін вибірково зменшує виділення ФСГ (але не ЛГ), а активін стимулює синтез ФСГ (але не ЛГ).
Фолістатин. Фолістатин — це яєчниковий пептид, який ще називають ФСГ пригнічуючим білком у зв’язку з його дією: пригніченням синтезу і секреції ФСГ, а також відповіді ФСГ на ГнРГ. Фолістатин також зв’язує активін і, в такий спосіб, зменшує його активність.
Галанін. Галанін вивільняється у портальну циркуляцію у пульсаційному режимі та позитивно впливає на секрецію ЛГ.
Дія ГнРГ
Коли ГнРГ досягає передньої частки гіпофіза, він стимулює секрецію ЛГ і ФСГ одними і тими ж гіпофізарними клітинами. Отже, якщо гіпоталамічний контроль секреції пролактину може бути як пригнічуючим (переважно), так і стимулюючим, то гіпоталамічний контроль секреції гонадотропінів є лише стимулюючим. Пептидні гормони, такі як ГнРГ, зв’язують специфічні рецептори на поверхні мембрани клітин мішеней, на відміну від стероїдних гормонів, які проходять через клітинну мембра ну і зв’язуються з внутрішньоклітинними рецепторами (табл. 4.1).
Рецептори протеїнових гормонів мають високу молекулярну масу (200 000– 300 000 дальтон), і кожний рецептор зв’язується з 1 молекулою протеїну. Поліпеп тидні гормони, такі як ЛГ, ФСГ і пролактин, хоча й мають деякий ступінь розчин ності у рідинах організму, характеризуються низькою розчинністю у ліпідах, і тому не можуть швидко проходити через ліпідний бар’єр плазматичних мембран клітин
124
|
|
Розділ 4. Репродуктивна ендокринологія |
|
|
|
|
|
|
|
Таблиця 4.1 |
|
|
Застосування аналогів ГнРГ у гінекології |
||
|
|
|
|
|
Стимуляція гіпофізарно |
Супресія гіпофізарно яєчникової |
|
|
яєчникової функції (ГнРГ) |
функції (аналоги ГнРГ) |
|
|
|
|
|
|
Затримка статевого розвитку |
Передчасний статевий розвиток |
|
|
Індукція овуляції |
Ендометріоз |
|
|
|
Рак молочної залози |
|
|
|
Міома матки |
|
|
|
Яєчникова гіперандрогенія |
|
|
|
|
|
мішеней. Після зв’язування протеїнового гормону зі своїм рецептором, комплекс гормон рецептор проходить через клітинну мембрану для захисту її від інших впливів. Цей процес називається інтерналізацією. Крім інтерналізації гормон рецепторного комплексу, гормональний сигнал може бути перенесений у клітину шляхом транс мембранних сигналів за допомогою продукції внутрішньоклітинних та позаклітин них мембранозв’язаних вторинних месенджерів. Коли протеїновий гормон зв’язується зі специфічним рецептором, він активує або пригнічує фермент аденілатциклазу, (вторинний месенджер), який, в свою чергу, змінює концентрацію циклічного 3′5′ аденозинмонофосфату (цАМФ). Потім цАМФ активує протеїнкіназу в цито плазмі шляхом зв’язування її регуляторної субодиниці (викликає дисоціацію цієї субодиниці з її каталізуючою субодиницею). Коли регуляторна одиниця протеїнкі нази звільнюється від її каталізуючої субодиниці, остання одержує здатність переда вати фосфати з аденозинтрифосфату (АТФ) до протеїнового субстрату.
Зв’язування ГнРГ мембранами клітин гіпофіза полегшується під дією кальцію та простагландинів; кальцій активує виділення запасів ЛГ і ФСГ. Диференційована секреція ЛГ і ФСГ досягаєтся зворотним зв’язком стероїдних і пептидних гормонів на гонадотропах.
При болюсному призначенні ГнРГ виникає швидке зростання рівня циркулюю чого ЛГ, яке досягає піка через 30 хв, і зростання ФСГ з піком через 60 хв. Рівні ЛГ і ФСГ повертаються до вихідного значення за 3 год. При постійній інфузії ГнРГ спостерігається двофазне вивільнення ЛГ, але не ФСГ. При продовженні інфузії ГнРГ секреція гонадотропінів зменшується, що може бути пов’язано з насиченістю рецепторів і неможливістю продовження стимуляції виділення вторинних месен джерів. Хоча максимальна гормональна стимуляція виникає, коли навіть невелика кількість рецепторів клітин мішеней зв’язана гормоном. При максимальній стиму ляції незайняті рецептори стають рефрактерними до зв’язування гормону протягом 12–72 год. Цей феномен знайшов широке застосування в клінічній практиці при призначенні ГнРГ.
Штучно синтезовані препарати — аналоги (агоністи) ГнРГ — мають більшу (в 15–200 разів) активність і довший період напівжиття (1, 3, 6 год), ніж ГнРГ. Агоністи спочатку стимулюють виділення гонадотропінів (спалах). Цей ефект три ває 1–3 тиж. Після того, як ГнРГ рецептори стають насиченими аналогами, що пост ійно призначаються, стимулюючий ефект періодичного вивільнення ендогенного ГнРГ у гіпофіз блокується. Цей процес дістав назву десенситизації або зворотної регуляції. Цей ефект лежить в основі клінічного призначення аналогів ГнРГ при різних стероїд гормонозалежних патологічних станах.
125

Акушерство і гінекологія. Том 1
Перший агоніст ГнРГ люпролід ацетат був застосований у 1985 р. для паліатив ного лікування раку передміхурової залози, а також лікування ендометріозу і міоми матки (3,75–7,5 мг внутрішньом’язово 1 раз на місяць).
Зусиллям щодо синтезу антагоністів ГнРГ перешкоджає розвиток алергічної ре акції, пов’язаної з вивільненням гістаміну. Синтезований потенційний ГнРГ анта гоніст Nal Glu, який викликає вивільнення гістаміну і знижує секрецію ЛГ при при значенні однією дозою, не викликає ефекту спалаху. Nal Glu інгібує овуляцію, зни жує рівень естрадіолу в середині циклу. Клінічне застосування антагоністів ГнРГ фокусується на допоміжних репродуктивних технологіях для зворотної регуляції гіпоталамо гіпофізарної осі протягом циклу стимуляції яєчників. Нові показання для застосування антагоністів ГнРГ у клінічній практиці, в тому числі для лікування лейоміоми матки, знаходяться в стадії вивчення.
Гіпофіз
Структура і функція гонадотропінів
Глікопротеїнами з високою молекулярною масою є ЛГ і ФСГ (28 000 і 37 000 дальтон, відповідно). Вони мають однакову α субодиницю (14 000 дальтон), яка складається з 90 амінокислот і є подібною до структури α субодиниці ТТГ і ХГЛ. β субодиниці цих гормонів мають різні амінокислоти і карбогідрати і відповідають за специфічну біологічну активність. Субодиниці α і β приєднуються за допомогою сульфгідрильних груп. ЛГ має період напівжиття 30 хв, а ФСГ — 3,9 год. ЛГ діє на тека клітини фолікула і стимулює синтез ними стероїдів, тимчасом як ФСГ діє пере важно на гранульозні клітини і стимулює зростання фолікулів. ФСГ виділяється в більшій кількості, ніж ЛГ до пубертатного періоду. При встановленні нормального менструального циклу секреція ЛГ перевищує виділення ФСГ. Після менопаузи співвідношення ЛГ/ФСГ знову зменшується. Це вибіркове пригнічення виділення ФСГ протягом репродуктивного періоду відбувається під дією зростаючих рівней естрадіолу та інгібіну.
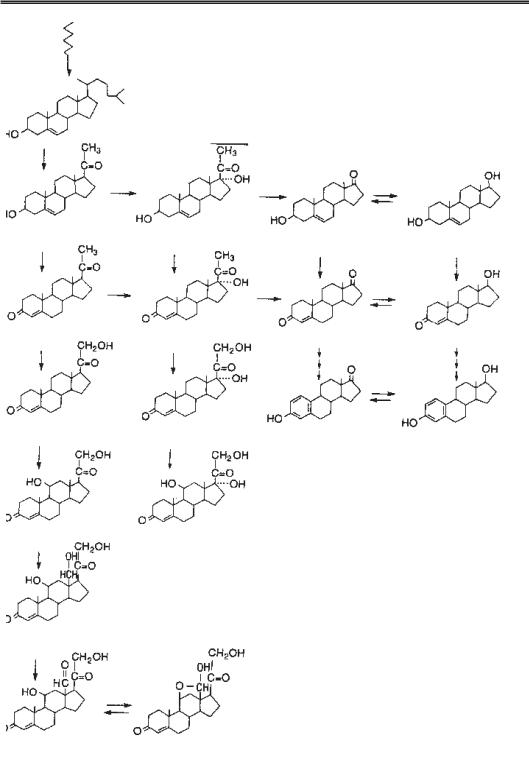
Рецептори ЛГ присутні у тека клітинах протягом усього менструального циклу, у гранульозних клітинах вони з’являються після дозрівання фолікула під впливом ФСГ і естрадіолу; вони присутні у жовтому тілі. Кожна гонадна клітина мішень має 2000– 30 000 мембранних рецепторів. Максимальна стимуляція гормональної активності відбувається, коли щонайменше 5 % цих рецепторів зв’язані з гормоном. Основною функцією ЛГ є стимуляція синтезу андрогенів тека клітинами і синтезу прогестеро ну жовтим тілом шляхом сприяння внутрішньоклітинній продукції цАМФ. Механізм дії ЛГ на гранульозні клітини остаточно не встановлений, але він, можливо, діє синергічно з ФСГ і стимулює дозрівання фолікула. ЛГ стимулює також транспорт амінокислот і синтез РНК в яєчниках. ЛГ може стимулювати овуляцію шляхом індукції активатора плазміногена, який зменшує міцність оболонки фолікула перед його розривом (рис. 4.4).
Рецептори ФСГ локалізуються переважно в мембрані гранульозних клітин. До датково до стимуляції ЛГ рецепторів на цих мембранах ФСГ активує ароматазу і 3β гідроксистероїд дегідрогеназу всередині клітин шляхом активації цАМФ. Сти муляція ФСГ ізольованих гранульозних клітин in vitro приводила до виділення не значної кількості естрогенів, але при додаванні андрогенів або тека клітин синтез естрогенів значно зростав. Ці дані підтверджують двоклітинну гіпотезу продукції
126
Розділ 4. Репродуктивна ендокринологія
а |
|
|
|
б |
|
|
|
1 |
|
|
|
|
2 |
3 |
4 |
в |
г |
д |
е |
5 |
5 |
5 |
5 |
|
2 |
3 |
4 |
ж |
з |
и |
к |
6 |
6 |
10 |
10 |
|
|||
|
|
|
4 |
л |
м |
н |
п |
7 |
7 |
Рис. 4.4. Біосинтез андрогенів, естро |
|
|
|
||
|
|
генів і кортикостероїдів: а) ацетат; б) холе |
|
|
|
стерол; в) прегненолон; г) 17α гідрокси |
|
|
|
прегненолон; д) дегідроепіандростерон; |
|
р |
с |
е) ∆ 5 андростендіон; ж ) прогестерон; |
|
з) 17α гідроксипрогестерон; и) андростен |
|||
8 |
|
діон; к) тестостерон; л) 11 деоксикортико |
|
|
стерон; м) 11 деоксикортизол; н) естрон; |
||
|
|
||
|
|
п) естрадіол; р) кортикостерон; с) корти |
|
|
|
зол; т) 18 гідроксикортикостерон; у) аль |
|
|
|
достерон. |
|
|
|
Ензими, що беруть участь у стероїдоге |
|
т |
|
незі: |
|
|
|
1 — С20 22 ліаза (десмолаза); 2 — 17α |
|
|
|
гідроксилаза; 3 —С17 20 ліаза; 4 — 17β |
|
9 |
|
гідроксистероїд оксиредуктаза (дегідроге |
|
|
|
наза); 5 — 3β |
гідроксистероїд оксиредукта |
|
|
за ∆ 5 4 ізомераза; 6 — 21 гідроксилаза; 7 — |
|
|
|
17β гідроксилаза; 8 — 18 гідроксилаза; 9 — |
|
у |
18 гідроксистероїд оксиредуктаза; 10 — |
|
ароматаза |
||
|
127

Акушерство і гінекологія. Том 1
естрогенів. Згідно з цією гіпотезою, ЛГ діє на тека клітини, що продукують андроге ни (андростендіон і тестостерон). Андрогени потім транспортуються в гранульозні клітини, де під дією ФСГ ароматизуються в естрогени (естрон і естрадіол) за допо могою ферменту ароматази.
Під дією естрогенів у гранульозних клітинах стимулюються мітози; кількість клітин збільшується. Зростає кількість рецепторів естрадіолу та ФСГ, що підтри мується внутрішньоклітинним рівнем цАМФ навіть при зменшенні рівня ФСГ у крові. В гранульозних клітинах ЛГ діє синергічно з ФСГ щодо зростання ЛГ рецеп торів та ініціації лютеїнізації фолікула, що призводить до зростання рівня прогесте рону. Передчасне вивільнення ЛГ може перервати цей процес і призвести до перед часної лютеїнізації фолікула. Здатність фолікула відповідати на дію естрогенів виз начає, досягне він зрілості чи відбудеться його атрезія.
Синтез простагландинів шляхом внутрішньоклітинної продукції цАМФ стиму лює також ЛГ. Простагландини можуть відігравати роль у розриві фолікула. Вміст простагландинів у фолікулі зростає під час підвищення рівня гонадотропінів і може призводити до стимуляції скорочення гладких м’язів. Прогестерон посилює ак тивність протеолітичних ферментів, які діють разом з простагландинами у напрямку деградації та розриву фолікула. Концентрація активатора плазміногена (АП) під дією ЛГ зростає у передовуляторному фолікулі. Призначення інгібіторів АП блокує ову ляцію.
На рівні яєчників вибір і початкове зростання фолікулів спостерігається незалеж но від гонадотропних гормонів. Хоча кількасот фолікулів, можливо, починають зро стати, більшість із них дегенерує. Не більше 30 фолікулів стають гонадотропінзалеж ними і присутні на початку менструального циклу. З них за фізіологічних умов лише декілька, з оптимальною ФСГ/ЛГ стимуляцією, відбираються для подальшого росту і розвитку. Вважають, що збереження фолікула від дегенерації під дією ФСГ досягається шляхом редукції андрогенного впливу і підтримки естрогензалежного розвитку. Спочатку це відбувається шляхом посилення продукції активіну, а потім шляхом метаболізації ЛГ індукованих текальних андрогенів у гранульозних кліти нах. Вважається, що вибір домінантного фолікула визначається його більшою чутли вістю до ФСГ і здатністю до продукції значної кількості естрогенів, а також можли вістю модулювати секрецію гонадотропінів. Домінантний фолікул зазвичай визна чається на 7 й день циклу.
Яєчники
Гонадна регуляція репродуктивної системи
факторами росту
Інсуліноподібні фактори росту (IGFs) представлені сімейством з двох пептидів: IGF І і IGF ІІ, які мають структурну подібність до проінсуліну і продукуються в різних ділянках тіла. Їх рівень у крові не змінюється протягом менструального цик лу; отже вони діють аутокринним/паракринним механізмами, зв’язуючи рецептори І і ІІ типів до IGF у різних клітинах мішенях. Рецептори типу І є більш активними. Дію IGFs на органи мішені регулює IGFs зв’язуючий протеїн (IGFBPs).
Базальний і гонадотропінзалежний стероїдогенез у тека і гранульозних клітинах стимулює IGF І. Останній сприяє ФСГ залежному зростанню рівня цАМФ, ЛГ ре цепторів, протеогліканів і базальному синтезу інгібіну в гранульозних клітинах. Пер
128
