
- •Министерство образования и науки украины
- •Вступление
- •Глава 1. Вступление к технологии
- •1.1. Понятие о технологии
- •1.2. Отрасли промышленности и их классификация
- •1.3. Понятие о производственном и технологическом процессах
- •1.4. Экономическая оценка технологического процесса
- •1.5. Типы производств и их основные технологические признаки
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 2. Сырье, топливо, вода и воздух в технологических процессах
- •2.1. Определение сырья и его классификация
- •2.2. Обогащение сырья
- •Водная взвесь измельченной руди
- •2.3. Качество сырья и современные технологические процессы
- •2.4. Виды и основные характеристики топлива
- •2.5. Основные источники и характеристики воды
- •2.6. КласСификация вод
- •2.7 Очистка и обезвреживание воды
- •2.8. Воздух в технологических процессах
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 3. Система технологий в энергетике
- •3.1. Основные виды и источники энергии
- •3.2. Система технологий тепловых электростанций
- •3.3. Система технологий гэс
- •3.4. Система технологий аэс и проблемы радиационной защиты
- •Действующие атомные электрические станции (аэс) Украины
- •3.5. Биохимические источники энергии
- •3.6. Экологически чистые нетрадиционные системы технологий энергетики
- •3.7. Солнечные электростанции
- •3.8. Геотермальные электростанции
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 4. Общая характеристика добывающей промышленности
- •4.1. Определение добывающей промышленности
- •4.2. Разновидности природных ресурсов и Способы эксплуатации
- •4.3. Добывающие предприятия и их отличительные особенности
- •4.4. Технологический и жизненный циклы добывающих предприятий
- •4.5. Горно-геологические условия разработки полезных ископаемых
- •Основные понятия
- •Химическое ингибирование вопросы для обсуждения
- •Глава 5. Добыча угля
- •5.1. Ископаемые угли, их марки и свойства
- •5.2. Способы добычи угля
- •5.3. Технология очистных работ
- •5.4. Комплексная механизация добычи угля
- •5.5. Вспомогательные технологические процессы
- •5.6. Использование угля
- •Основные понятия
- •Глава 6. Добыча нефти и газа
- •6.1. Особенности нефти и ее использование
- •6.2. Условия залегания нефти и бурение скважин
- •6.3. Извлечение нефти на поверхность
- •6.4. Хранение и транспортировка нефти и нефтепродуктов
- •6.5. Технология добычи газа
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 7. Система технологИй металлургической промышленности
- •7.1. Понятие о металлургическом заводе и комбинате
- •7.2. Исходные материалы для выплавки чугуна
- •7.3. Технология выплавки чугуна
- •Материальный баланс доменной плавки
- •Задано, кг
- •Получено, кг
- •7.4. Продукция доменного производства
- •7.5. Технология производства стали
- •7.6. Прокатное производство
- •7.7. Цветная металлургия
- •7.8. Технология порошковой металлургии
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 8. Система технологий машиностроения
- •8.1. Понятие о машиностроительном комплексе
- •8.2. Понятие о технологии машиностроения
- •8.3. Литейное производство
- •8.4. Обработка металлов резанием
- •8.5. Прогрессивные методы обработки металлов
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 9. Система технологий химической
- •9.1. Понятие о химическом производстве
- •9.2. Технология коксохимического производства
- •9.3. Технология переработки нефти
- •9.4. Производство аммиака, азотной кислоты и минеральных удобрений
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 10. Строительные материалы и изделия из них
- •10.1. Свойства строительных материалов
- •10.2. Производство цемента и его разновидности
- •10.3. Производство гипса и извести
- •10.4. Производство безобжиговых каменных материалов
- •10.5. Производство бетона, железобетона и изделий из них
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 11. Система технологий строительного производства
- •11.1. Классификация зданий и сооружений и их элементов
- •11.2. Общие принципы организации строительства
- •11.3. Современные методы производства основных строительных работ
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 12. Системы технологий важнейших продуктов питания
- •12.1. Технология производства сахара
- •12.2. Технология производства кефира
- •12.3. Технология производства муки
- •12.4. Технология производства растительных масел
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 13. Наука и научные организации
- •13.1. Понятие науки
- •13.2. Национальная Академия наук (нан) Украины
- •13.3. Научные степени, ученые и академические звания
- •13.4. Типовая структура научно-исследовательского института (нии)
- •13.5. Формирование тем научных исследований
- •13.6. Технология научных исследований
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 14. Системы технологий коммунального хозяйства
- •14.2 Канализация населенных пунктов
- •14.3. Теплоснабжение жилых помещений, учреждений, заведений
- •14.4. Газоснабжение населенных пунктов
- •14.5. Электроснабжение населенных пунктов
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 15. Бытовое обслуживание населения
- •15.1. Технология пошива одежды в ателье
- •15.2. Технология изготовления трикотажных изделий
- •Основные понятия
- •Вопросы для обсуждения
- •Глава 16. Транспорт и связь населенных пунктов
- •16.1. Транспорт населенных пунктов
- •16.2. Связь населенных пунктов
- •Основные понятия
- •Вопросы для обсуждения
- •Литература
- •Содержание
2.5. Основные источники и характеристики воды
Вода занимает важное место в жизни и деятельности человека. Распространение воды: 97,57% – в мировом океане, 2,14% – в высокогорных ледниках и полярных льдах, 0,29% – в реках и озерах, в водяных парах атмосферы – около 0,001%. Примерно 7% массы земной коры составляют подземные воды.
Для бытовых и промышленных нужд применяется только пресная вода (содержание солей до 1 г/л), составляющая 3% всех запасов воды.
Расход воды на душу населения в крупных городах США и Европы составляет 600-700л в сутки, в развивающихся странах – 50 л.
В воде содержатся почти все элементы системы Менделеева. Ее обшая масса 1,4х1018 т, в ней содержится 2,8 млрд. т урана. Если извлечь из нее только 0,01% содержащегося урана, то его хватит на 100 лет для выработки электроэнергии для всего человечества.
Качество воды определяется ее химическими и физическими характеристиками, такими как жесткость, общее солесодержание, прозрачность, окисляемость и др. Для питьевых нужд большое значение имеет количество токсичных примесей (мышьяк, стронций, радий, радиактивный уран), содержание микробов, запах, цвет и вкус. Для технических нужд важны показатели жесткости, содержание солей, механических примесей.
Жесткость воды характеризуется содержанием в ней солей кальция и магния. Различают жесткость воды трех видов: временную, постоянную и общую.
Временная (устранимая) жесткость характеризуется содержанием в воде бикарбонатов кальция и магния, которые легко удаляются из воды простым кипячением. Бикарбонаты переходят в нерастворимые углекислые соли и выпадают в виде плотного осадка.
Постоянная жесткость воды связана с присутствием в ней хлоридов, сульфатов, нитратов кальция и магния. Эти соли не удаляются при кипячении воды. Временная и постоянная жесткость в сумме дают общую жесткость. Вода имеет жесткость, равную единице, если в литре ее содержится 1 мг-экв ионов кальция или магния. Жесткость вызывает агресивность по отношению к бетону. При содержании 250 млг/л сульфатных ионов наступает разрушение бетонного камня.
Общее солесодержание или сухой остаток – масса вещества, оставшегося после испарения воды и высушивания полученного остатка при 105...110°С до постоянной массы. Сухой остаток выражается в миллиграммах на 1 литр воды.
Прозрачность воды определяется толщиной слоя воды, через который можно различить крест или шрифт определенного размера (без или с помощью фотоэлемента). В открытых районах Черного моря она равна 24...28 м.
Окисляемость воды определяется массой (в миллиграммах) перманганата калия, взаимодействующего с 1 л воды при кипячении в течение 10 минут.
Кислотность или щелочность воды характеризуется концентрацией водородных ионов или величиной pH = – 1g [H+, моль/л].
При pH = 6,5 – 7,5 вода считается нейтральной, при pH < 6,5 воду называют кислотной, при pH > 7,5 – щелочной.
И
Рис. 2.6.
Фазовая диаграмма воды Лед
Водяной
пар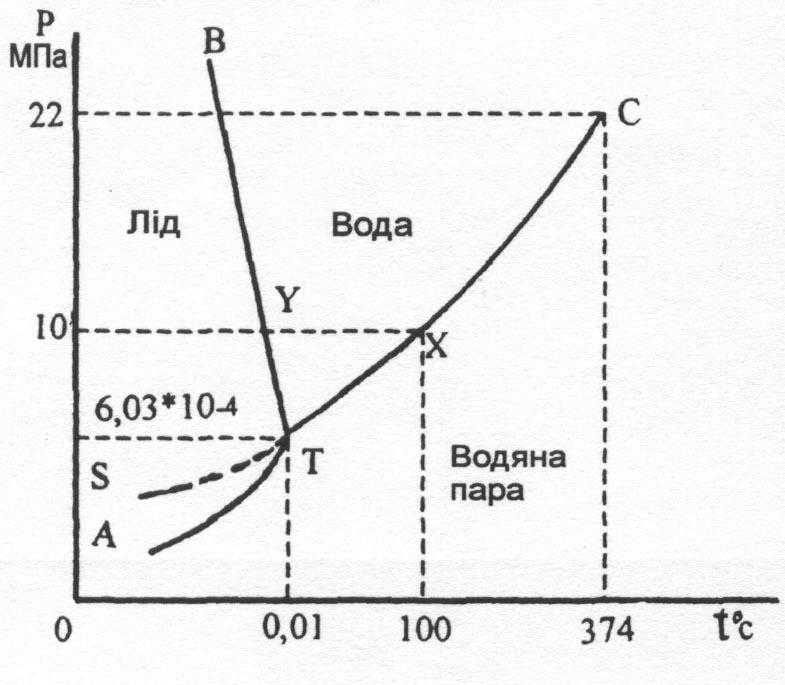
Например, при определенных значениях темпера-туры и давления, которое соответствует точкам диаг-раммы в плоскости, огра-ниченной кривыми ВТ и СТ, вода существует только в жидком состоянии, в точках ниже кривых АТ и ТС – в виде пара.
Точки на кривых соответствуют условиям, при которых две смежные фазы находятся в равновесии.
Две точки на диаграмме вызывают особый интерес. Точка Т (0,01оС и 6,03·10-4 МПа) называется тройной точкой, где в равновесии находятся одновременно три фазы: пар, вода и лед. Точка С (347оС и 22,0 МПа) называется критической. При температуре свыше 374оС пар воды нельзя преобразовать в жидкость при увеличении давления. Иными словами, при температуре и давлении свыше чем в точке С, пар и жидкость воды не различаются. Между ними не существует фазовой линии.
Диаграмма состояния воды играет исключительно важную роль при проектировании и эксплуатации паровых котлов, энергетических турбин энергосистем, автоклавов и т.д.
