
- •01. Инфекционные и паразитарные болезни A; B –
- •Острый гастроэнтерит (дизентерия, сальмонелёз)
- •Острый менингит - Meningitis acuta
- •Результаты лабораторных исследований
- •Клинический анализ крови
- •Число
- •Биохимический анализ крови
- •Число
- •Общий анализ мочи
- •Исследование ликвора
- •Число
- •Кислород
- •Лечение отека—набухания мозга на госпитальном этапе
- •Краснуха (Код Станции – 1060, МКБ –B06.9 Краснуха [немецкая корь] без осложнений)
- •Лептоспироз, Инфекционный мононуклеоз неуточненный (Код Станции – 1069, МКБ –B27.9)
- •02. Новообразования и Опухоли C; D –
- •03. Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм D
- •04. Болезни эндокринной системы, расстройства питания и нарушения обмена веществ E –
- •05. Психические расстройства и расстройства поведения F –
- •06. Болезни нервной системы G –
- •Основные клинические характеристики болезни Альцгеймера
- •Мигрень (Код Станции – 1314 , МКБ –G43.9–Мигрень неуточненная или 2109 , МКБ –G43.2–Мигренозный статус)
- •Синдром вертебробазилярной недостаточности (Код Станции – 2110, МКБ –G45.0 Синдром вертебробазилярной артериальной системы)
- •Причины развития
- •Клиническая картина вертебро базилярной недостаточности
- •Неврит лицего нерва,справа (Код Станции – 1319 , МКБ –G51.0 Паралич Белла, Примечание: Идиопатический лицевой паралич)
- •неуточненное)
- •07. Болезни глаза и его придаточного аппарата H –
- •Клиника:
- •Халязион
- •Гордеолум
- •Диагностика
- •Халязион
- •Гордеолум
- •Кератит (Код Станции – 2134, МКБ – Н16.2 – Кератоконъюнктивит.Примечание: в том числе: вызванный внешним воздействием;)
- •Резь, светобоязнь, блефароспазм, боли в области глаза, снижение зрения.
- •Диагностика
- •08. Болезни уха и сосцевидного отростка H –
- •09. Болезни системы кровообращения I –
- •Жалобы
- •Анамнез
- •Физикальное обследование
- •Основная патология
- •Электрокардиография
- •Диагноз бригады СМП
- •Лечебные мероприятия
- •Результат лечения
- •Жалобы
- •Анамнез
- •Физикальное обследование
- •Основная патология
- •Электрокардиография
- •Диагноз бригады СМП
- •Лечебные мероприятия
- •Результат лечения
- •Жалобы
- •Анамнез
- •Физикальное обследование
- •Основная патология
- •Электрокардиография
- •Диагноз бригады СМП
- •Лечебные мероприятия
- •Алкогольная кардиомиопатия (Код Станции – 2157, МКБ – I42.6)
- •Жалобы, анамнез заболевания
- •Анамнез жизни
- •Физикальное обследование
- •Основная патология
- •Диагноз бригады СМП
- •Лечебные мероприятия
- •Жалобы
- •Анамнез
- •Физикальное обследование
- •Основная патология
- •Электрокардиография
- •Брадиаритмии,Приступ Морганьи-Эдамса-Стокса (Код Станции – 2164, МКБ – I49.5 - Синдром слабости синусового узла - Примечание Синдром (тахи)брадикардии)
- •ОНМК (геморрагический инсульт)
- •ОНМК (Код Станции – 1402, МКБ –I64.9 –Инсульт, не уточненный как кровоизлияние или инфаркт)
- •Последствия ЦВЗ (Дисциркуляторная энцефалопатия. Посттравматическая энцефалопатия. Остаточные явления ОНМК)(Код Станции – 1403, МКБ –I67.8-Другие уточненные поражения сосудов мозга. Примечание: Дисциркуляторная энцефалопатия)
- •Дисциркуляторная энцефалопатия (ДЭП)
- •10. Болезни органов дыхания J –
- •Острая пневмония (Код Станции – 1438, МКБ – J12.9- Вирусная пневмония, неуточненная)
- •11. Болезни органов пищеварения K –
- •12. Болезни кожи и подкожной клетчатки L -
- •Кожный панариций
- •Подкожный панариций
- •Сухожильный панариций
- •Суставной панариций
- •Подногтевой панариций
- •Паронихий (околоногтевой панариций)
- •Костный панариций
- •Схема зон максимальной болезненности при различных видах панариция
- •13. Болезни костно-мышечной системы и соединительной ткани M -
- •14. Болезни мочеполовой системы N –
- •Острый простатит (Код Станции –1578, МКБ – N41.0)
- •Острый эпидидимоорхит (Код Станции –1581, МКБ – N45.9 -Орхит, эпидидимит и эпидидимо-орхит)
- •Дисфункциональные маточные кровотечения БДУ (Код Станции – 2338, МКБ – N93.8–Другие уточненные аномальные кровотечения из матки и влагалища)
- •15. Беременность, роды и послеродовой период O –
- •Угрожающие Преждевременные Роды.Беременность 22-23 недели (Код Станции – 1626, МКБ – O47.0- Ложные схватки в период до 37 полных недель беременности)
- •Нормальные роды (Код Станции – 1640, МКБ – O80.0 – Одноплодные самопроизвольные роды в затылочном предлежании)
- •Образец оформления карты вызова при домашних родах
- •Самопроизвольный аборт
- •Диагноз: Роды на дому
- •16. Отдельные состояния, возникающие в перинатальном периоде P -
- •17. Врожденные аномалии [пороки развития], деформации и хромосомные нарушения Q -
- •18. Симптомы, признаки и отклонения от нормы, выявленные при клинических и лабораторных
- •исследованиях, R –
- •Повышенное кровяное давление при отсутствии диагноза гипертензии (Код Станции –1702, МКБ – R03.0)
- •Лихорадка неясного генеза (Febris e causa ignota) (Код Станции – 1724, МКБ – R50.9- Лихорадка неуточненная)
- •Диагноз бригады СМП
- •19. Травмы, отравления и некоторые другие последствия воздействия внешних причин S;T-
- •Термический ожог шеи, грудной клетки 1-2 степени (Код Станции – 2667, МКБ – T20.2 Термические ожоги головы и шеи второй степени) (Код Станции – 2668, МКБ – T20.4 Химические ожоги головы и шеи (неуточненной степени)
- •Отравление нафтизином, нафазолином, ксилометазолином (у детей)
- •Нейрогенная дисфункция мочевого пузыря
- •Фимоз. Парафимоз
- •21. Факторы, влияющие на состояние здоровья и обращения в учреждения здравоохранения Z –
- •Алкогольная интоксикация (алкогольное опьянение, признаки употребления алкоголя)
- •22. Информационные таблицы и полезная информация
- •Острые болевые синдромы и их лечение
- •Тошнота, рвота
- •Раны
- •Шпаргалки по травматологии
- •ВИДЫ ПЕРЕЛОМОВ ЛУЧА (КРАТКАЯ КЛАССИФИКАЦИЯ)
- •Перелом Коллеса
- •Перелом Смита
- •КЛАССИФИКАЦИЯ ПЕРЕЛОМОВ ЛУЧЕВОЙ КОСТИ РУКИ:
- •Характеристика сыпи при заболеваниях, сопровождающихся лихорадкой.
- •Раны, ушибы, повреждения связок. Клинические примеры. Vulnera, contusiones, laesiones ligamentorum. Exempla clinica
- •Шпаргалки по неврологии
- •Транзиторная ишемическая атака (ТИА) (ПНМК)
- •Дисциркуляторная энцефалопатия (ДЭП)
- •Мигрень
- •Икота
- •Боковой амиотрофический склероз
- •Спинальный инсульт
- •Полиневриты (полиневропатии)
- •Постпункционный синдром
- •Рассеяный склероз
- •Миастения
- •Xoрea
- •Острый социальный эпидурит (эпидуральный абсцесс)

Проведение экспресс-оценки неврологического статуса по предложенному алгоритму позволяет с высокой долей уверенности судить о наличии или отсутствии повреждения центральной нервной системы.
Острые болевые синдромы и их лечение
Во всем мире острая боль является одной из наиболее частых причин обращений за скорой медицинской помощью. По данным CordeLL W. Н. и соавт. (2002), боль — причина обращения пациентов в 52% всех случаев оказания срочной медицинской помощи. В России, по данным Национального научно-практического общества скорой медицинской помощи (ННПОСМП), в течение последних трех лет общее количество вызовов скорой медицинской помощи (СМП) в связи с острой или хронической болью возросло почти на 25% [1]. Согласно имеющимся данным, в 20—25% случаев причиной экстренного обращения является выраженный болевой синдром, а в 10—15% — боль средней интенсивности [2].
В то же время адекватное обезболивание получают далеко не все пациенты с острой болью. Так, согласно исследованию McLean S. А. и соавт. (2002), полноценную, по мнению пациентов, помощь получил только 21% больных из всех, кому было проведено срочное обезболивание. Wilson J. Е. и Pendleton J. М. (1989), проведя ретроспективное исследование, обнаружили, что из 198 пациентов, обратившихся за помощью в связи с острой болью, только 44% получили помощь в отделении неотложной терапии. Более того, 62% указанных больных ждали обезболивания больше часа, а в 32% случаев обезболивание было недостаточно эффективным. Таким образом, в тех случаях, когда обезболивание проводят в рамках скорой или неотложной терапии, оно не всегда адекватно. Наиболее вероятными причинами этого считают применение неэффективных и устаревших лекарственных средств или режимов лечения, рефрактерность пациентов, часто применяющих анальгетики, ограничения в назначении эффективного лечения из-за возможного развития побочных эффектов [3].
Известно, что боль представляет собой сложный многоуровневый феномен, включающий неприятные ощущения и эмоции, связанные с действительным или возможным поражением тканей [4]. Многофакторная модель боли:
∙ноцицепция (раздражение рецепторов);
∙боль (интеграция ноцицептивных сигналов на уровне спинного мозга);
∙страдание (негативное ощущение, генерированное в ЦНС и модулированное эмоциональными ситуациями, такими, как острый или хронический стресс);
∙ болевое поведение (моторно-мотивационный ответ организма, регулируемый всеми составляющими). Согласно многофакторной модели боли, раздражение болевых рецепторов в патологическом очаге (ноцицепция) приводит к появлению у больного ряда патологических нейросоматических симптомов и специфическому поведению; это и позволяет заключить, что пациент испытывает боль. Механизмы формирования указанных нейросоматических симптомов также варьируют.
Механизмы формирования боли и ее проявление
Ноцицептивная боль (активизация болевых рецепторов):
∙отраженные боли;
∙артралгии;
∙миалгии;
∙миофасциальный синдром (триггерные точки).
Нейропатическая боль:
∙
∙туннельный синдром. Психогенная боль:
∙несоответствие жалоб и объективных признаков боли;
∙нелокализованный характер боли, ее миграция;
∙неэффективность лечения;
∙многочисленные «кризы».
Сочетание ноцицептивной боли с психогенной:
∙
В свою очередь, эмоциональная реакция больного определяется совокупностью факторов, в конечном итоге влияющих на выявление причины развития болевого синдрома: выраженностью и длительностью боли, темпераментом и психоэмоциональной конституцией пациента, его отношением к болезни и степенью самоконтроля боли и болезни в целом, качеством социальной поддержки.
Очевидно, что наиболее яркие нейровегетативные реакции сопровождают впервые возникшую острую боль, суммарная длительность которой, согласно современным классификациям, не превышает 12 недель. У пациентов с острой болью нередки бледность или покраснение кожи, холодный пот, реакция зрачков, тахикардия, повышение артериального давления, увеличение частоты и изменение ритма дыхания, изменение поведения в виде беспокойства или агрессии. При хронической боли длительностью более 12 недель к указанным выше симптомам обычно присоединяются нарушения астеноневротического круга: утомляемость, нарушения сна, снижение аппетита, потеря веса, снижение либидо, запоры, депрессия.
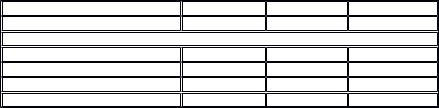
Интенсивность болевого синдрома и эффект проводимой терапии оцениваются несколькими способами (табл. 1). Наиболее распространенные из них — визуально-аналоговая шкала (ВАШ) и аналоговая шкала облегчения боли. При применении ВАШ больной отмечает уровень выраженности болевого синдрома на 100 мм шкале, где 0 — отсутствие боли, 100 — максимальная боль до и через 20 мин после введения препарата.
|
|
|
|
Таблица 1 |
|
|
|
Способы оценки интенсивности болевого синдрома |
|
|
|
|
|
|
|
Способ |
|
Градация боли |
Когда используется |
|
|
|
|
Общая пятизначная шкала |
0 |
— нет боли |
При оценке / обследовании в обычных условиях |
|
1 |
— слабая ( чуть - чуть ) |
|
|
2 |
—умеренная ( болит ) |
|
|
3 |
— сильная ( очень болит ) |
|
|
4 |
— невыносимая ( нельзя терпеть ) |
|
|
|
|
|
Словесная количественная шкала |
0... 5... 10 |
При оценке / обследовании в обычных условиях |
|
|
Нет боли — невыносимая боль (какое число соответствует боли?) |
|
|
|
|
|
|
Визуальная аналоговая шкала (линия длиной 10 см , скользящая линейка) |
Нет боли — невыносимая боль (отметьте на линии, насколько сильна боль) |
При оценке / обследовании в обычных условиях . |
|
|
|
|
Может применяться у детей старше б лет |
|
|
|
|
Неосознаваемые поведенческие и психологические параметры (не являются |
Мимические гримасы, стоны, повышение голоса, бледность, потливость, |
При оценке / обследовании больных в бессознательном состоянии, аутичных |
|
специфичными, а свидетельствуют об остром нарушении) |
слезотечение, расширение зрачка, тахикардия, гипертензия, дискоординация |
и критических больных |
|
|
дыхания |
|
|
|
|
|
|
Оценка жизненно важных функций больного врачом |
В соответствии с общими принципами . Важно оценить, может ли пациент |
Соотнести с субъективными оценками, cледует использовать у всех |
|
|
контролировать произвольные функции организма (кашель, глубокое |
|
|
|
дыхание и т. д.) |
|
|
|
|
|
|
Для оценки эффективности проведенного обезболивания используют аналоговую шкалу оценки выраженности боли в баллах. Через 20 мин после введения препарата пациенту задают вопрос: «Уменьшилась ли интенсивность боли после введения препарата по сравнению с болью до введения препарата?» Возможные варианты ответа оценивают в баллах: 0 — боль не уменьшилась, 1 — немного уменьшилась, 2 — уменьшилась, 3 — сильно уменьшилась, 4 — исчезла полностью. Для оценки эффективности обезболивания важно также измерять латентное время обезболивания — время от введения препарата до наступления отчетливого обезболивающего эффекта.
Выбор средств для догоспитальной терапии острой боли базируется на следующих принципах:
1.возможность получения отчетливого клинического эффекта при однократном применении у большинства больных;
2.быстрое наступление эффекта;
3.управляемость и обратимость эффекта;
4.возможность парентерального или сублингвального введения или при необходимости получения местного эффекта без развития резорбтивного действия;
5.минимальная вероятность развития нежелательного действия или неблагоприятного взаимодействия с другими лекарствами, как назначаемыми одновременно, так и принимаемыми пациентами самостоятельно или по назначению врача;
6.экономическая эффективность с учетом госпитализаций, повторных вызовов, в том числе специализированных бригад.
Таким образом, для выбора оптимального для применения на догоспитальном этапе обезболивающего средства необходимо знать основные фармакологические параметры препарата: силу обезболивания, основной механизм действия (уровень влияния с позиций многофакторной модели боли), быстроту развития эффекта, возможность различных способов введения, основные пути метаболизма и варианты нежелательного фармакологического взаимодействия, перечень возможных побочных эффектов.
Среди обезболивающих средств, не являющихся наркотиками, указанным выше требованиям в современной медицинской практике соответствуют несколько препаратов, каждый из которых обладает своими фармакологическими и экономическими параметрами (табл. 2).
Таблица 2
Безопасность применения различных НПВП на догоспитальном этапе
Нежелательные явления |
Диклофенак, Кеторолак, п Лорноксикам, |
||
|
п =153 |
=318 |
п =95 |
Метеоризм |
Общие |
|
|
|
|
|
|
Диарея |
|
1 |
|
Рвота |
|
1 |
|
Анорексия |
|
|
|
Тошнота |
1 |
|
|
Головокружение |
1 |
2 |
|
Головная боль |
|
|
1 |
Сонливость |
|
1 |
1 |
165
Дискомфорт в эпигастрии |
1 |
3 |
|
Всего |
3 (2%) |
8 (2,5%) |
2 (2,1%) |
Местные |
|
|
|
Боль 8 месте инъекции |
12 |
5 |
1 |
Инфильтрат в месте инъекции |
|
|
|
Некроз в месте инъекции |
1 |
|
|
Всего |
13 (8,5%) |
5 (1,6%) |
1 (1%) |
Метамизол натрия (анальгин, баралгин) используется в практической медицине с 1922 г., обладает центральным и периферическим обезболивающим, жаропонижающим, противовоспалительным и спазмолитическим эффектами [5]. Известно, что метамизол подавляет синтез брадикининов и проста-гландинов, препятствует проведению болевых экстеро- и проприоцептивных импульсов по проводящим путям ЦНС, повышает порог возбудимости таламических центров болевой чувствительности, увеличивает теплоотдачу. Метамизол применяют при болях различного генеза: при головной боли, невралгии и скелетно-мышечной боли, почечной колике и лихорадочных состояниях. Вводят внутривенно медленно или глубоко внутримышечно, максимальная разовая доза — 1000 мг, максимальная суточная — 2000 мг. Из побочных эффектов наиболее часты лейкопения, агрануло-цитоз, аллергические реакции, при внутримышечном введении возможны постинфекционные инфильтраты [7]. Метамизол противопоказан больным с тяжелым нарушением паренхиматозных органов, нарушением кроветворения, при беременности и кормлении грудью, детям первого года жизни, пациентам с реакциями гиперчувствительности на метамизол в анамнезе.
Несмотря на то что частый или непрерывный прием метамизола сопряжен с высоким риском тяжелых побочных эффектов, препарат традиционно остается в России основным средством для срочного обезболивания. Установлено, что в России на 1000 вызовов бригад СМП расходуется до 3—5 л анальгина. Метамизол используют в качестве анальгетика в Австрии, Бельгии, Франции, Германии, Италии, Нидерландах, Испании, Швейцарии, Южной Африке, Латинской Америке, Израиле и Индии. В то же время 34 страны мира полностью прекратили или частично ограничили продажу этого препарата, а в США, Норвегии, Великобритании, Нидерландах, Швеции его применение запрещено еще в середине 70-х годов. Причиной столь радикального запрета является невозможность оценки неконтролируемого употребления препарата населением, хотя органы здравоохранения не оспаривают высокой эффективности и достаточной безопасности метамизола при редком или однократном назначении у больных, не переносивших реакций гиперчувствительности к препарату. В России метамизол включен в Список лекарственных средств, разрешенных к медицинскому применению приложением к приказу Минздрава СССР № 155 от 28.02.72, с 2000 г. его употребление ограничено у детей и подростков до 18 лет. Таким образом, риск развития побочных эффектов метамизола при догоспитальной терапии боли тесно связан с изучением в каждом конкретном случае фармакологического анамнеза больного с острым болевым синдромом.
При боли спастического генеза анальгезию часто проводят, используя комбинацию анальгина и спазмолитика. Применение готовых комбинированных препаратов не только упрощает лечение, но и повышает эффективность обезболивания и безопасность терапии, поскольку каждый компонент ослабляет побочные эффекты друг друга или же побочные эффекты каждого компонента зависят от его дозы. Примером такого комбинированного средства служит ревалгин: 1 мл раствора для инъекций содержит 500 мг метамизола натрия, 2 мг гидрохлорида пито-фенона, 0,02 мг бромида фенпивериния. Показаниями к применению ревалгина служат спазмы гладкой мускулатуры: почечная, желчная колики [6]. По данным Sanahuja J. и соавт. (1990), проведших сравнительное двойное слепое исследование 57 пациентов с почечной коликой, комбинация метамизола и двух спазмолитиков (баралгин 5,0 внутривенно) оказывала такой же эффект, как и диклофенак (75 мг внутримышечно) [7]. Но, как и другие лекарственные средства с атропиноподобной активностью, препарат противопоказан при глаукоме и доброкачественной гиперплазии предстательной железы.
Диклофенак натрия (вольтарен, ортофен), кеторолак (кеторол) и лорноксикам (ксефокам) входят в группу нестероидных противовоспалительных препаратов (НПВП). Все НПВП обладают болеутоляющим, противовоспалительным, жаропонижающим и антиагрегационным эффектом. Препараты действуют путем неселективного ингибирования циклооксигеназы — основного фермента метаболизма арахидоновой кислоты, необходимого для синтеза простагландинов и медиаторов боли и воспаления. По данным Кукеса В. Г. (1999), по убыванию анальгезирующего действия указанные средства можно расположить в такой последовательности: кеторолак > лорноксикам > диклофенак > анальгин [8].
Диклофенак — наиболее широко используемый препарат из группы НПВП — признан «золотым стандартом» эффективности и эталоном безопасности. Помимо периферического предполагается наличие у препарата центрального механизма обезболивающего действия. Однако установлено, что новый препарат — лорноксикам — обладает в 100 раз большей способностью ингибировать циклооксигеназу и подавлять синтез простагландинов, чем диклофенак. Благодаря быстрому достижению (через 15 мин после внутривенного введения) максимальной концентрации в плазме лорноксикам демонстрирует высокую эффективность при почечной колике, послеоперационной боли и болевом синдроме, обусловленном дегенеративно-дистрофическими заболеваниями позвоночника. При плановом лечении пациентов с хронической болью в спине лорноксикам в дозе 8 мг в сутки в течение 14 дней приводил к облегчению болей у 80%, не уступая по эффективности диклофенаку в дозе 50 мг два раза в сутки [9].
Из всех НПВП кеторолак, по-видимому, оказывает наиболее выраженное действие при боли различного генеза [1]. В Северной Америке, Великобритании, некоторых других европейских странах и Гонконге кеторолак является единственным нестероидным противовоспалительным препаратом, используемым для лечения болевого синдрома в виде быстрого внутривенного введения. Показано, что при внутримышечном введении 30 мг препарат оказывает действие, сопоставимое с эффектом 10—12 мг морфина или 50 мг мепередина [10]. При почечной колике внутривенное введение 30 мг кеторолака оказывало такой же обезболивающий эффект, как и внутривенное введение 2,5 г метамизола в комбинации со спазмолитиками, при меньшем количестве побочных эффектов [11]. Преимущество кеторолака по сравнению с наркотическими анальгетиками — в отсутствии влияния на функцию дыхания, седативного и психомоторного действия.
На фоне терапии диклофенаком побочные эффекты встречаются редко, чаще наблюдают головную боль, аллергические реакции, боль в животе. Описаны редкие случаи развития гемолитической анемии, некротизирующего фасциита и некроза мягких тканей в месте внутримышечного введения препарата. Из-за возможности подобных осложнений целесообразно вообще избегать внутримышечного введения диклофенака [1].
Общий и опасный для жизни побочный эффект всех неселективных НПВП — их способность вызывать диспепсию и острое эрозивно-язвенное поражение слизистой оболочки желудка и двенадцатиперстной кишки (НПВПгастропатию). При плановом лечении (более месяца) диспепсия развивается у 30—40%, а язва или эрозии желудка — у 10—20% больных [8]. Важно помнить, что ульцерогенное действие НПВП у чувствительных к нему пациентов развивается на любом этапе введения препаратов в организм. Однако по выраженности ульцерогенного действия и сопряженного с ним риска острого желудочно-кишечного кровотечения НПВП варьируют: среди рассматриваемых в настоящей статье препаратов наибольший риск желудочно-кишечного кровотечения связан с кеторолаком, а наименьший — с диклофенаком [12]. Доказано, что вероятность развития желудочно-кишечного кровотечения выше у пациентов так называемой группы риска.
Основные факторы риска развития НПВП-гастропатии, по данным исследования ARAMIS (Fries 3. Т., 1997):
∙язвенная болезнь в анамнезе;
∙возраст старше 65 лет;
∙сопутствующий прием кортикостероидов.
Побочные эффекты на фоне плановой терапии лорноксикамом возникают в 25% случаев, при этом у 16% пациентов возникают жалобы со стороны ЖКТ. Таким образом, лорноксикам переносится не хуже, чем другие НПВП. Лорноксикам и кеторолак, как и аспирин и диклофенак, угнетают функцию тромбоцитов. Это нежелательное действие НПВП также является фактором, способствующим развитию послеоперационного и желудочно-кишечного кровотечения на фоне лечения. Однако в этой связи важно помнить, что рисклюбых нежелательных реакций на лечение НПВП резко возрастает по мере увеличения продолжительности лечения и у пациентов с тяжелыми сопутствующими заболеваниями (почечной недостаточностью, недостаточностью кровообращения). У больных, не входящих в группу особого риска, вероятность и клиническое значение побочных эффектов при обезболивании НПВП в течение 1—3 суток невелики и случаются реже, чем при назначении опиоидов. Тем не менее противопоказания к применению лорноксикама и кеторолака включают повышенную чувствительность к аспирину и другим НПВП, аллергию, высокий риск желудочного кровотечения, нарушения свертываемости крови, почечную или печеночную недостаточность, а также детский возраст (до 16 лет).
Согласно нормативным документам (Приложение 13 к приказу Минздрава РФ от 26 марта 1999 г. № 100 «Примерный перечень оснащения выездной бригады скорой медицинской помощи»), в минимальный перечень обезболивающих средств на СМП входят следующие препараты:
∙2.20. Наркотические анальгетики:
—морфин (долтард) 1% — 1 мл, 2 ампулы;
—омнопон 1% — 1 мл, 2 ампулы;
—промедол 2% — 1 мл, 2 ампулы;
—фентанил 0,005% — 2 мл, 2 ампулы.
∙2.21. Ненаркотические анальгетики:
—метамизол натрий (анальгин) 50% — 2 мл, 4 ампулы;
—трамадол (трамал) — 1 мл, 2 ампулы (опиоидный анальгетик со смешанным механизмом действия);
—морадол — 1 мл, 2 ампулы (агонист-антагонистопиоидных рецепторов).
Метамизол натрия (баралгин) также указан в статье.
∙2.27.Спазмолитики:
—аминофиллин (эуфиллин) 2,4% — 10 мл, 2 ампулы;
—бендазол (дибазол, глиофен) 1% — 5 мл, 5 ампул;
—дротаверин (но-шпа) 2% — 2 мл,
3 ампулы;
—магния сульфат 25% — 10 мл, 5 ампул;
—метамизол натрия (баралгин) — 2 мл, 2 ампулы;
—папаверина гидрохлорид (или платифиллин) 2% — 2 мл, 5 ампул.
Согласно данным ННПОСМП, в России в практике скорой помощи наиболее частыми причинами остро развившегося болевого синдрома являются боль в спине, почечная колика, онкогенная боль.
Боль в спине (БС)
БС — это болевой синдром в спине (в международной литературе — дорсалгия), развившийся вследствие дистрофических, воспалительных и функциональных изменений в тканях позвоночно-двигательных сегментов и смежных структур: в дугоотростчатых суставах позвонков, межпозвонковом диске, фасциях, мышцах, сухожилиях и связках. Наиболее часто развивается вследствие поражения нижних шейных позвонков с последующим поражением лучевого нерва или пояснично-крестцового отдела позвоночника с развитием синдрома боли в нижней части спины (low back pain).
Основной причиной первичной БС является спондилоартроз, для которого характерна двусторонняя, паравертебральная боль — артралгия, усиливающаяся при длительном стоянии и разгибании, уменьшающаяся при ходьбе и в положении сидя. По основному механизму развития боль при спондилоартрозе преимущественно ноцицептивная. В не-осложненных случаях поражение пояснично-крестцового отдела позвоночника приводит к развитию хорошо очерченного симптомокомплекса, позволяющего поставить диагноз спондилоартроза уже на догоспитальном этапе. Именно спондилоартроз — самая частая причина доброкачественных болей в пояснице улиц пожилого возраста. Признаки неосложненной механической боли в нижней части спины:
—боль зависит от физической активности (уменьшается после отдыха);
—внезапный приступ, провоцируемый подъемом тяжестей или поворотом;
—рецидив эпизодов;
—возраст 20—55 лет;
—боль локализуется в спине в верхней части бедра;
—отсутствие изолированного повреждения нервного корешка;
—нормальное общее состояние;
—хороший прогноз (в 90% случаев — выздоровление в течение 6 недель).
Миофасциальный синдром как причину первичной БС диагностируют в случае хронической локальной или региональной, ограничивающей движение мышечной боли, при наличии триггерных точек, локальном напряжении мышц, отсутствии двигательных и чувствительных нарушений. Нейропатическая боль возникает вследствие предшествующего или сопутствующего повреждения центральной нервной системы. Она может развиваться и сохраняться при отсутствии явного периферического болевого раздражителя, часто плохо локализована и сопровождается различными нарушениями поверхностной чувствительности. По сравнению с ноцицептивной нейропатическая боль существенно менее восприимчива к действию опиоидных анальгетиков. Острую первичную скелетно-мышечную БС необходимо дифференцировать с вторичной БС, развивающейся на фоне врожденных аномалий или травм позвоночника, опухолевого процесса, остеопороза, инфекционных заболеваний и патологии внутренних органов.
Дифференциальный диагноз боли в спине:
∙инфекционные заболевания (туберкулезный или неспецифический спондилит, эпидуральный абцесс);
∙воспалительные заболевания (серо негативные спондилоартропатии, ревматическая полимиалгия);
∙метаболические заболевания (остеопороз, гиперпаратиреоз, болезнь Педжета);
∙неопластические заболевания (первичные и метастатические опухоли позвоночника, множественная миелома);
∙соматические заболевания (аневризма или тромбоз аорты, заболевания поджелудочной железы, мочеполовой системы, желудочно-кишечного тракта, патология забрюшного пространства, гинекологические заболевания).
Таким образом, пациента с острой болью в спине, независимо от причины и уверенности в диагнозе необходимо срочно госпитализировать.
Почечная колика
При почечной колике острая боль является результатом острого нарушения оттока мочи из почки, что приводит к развитию чашечно-лоханочной гипертензии, рефлекторному спазму артериальных почечных сосудов, венозному стазу и отеку паренхимы, ее гипоксии и перерастяжению фиброзной капсулы. Причиной острой боли у пациентов, страдающих мочекаменной болезнью, нередко становится уретеролитиаз или мочеточниковая колика. Окклюзия мочеточника может развиться также при стриктурах, перегибах и перекрутах мочеточника, при обтурации его просвета сгустком крови, слизи или гноя, казеозными массами при туберкулезе почки, отторгнувшимся некротизированным сосочком. Почечная колика протекает с интенсивными коликообразными, периодическими болями, сопровождающимися тошнотой и рвотой. Боли часто иррадиируют по ходу мочеточника в паховую область и половые органы, сопровождаются вздутием живота и беспокойством пациентов. Больные пытаются искать удобную позу, но не находят комфортного положения. Беспокойное поведение специфично для почечной колики и отличает ее от острых хирургических заболеваний органов брюшной полости. Обычно при почечной колике выявляются гематурия и расстройство мочеиспускания. Основной проблемой адекватного догоспитального обезболивания при почечной колике является много раз упоминаемая "боязнь исказить клиническую картину заболевания в случае неверного диагноза СМП, если у больного на самом деле наблюдается острое хирургическое заболевание". Однако, по данным ряда специалистов в абдоминальной хирургии, указанный тезис вовсе не аксиома. Аргументы в пользу срочного эффективного обезболивания пациентов с вероятным догоспитальным диагнозом почечной колики следующие:
∙симптомокомплекс почечной колики является достаточно очерченным и в большинстве случаев вызван наличием в анамнезе гиперурикемии или мочекаменной болезни;
∙поведение больного с почечной коликой настолько беспокойное, что не позволяет не только исследовать пациента, но и обеспечить его транспортировку в стационар;
∙эффективное обезболивание при почечной колике не предполагает назначения морфина и других опиоидов, способных исказить клинические проявления "острого живота".
Согласно литературным данным, у больного с почечной коликой для обезболивания целесообразно применять метамизол в качестве монотерапии или в комбинации со спазмолитиками, НПВП быстрого действия — лорноксикам или кеторолак. Как уже говорилось, критерием отказа от назначения метамизола служит неблагоприятный фармакологический анамнез, критерием отказа от назначения НПВП — наличие указанных выше противопоказаний.
Как известно, для обезболивания на догоспитальном этапе в России традиционно применяется метамизол, более современные препараты из группы НПВП используются редко. Лишь единичные работы посвящены оценке сравнительной эффективности и безопасности ненаркотических анальгетиков и НПВП в парентеральной форме при болевом синдроме различного генеза. Сравнительный анализ эффективности, безопасности, а также экономической эффективности применения различных НПВП на догоспитальном этапе был проведен ННПОСМП в 2003-2004 гг. В исследование вошел 991 пациент в возрасте 54,8±0,46 года, все они обратились на СМП с жалобами на острую боль. Из принявших участие в исследовании 533 пациента (54,7%) обратились за неотложной помощью в связи со скелетно-мышечной болью, 244 (24,1%) — по поводу травмы, 214 (21,2%) — с почечной коликой (рис. 1).
В связи с острой болью пациентам методом случайного выбора назначали терапию диклофенаком натрия (вольтареном) 3,0 2%-ного раствора в/м, кеторолаком (кетановом) 1,0 (30 мг) в/м, лорноксикамом (ксефокамом) 8 мг в/м. Анальгезирующая эффективность препаратов оценивали по ВАШ и аналоговой шкале оценки интенсивности боли в баллах от 1 до 5. По ВАШ из исследуемых препаратов наилучшей анальгетической эффективностью обладал лорноксикам, наихудшей — диклофенак (рис. 2).
Идентичные данные получились при оценке эффективности по 5-балльной шкале. Наименьшее время обезболивания было у лорноксикама, наибольшее — у диклофенака. По времени наступления обезболивания данные препараты можно расположить следующим образом: лорноксикам жеторолак > диклофенак (рис. 3).
Частота повторных вызовов по поводу скелетно-мышечной боли была высока при приеме диклофенака, а при приеме кеторолака и лорноксикама повторные вызовы были значительно реже (рис. 4).
Эффективность изученных препаратов существенно различалась при болевом синдроме разного генеза. Динамика интенсивности скелетно-мышечной боли по ВАШ в группе диклофенака составила 57,7±4,б мм, кеторолака — 69,3±1,9 мм, лорноксикама — 70,8±4,7 мм (рис. 5). При почечной колике (рис. 6) динамика интенсивности боли на фоне лечения диклофенаком — 72,4±4,7 мм, кеторолаком — 57,8±3,б мм, а лорноксикамом — 77,8±4 мм. Динамика острой боли травматического генеза на фоне лечения диклофенаком — 60+4,6 мм, кеторолаком — 77,8±1,9 мм, а лорноксикамом — 68,0±4,7 мм (рис. 7).
При оценке безопасности наиболее надежным оказался лорноксикам, а наибольшее количество осложнений выявлено на фоне лечения диклофенаком (табл. 2).
166

При анализе фармакологической эффективности лечения оказалось, что затраты на единицу эффективности препарата зависят не только от его первоначальной стоимости, но и от эффективности обезболивания и частоты возникновения побочных эффектов. По затратам на единицу эффективности препарата наилучшая позиция оказалась у кеторолака (табл. 3).
Таблица 3
Фармаккоэкономический анализ лечения (КЭ - боль не менее 50%)
Показатель |
Диклофенак, |
Кеторолак, п |
Лорноксикам, |
|
п =153 |
=318 |
п =95 |
|
|
|
|
Количество единиц лекарства |
1 ампула (3 мл |
1 ампула (3 |
1 флакон (8 |
|
, 75 мг ) |
мл , 30 мг ) |
мг ) |
|
|
|
|
Стоимость единицы лекарства , |
36,36 |
10,86 |
97,23 |
руб . |
|
|
|
|
|
|
|
Количество повторных вызовов |
9 |
11 |
3 |
|
|
|
|
Стоимость повторных вызовов , |
7200 |
8800 |
2700 |
руб . |
|
|
|
|
|
|
|
Общая стоимость лечения , руб |
12763,08 |
12253,48 |
11936,85 |
. |
|
|
|
|
|
|
|
Средние затраты на одного |
83,42 |
38,53 |
125,65 |
пациента ( С ), руб . |
|
|
|
|
|
|
|
Эффективность (Ef),% |
69,9 |
82,4 |
87 |
|
|
|
|
Затраты на единицу |
1,19 |
0,46 |
1,44 |
эффективности ( CEA = C / Ef ), |
|
|
|
руб . |
|
|
|
Таким образом, лорноксикам оказался наиболее эффективным при почечной колике и скелетно-мышечной боли, кеторолак— при травме. У лорноксикама и кеторолака приблизительно одинаковы время наступления отчетливого обезболивания и частота повторных вызовов по поводу купирования боли. Лорноксикам редко вызывает нежелательные явления. Кеторолак — наиболее экономичный препарат (табл. 4).
Таблица 4
Сравнительная характеристика НПВП при догоспитальной терапии острых болевых синдромов
Показатель |
Диклофенак , п =153 |
Кеторолак , п =318 |
Лорноксикам , п =95 |
Эффективность в целом |
+ |
|
|
Эффективность при скелетно - мышечной боли |
+ |
|
++++ |
Эффективность при травме |
|
|
++ |
Эффективность при почечной кол и ке |
++ |
+ |
+ ++ |
Безопасность |
++ |
|
|
Стоимость |
|
|
+ |
Онкогенная боль
Ежегодно в мире выявляют около 6 млн. новых случаев онкологических заболеваний, в основном у пациентов старшего возраста. В нашей стране из 500 тыс. случаев с впервые установленным диагнозом злокачественного образования у 20% пациентов диагностируют IV стадию болезни и 30% больных умирают в течение первого года. Установлено, что около 4 млн. онкологических больных ежегодно страдают от болей разной интенсивности. При этом около 40% больных с промежуточными стадиями процесса и 60—87% с генерализацией заболевания испытывают боли отумеренных до сильных.
Помимо развития стойких болей при поражении позвоночника и других отделов опорно-двигательного аппарата у пациентов с онкологическими заболеваниями развиваются стойкие боли, обусловленные деструкцией нервных стволов, внутренних органов и синовиальных оболочек. Тем не менее интенсивность болевого синдрома у онкологических больных прямо не зависит от типа и распространенности поражения тканей и в большинстве случаев — результат суммирования ноцицептивной и невропатической боли. У подавляющего большинства пациентов собственно онкологическая боль развивается в далеко зашедших стадиях заболевания и по сути является персистирующей острой болью. Кроме того, у получающих специфическое лечение онкобольных упорная боль может s том числе развиться в исходе противораковой терапии, при присоединении инфекции или позднего метастазирования.
На догоспитальном этапе лечение пациентов с онкологическим заболеванием сопряжено с рядом трудностей. В первую очередь это обусловлено сложностью внеклинической оценки параметров полиэтиологичной онкогеннои боли, а также отсутствием на СМП регламентации и опыта применения современных эффективных ненаркотических анальгетиков и адъювантных средств у онкологических больных с различной распространенностью бластоматозного процесса. Таким образом, на практике эффективное обезболивание, которое в соответствии с законодательством должно быть бесплатным, оказывается недоступным для большинства онкологических больных, еще не получающих наркотических анальгетиков. С другой стороны, онкологические больные, находящиеся на амбулаторном лечении, нуждаются в перманентном контроле и при необходимости в коррекции терапии, профилактике и устранении нежелательного действия обезболивающих средств.
Согласно рекомендациям ВОЗ, выбор средств для анальгезии базируется на выраженности онкогенной боли. ВОЗ предлагает «шаговую» схему обезболивания онкологических больных, в соответствие с которой сила анальгезии увеличивается постепенно, от 1-го к 4-му уровню, что позволяет достичь удовлетворительного обезболивания у 90% пациентов [13]:
∙1-й уровень: неопиоидные препараты;
∙2-й уровень: неопиоидные препараты + слабые опиоиды;
∙3-й уровень: неопиоидные препараты + сильные опиоиды;
∙4-й уровень: инвазивные методы обезболивания — спинальная анальгезия, использование подкожных аппликаторов и т.д.
Всоответствии с концепцией шаговой терапии ВОЗ предложены рекомендации по комплексной плановой терапии боли у пациентов с верифицированным онкологическим заболеванием, находящихся за пределами стационара (табл. 5).
Таблица 5 |
|
|
Рекомендации ВОЗ по купированию онкогеннои боли |
|
|
Шаги |
Анальгетики и адъювантные средства |
Препараты |
I. Умеренная боль |
Периферические анальгетики |
Парацетамол, метамизол (анальгин) |
II . Сильная боль (шаг I неэффективен) |
Периферические анальгетики+анальгетики центрального действия |
Парацетамол, метамизол + пентазоцин (фортрал, фортвин) |
IIIа. Более сильная боль (шаг II неэффективен) |
Легкие опиоиды |
Трамадол (трамал), тилидин |
IIIb *. Более сильная боль (шаг Ша |
Нейролептики и/или антидепрессанты |
Левопромацин , кломипрамин |
неэффективен) |
|
|
IV . Сильнейшая , нестерпимая боль (шаг III |
Опиоиды |
Бупренорфин (бупранал), морфин |
неэффективен) |
|
|
* Нейролептики и/или антидепрессанты могут быть добавлены к любому шагу World HeaLth Organization . Cancer pain relief and palliative care: Report on a WHO expert committee, 1990. Geneva ( Switzerland ). |
||
Традиционное лекарственное оснащение СМП позволяет провести адекватное обезболивание онкологических больных. Тем не менее в практике СМП практически отсутствует опыт применения у онкологических больных современных НПВП с коротким периодом полувыведения (обеспечивающим быстрое развитие и «управляемость» эффекта) и выраженным анальгетическим действием, таких, как лорноксикам.
В целях оценки эффективности и безопасности лорноксикама при догоспитальной терапии онкогенной боли ННПОСМП в 2004 г. было проведено многоцентровое открытое исследование «Применение лорноксикама у онкологических больных на этапе СМП». В исследование вошли 50 пациентов в возрасте 69+11 лет с верифицированным онкологическим заболеванием, обратившихся на СМП по поводу сильного болевого синдрома и не получающих системные наркотические анальгетики. При оказании СМП пациентам однократно в зависимости от тяжести болевого синдрома внутривенно вводили 8 мг или 16 мг лорноксикама. Эффект оценивали по ВАШ исходно и через 20 мин после лечения, по длительности времени от введения лорноксикама до появления выраженного обезболивания. Кроме того, пациенты определяли эффективность анальгезии по пятибалльной шкале через 20 мин и 60 мин после введения препарата и сравнивали эффективность однократного введения лорноксикама и препарата, который они принимали раньше. Из 50 пациентов, принявших участие в исследовании, у 34% больных был рак желудка, у 26% больных — рак легких, у 10%, 14% и 16% — рак матки, поджелудочной железы и молочной железы соответственно.
До назначения лорноксикама пациенты наиболее часто применяли трамал и баралгин. Динамика интенсивности болевого синдрома после однократного введения лорноксикама по ВАШ составила 54 балла, эффективность по 5- балльной шкале через 20 мин — 3,4, а через 60 мин — 4,4 (рис. 8).
По субъективной оценке пациентов, лорноксикам при однократном введении оказался достоверно эффективнее, чем любой из анальгетиков, ранее применявшихся (рис. 9). Значит, можно сделать следующие выводы:
∙лорноксикам — эффективное и безопасное средство догоспитального лечения боли у онкологических больных, не получающих наркотические анальгетики;
∙все пациенты, получавшие лорноксикам на догоспитальном этапе, оценили эффективность его однократного введения выше, чем любого другого ненаркотического анальгетика;
∙ни в одном случае применение лорноксикама у онкобольных на догоспитальном этапе не привело к развитию значимых побочных эффектов;
∙ни один пациент, однократно получивший лорноксикам, в течение суток не вызывал СМП повторно.
Очевидно, что на любом этапе лечения эффективность обезболивания у онкологических больных может быть усилена применением адъювантных средств. К адъювантным средствам относят не только препараты, потенциирующие действие анальгетиков (психотропные, снотворные и т.д.), но и средства для коррекции побочных эффектов (глюкокортикоиды, антибиотики, противокислотные и обволакивающие и т.д.).
Таким образом, на догоспитальном этапе у каждого пациента поиск показаний, выбор препаратов и режимов обезболивания должны базироваться на рекомендациях ВОЗ, ориентированных именно на внегоспитальную помощь онкологическим больным. Однако адъювантные средства специалисты СМП могут применять только для лечения сопутствующих неотложных состояний или в целях коррекции нежелательного действия обезболивающих препаратов.
Е. И. Горулева, А. Л. Верткин, Е. И. Вовк ННПОСМП, ГКБ № 50, МГМСУ, Москва Взято с сайта http://www.medafarm.ru
хронические болевые синдромы, в том числе фибромиалгия. альгонейродистрофия;
Тошнота, рвота
Тошнота (nausea) — это неприятное, болезненное субъективное ощущение, предшествующее рвоте или сопутствующее ей. Рвота (vomitus) — защитный рефлекс, направленный на удаление содержимого ЖКТ.
Срыгивание - разновидность рвоты у детей первого года жизни, которое возникает после кормления, без усилия, то есть без напряжения брюшного пресса. Извержение желудочного содержимого при этом не отражается ни на поведении ребенка, ни на его настроении.
КЛАССИФИКАЦИЯ Центральная (мозговая, нервная) рвота.
Тяжелая ЧМТ, нейроинфекция, развитие опухолевого процесса, мигрень.
Гематогенно-токсическая рвота
почечная недостаточность, кетоацидоз, отравления.
Висцеральная, (собственно рефлекторная)
поражение органов ЖКТ (гастрит, язвенная болезнь желудка, холецистит, ЖКБ и др.)
Наиболее частые причины рвоты у детей
Инфекция ЦНС (менингит, менингоэнцефалит) (дети первого года жизни); Инфекция ЖКТ (гастрит, гастроэнтерит); Средний отит; Инфекции мочевыделительной системы ЧМТ; Отравления
Менее частые причины рвоты у детей
Острая кишечная непроходимость (пилоростеноз); Метаболические нарушения (кетоацидоз);
Заболевания ЦНС, сопровождающиеся внутричерепной гипертензией.
167
Особенности рвоты при различных заболеваниях НОВОРОЖДЕННЫЕ Рвота от перекармливания
Может наблюдаться после каждого кормления при повышенной лактации у матери или при передозировке молока. Общее состояние ребенка удовлетворительное.
Аэрофагия
Чаще в горизонтальном положении, при пеленании, частота различна. Развивается при затрудненном носовом дыхании, аномалиях соска у матери. При рентгенологическом исследовании - значительное скопление воздуха в желудке.
Брахиэзофагус
Частая, обильная рвота у детей грудного возраста. Усиливается в горизонтальном положении. Исчезает, когда ребенок начинает ходить. Рентгенологически - короткий пищевод, желудок вытянут над диафрагмой.
Дивертикул пищевода
Периодическая рвота. В рвотных массах примесь большого количества слизи. Рентгенологически - округлая тень на стенке пищевода.
Перитонит
Непрерывная рвота, не связанная с приемом пищи. Тяжелое общее состояние, коллапс, живот вздут, напряжен. Сгущение крови.
Пилоростеноз
Обильная, частая, фонтаном, возникает на 2-4 неделе жизни. Развитие дегидратации, потеря массы тела, видимая на глаз перистальтика (в виде "песочных часов"). Гипохлоремический алкалоз, гипокалиемия. Рентгенологически - длительная (12-24 ч) задержка бария в желудке. Иногда прощупывается утолщенный пилорический отдел желудка.
Псевдопилоростеноз (адреногенитальный синдром)
Рвота фонтаном, с первых дней жизни, иногда позднее. Дегидратация, дистрофия, может наблюдаться усиленная перистальтика желудка. Метаболический ацидоз, гиперкалиемия, потеря натрия с мочой. Низкий уровень основных гормонов коры надпочечников в крови и мочи.
Пилороспазм
С рождения. Рвота небольшим количеством, частота рвоты варьирует по дням.
ГРУДНЫЕ ДЕТИ Отит, пневмония (заболевания, не связанные с ЖКТ)
Нечастая, неинтенсивная рвота, наблюдается после кормления и натощак. Появляется в начале или в разгаре заболевания, прекращается при выздоровлении. Симптомы основного заболевания.
Простая диспепсия
После кормления, однократная, иногда повторная. Предшествует поносу или начинается вместе с ним. Общее состояние нетяжелое, частый жидкий стул.
Дизентерия
Нечастая, усиливается при развитии вторичного токсикоза. Чаще предшествует поносу или начинается вместе с ним. Эпидемиологический анамнез, выраженный колитический синдром, бактериологическое исследование. Нейтрофильный лейкоцитоз в крови, изменения ионограммы при вторичном токсикозе.
Колиэнтерит
Многократная в начале заболевания, при длительном течении частота и интенсивность ее различны. Упорная при нарастании токсикоза и умеренно выраженной дегидратации. Эпидемиологический анамнез, жидкий водянистый стул, бактериологическое исследование кала. Нейтрофильный лейкоцитоз, сгущение крови, ацидоз, вододефицитное, изотоническое или гипертоническое обезвоживание.
Инвагинация кишечника
Многократная в начале заболевания, повторяется приступами. В рвотных массах, помимо желудочного содержимого, желчь, кишечное содержимое. Тяжелое общее состояние. Данные рентгенологического исследования - непроходимость. Прощупывается инвагинат в брюшной полости. Кровавый стул (иногда в виде малинового желе). Гипохлоремия.
ДЕТИ СТАРШЕ 1 ГОДА Острый гастрит
Погрешности в диете, после приема пищи. Рвотные массы состоят из застоявшейся пищи с примесью слизи, желчи, иногда с прожилками крови.
Энтероколит, колит
Редкая, через определенный период времени после приема пищи. Понос. В испражнениях примесь слизи, иногда крови.
Аппендицит
Вначале заболевания нечастая, не связанная с приемом пищи. Признаки раздражения брюшины. Симптомы острого живота. Нейтрофильный лейкоцитоз в крови.
Эпидемический гепатит
Однократная или повторная в начале заболевания, сопровождается анорексией, тошнотой. Увеличение печени, появление желтухи, изменение цвета мочи и кала.
Панкреатит
Частая, мучительная, неукротимая, с начала заболевания. Резкие боли в эпигастральной области. Общее тяжелое состояние, коллапс, повышение активности амилазы в крови и моче.
Ацетонемическая рвота
Неукротимая, начинается внезапно. Появлению рвоты предшествуют недомогание, раздражительность. Запах ацетона от больных, сопор, кома. Сгущение крови, ацидоз, ацетон в крови и моче.
Заболевания почек
Вначале заболевания однократная или повторная. Рвота может быть при уремии и почечной колике. Отечный синдром, гипертензия. Изменения в моче, повышение остаточного азота крови, изменения протеинограммы.
Острая азотемия (эклампсия)
Частая, неукротимая. Появляется внезапно, сочетаясь с головной болью, расстройствами зрения, нарушениями сознания, судорогами. Повышенное АД. Гиперазотемия, анурия, олигурия, протеинурия, гематурия.
Кома уремическая
Постепенное усиление рвоты при нарастании азотемии. Появляется после предвестников (головная боль, анорексия, поносы). Данные анамнеза. Протеинурия, гематруия. Признаки почечной недостаточности. Гиперазотемия, гиперкалиемия, ацидоз.
Кома диабетическая
Не связана с приемом пищи, может быть частой. Появляется после предвестников (вялость, тошнота, жажда), в тяжелых случаях потеря сознания, судороги.
Синдром Уотерхауза-Фридериксена
Неукротимая рвота, возникающая внезапно. Гипертермия, резкая адинамия, коллапс, сыпь, участки цианоза на коже. Биохимические признаки недостаточности коры надпочечников.
Лихорадочные заболевания (грипп, скарлатина, ангина)
Вначале заболевания, частота индивидуальная. Сопровождает повышение температуры тела, исчезает по мере ее снижения. Симптомы основного заболевания. Лабораторные данные, характерные для основного заболевания.
Рвота при невротической анорексии
После пищи, данной по принуждению. Впоследствии пищи становится условным раздражителем, вызывающим рвоту. Дети отличаются повышенной возбудимостью, развивающейся на почве неправильного воспитания. Общее состояние нарушается незначительно.
Раны
Т09.1 Открытая рана туловища на неуточненном уровне Т11.1 Открытая рана верхней конечности на неуточненном уровне
Т13.1 Открытая рана нижней конечности на неуточненном уровне Т14.1 Открытая рана неуточненной области тела
Поверхностные раны: ссадина, ушиб, кровоподтёк, гематома, травма от поверхностного инородного тела (без большой открытой раны), укус неядовитого насекомого.
Ссадина (= царапина), осаднение (значительный участок кожи занят ссадинами),
1-е сутки - ссадина розовато-красного цвета блестящая, располагается ниже уровня кожи; 2-3-е сутки - образуется корочка, которая располагается на уровне кожи, корочка начинает возвышаться над уровнем кожи; 4-6 сутки - под корочкой идет эпителизация (процесс заживления); 7-9 сутки - корочка отпадает. После отпадения корочки остается участок гиперпигментации, чаще фиолетового цвета, к концу второй недели цвет кожи приобретает обычную окраску. После заживления ссадины никогда не остается рубца.
Ушиб, кровоподтёк - в основе действия тупого твердого предмета - удар и сдавление . Кровоподтеки бывают поверхностные, глубокие, по величине - петехии, экхимозы, гематомы. В первые часы кровоподтек красно-багрового, красно-синего, синего, фиолетового цвета. На 3- 6 сутки кровоподтек приобретает зеленый оттенок, на 6-10 сутки приобретает желтую окраску. Небольшие кровоподтеки исчезают через две недели.
Схема описания ссадины и кровоподтека
168

1.Точная локализация.
2.Форма (линейная, округлая, овальная, неправильная овальная и др.), направление (вертикальное, горизонтальное, косо-вертикальное в направлении сверху вниз, слева направо и т. д.).
3.Размеры (длина, ширина в см).
4.Состояние дна либо покрывающей корочки, цвет корочки ссадины, цвет кровоподтека.
Открытые раны: укушенная, резаная, скальпированная, рваная, колотая (щелевидная, веретенообразная, овальная, округлая), огнестрельные, с проникающим инородным телом.
Схема описания ран
1.Локализация.
2.Форма раны (линейная, веретенообразная, Г-образная и т. д.); направление; меняется ли после сведения краев; наличие дефекта мягких тканей (минус-ткань).
3.Размеры (длина и ширина в см); если от раны не отходит раневой канал, указывается также ее глубина.
4.Характер краев (ровные или неровные, наличие осаднений, инородных включений, имеются ли разрывы (их локализация, направление, размеры) и др.).
5.Характер концов (закругленные, остроугольные, есть ли разрывы (их локализация, направление, размеры) и др.).
6.Содержимое (чем наполнена, наличие инородных частиц, их особенности), что является дном.
7.Состояние окружающих кожных покровов (ссадины, кровоподтеки, загрязнения, наличие посторонних включений, пороха и т. д.)
8.Описание раневого канала (общее направление, длина, через какие ткани и органы проходит, чем наполнен, заканчивается слепо либо проникает в полость и т. д.).
Жалобы больного. Обстоятельства и время травмы, указание на вид ранящего предмета. Форма раны (точечная, линейная, веретенообразная и т.д), локализация. При скальпированной ране - наличие отслойки кожи (кожный лоскут). Края раны - ровные, неровные, припухлость краев раны. Зияние раны (расхождение краёв раны). В ране видны жировая, мышечная ткань (обрывки тканей), сухожилия, кость, сгустки крови, раневой экссудат; рана (не) загрязнена землей; наличие инородных тел, обрывков одежды в ране. Наличие кровотечения (незначительное, умеренное, сильное; кровь вытекает, пульсирует). Входное и выходное отверстие при огнестрельном ранении.
Уровень артериального давления, пульсовое давление, частота пульса, признаки геморрагического шока.
ПОМОЩЬ:
Остановка кровотечения.
ПРАВИЛА НАЛОЖЕНИЯ ЖГУТА
Обработка краев раны антисептиком.
Асептическая повязка.
При боли:
Кеторолак (Кеторол) 30 мг или
Трамадол (Трамал) 100 мг в/в или
Фентанил 0,05-0,1 мг в/в
При недостаточном эффекте:
Кетамин 0,5 мг/кг в/в
Иммобилизация по показаниям (в зависимости от локализации).
Госпитализация или доставка в травмпункт. При отказе от госпитализации – актив в ЛПУ.
~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~
Примеры описания ссадины
На передней поверхности правой голени в средней трети на фоне припухлости мягких тканей расположена косовертикальная (сверху вниз, справа налево) овальная ссадина размерами 5´3 см, покрытая плотной красно-коричневой
корочкой, расположенной выше уровня окружающей кожи.
На правой боковой поверхности грудной клетки в проекции 7-го ребра по среднеподмышечной линии имеется горизонтальная линейная ссадина 6,2´0,2 см с влажным темно-красным дном, расположенным ниже уровня окружающих тканей. Вокруг ссадины кожа покрыта кровью.
Примеры описания кровоподтеков
169
