- •Алициклические углеводороды
- •Моноциклические насыщенные углеводороды (циклопарафины, циклоалканы, полиметиленовые углеводороды)
- •Номенклатура циклопарафинов
- •Изомерия циклопарафинов
- •Соединения с четырех- и пятичленными кольцами
- •Соединения ряда циклогексана
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Химические свойства соединений с трехчленными циклами
- •1.Реакции присоединения
- •Химические свойства циклобутана и его гомологов
- •2.Окисление
- •3.Реакции термического разложения
- •4.Реакции присоединения
- •Взаимные превращения циклов
- •Способы получения
- •Химические свойства
- •Отличительные реакции
- •2.Отличительные особенности химических свойств циклопентадиена.
- •Ароматические соединения
- •Основные признаки ароматичности
- •Ароматические соединения
- •1 Группа – ароматические соединения бензоидного строения (ароматические углеводороды)
- •Отличительные особенности химического поведения ароматических углеводородов
- •Гомологический ряд, изомерия и номенклатура ароматических углеводородов
- •Названия ароматических радикалов
- •Способы получения ароматических углеводородов
- •Химические превращения углеводородов в процессе ароматизации
- •Б. Синтетические способы получения ароматических углеводородов
- •Физические свойства ароматических углеводородов
- •Химические свойства
- •Механизм электрофильного замещения
- •I. Реакции электрофильного замещения в ароматическом ядре
- •Правила электрофильного замещения в ароматическом ядре
- •Нитрование гомологов бензола
- •Реакции присоединения (нетипичны)
- •Галоидпроизводные ароматических углеводородов Классификация, изомерия, номенклатура
- •Получение
- •Физические свойства галогенопроизводных ароматических углеводородов
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •I тип реакций. Реакции, характерные для органических кислот.
- •II тип реакции. Восстановление сульфогруппы
- •III тип реакций. Реакции нуклеофильного замещения сульфогруппы
- •IV тип реакций. Реакции электрофильного замещения в ядре идут в соответствии с правилами замещения
- •Нитросоединения ароматического ряда
- •1.Нитросоединения с нитрогруппой в ядре
- •Физические свойства
- •Химические свойства
- •II. Реакции в ядре
- •II. Нитросоединения с группой no2 в боковой цепи
- •Способы получения
- •Химические свойства ароматических нитросоединений с группой no2 в боковой цепи
- •Ароматические амины Классификация
- •I. По положению аминогруппы относительно ароматического ядра.
- •II. По количеству радикалов, связанных с азотом
- •III. По количеству аминогрупп
- •Получение
- •Физические свойства
- •Химические свойства
- •II. Реакции замещения водорода в аминогруппе
- •IV. Окисление
- •V. Реакции замещения в ароматическом ядре
- •Механизм реакции галоидирования
- •VI. Реакции конденсации ароматических аминов с другими органическими и неорганическими соединениями
- •Диазо- и азосоединения
- •Ароматические диазосоединения
- •Способы получения
- •1. Реакция диазотирования - -получение солей диазония.
- •Таутомерия и физические свойства ароматических диазосоединений
- •Химические свойства солей диазония
- •I. Реакции с выделением азота
- •II. Реакции диазосоединений без выделения азота
- •Азокрасители
- •Связь строения с цветностью
- •Индикаторные свойства азокрасителей
- •Ароматические оксисоединения
- •Классификация
- •Способы получения
- •Физические свойства фенолов
- •Химически свойства фенолов
- •I. Реакции подвижного водорода в группе он
- •II. Реакции электрофильного замещения в ядре
- •III. Окислительно-восстановительные реакции
- •IV. Конденсация фенолов с другими органическими соединениями
- •Ароматические спирты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Ароматические альдегиды и кетоны
- •Способы получения
- •II. Частные способы получения альдегидов и кетонов
- •Физические свойства
- •Химические свойства
- •Отдельные представители альдегидов
- •Отдельные представители кетонов
- •Ароматические кислоты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Двухосновные ароматические кислоты
- •Другие поликарбоновые ароматические кислоты
- •Полициклические ароматические углеводороды и их производные
- •Ароматические углеводороды с изолированными ядрами
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Наиболее важные группы многоядерных соединений. Группа дифенила
- •Группа трифеиилметана
- •Красители типа трифенилметана
- •Полициклические ароматические углеводороды с конденсированными ядрами
- •Получение
- •Физические свойства
- •Особенности химических свойств
- •Аминопроизводные нафталина
- •Гетероциклические соединения
- •Ароматические гетероциклические соединения
- •Ароматические моноциклические пятичленные гетероциклы
- •Номенклатура гетероциклических соединений
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Пятичленные гетероциклы с несколькими гетероатомами
- •Получение
- •Отличительные особенности свойств
- •Бициклические соединения с пятичленными гетероциклами
- •Получение инденкумароновых смол
- •Химические свойства
- •Значение
- •Применение и значение пятичленных гетероциклических соединений
- •Шестичленные гетероциклы с одним гетероатомом
- •Получение
- •Реакционноспособность некоторых заместителей в пиридиновом кольце
- •Получение
- •Понятие об алкалоидах
Физические свойства фенолов
В чистом виде фенолы - твердые бесцветные кристаллические вещества, иногда жидкости. Практически обычно окрашены, т.к. легко окисляются кислородом воздуха, образуя соединения хиноидного строения. Очень гигроскопичны. В воде растворяются ограниченно. Фенол при добавлении воды образует два слоя: воды в феноле и фенола в воде. Обладают характерным запахом (“карболка”). На кожу оказывают прижигающее действие.
Химически свойства фенолов
Обусловлены наличием сильного взаимного влияния групп ОН ароматического ядра.

Вследствие наличия р- -сопряжения, электронная плотность у кислорода уменьшается, ион притягивает к себе электроны от Н, группа ОН приобретает кислотные свойства и способна отщеплять Н+. ароматическое ядро обогащается электронами, наибольшее повышение электронной плотности наблюдается в о- и п-положении. Поэтому фенолы очень легко вступают в реакции электрофильного замещения.
I. Реакции подвижного водорода в группе он
1) Фенолы, в отличие от спиртов, проявляют вполне выраженные кислотные свойства.
а) образуют солеобразные соединения – феноляты со щелочью;
|
+ NaOH -HOH |
|
|
|
|
б) могут диссоциировать как кислоты
H2O
C6H5OH C6H5O- + H+
Константа диссоциации меньше, чем у угольной кислоты, поэтому угольная кислота вытесняет фенолы из их солей (фенолятов).
Кфен.=1,3 . 10-10
К1
H2CO3 =4,3 . 10-7
К2 H2CO3 =5,6 . 10-11
С6H5Ona + H2CO3 C6H5OH + NaHCO3
в) с хлорным железом образуют комплексные феноляты, растворы которых в воде имеют характерные окраски (качественная реакция на фенолы в водной фазе). Так, фенол – фиолетовое окрашивание, п-крезол – синее, пирокатехин – зеленое.
3C6H5OH+FeCl3 3HCl+(C6H5O)3Fe H3[Fe(C6H5O)6] 3H++[Fe(C6H5O)6]3-
При добавлении щелочи, спирта, ацетона комплекс разрушается, и окраска исчезает.
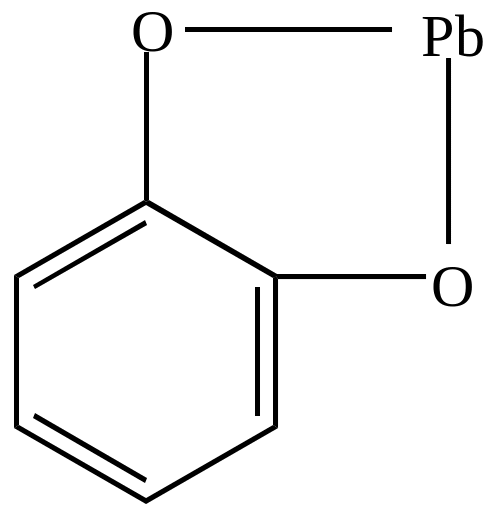
г) образование нерастворимых фенолятов
|
+ (CH3COO)2Pb |
|
+ 2 CH3COOH |
пирокатехин |
|
фенолят свинца |
|
2) о-алкилирование фенолов приводит к образованию простых эфиров фенолов. Осуществляется чаще всего действием галоидных алкилов на феноляты.
C6H5Ona + ICH3 C6H5OCH3 + NaI
метилфениловый эфир
(анизол)
Например,
С6H5ONa + C2H5O-SO2-C6H5 C6H5O-C2H5 + NaO-SO2-C6H5
фенолят натрия этиловый эфир этилфениловый эфир натриевая соль
бензолсульфокислоты (фенетол) БСК
|
+ |
|
+ NaOH
|
|
+CH3O-SO2-ONa+H2O |
пирокатехин |
|
диметилсульфат |
|
гваякол (метиловый эфир пирокатехина) |
натриевая соль метоксисерной кислоты |
3) о-ацилирование фенолов приводит к образованию сложных эфиров фенолов. Осуществляется обычным образом – действием хлорангидридов или ангидридов кислот на фенолы.
С6H5ONa + |
|
|
|
+ NaCl |
||||||
фенолят натрия |
хлорангидрид пропионовой кислоты
|
|
фенилпропианат |
|
||||||
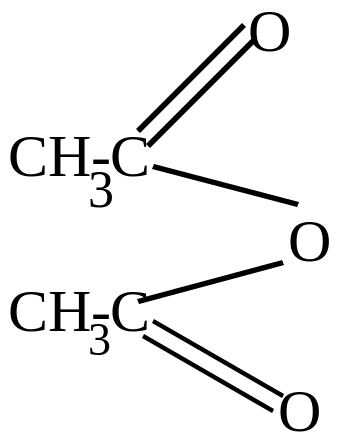
С6H5OH + |
|
|
|
+ |
|
|
||||
фенол |
уксусный ангидрид |
|
фенилацетат |
|
ацетат натрия |
|
||||