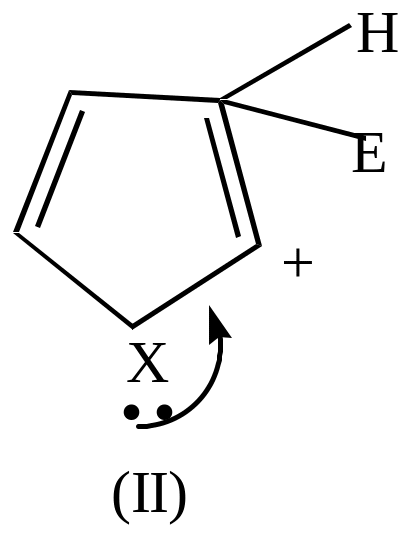- •Алициклические углеводороды
- •Моноциклические насыщенные углеводороды (циклопарафины, циклоалканы, полиметиленовые углеводороды)
- •Номенклатура циклопарафинов
- •Изомерия циклопарафинов
- •Соединения с четырех- и пятичленными кольцами
- •Соединения ряда циклогексана
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Химические свойства соединений с трехчленными циклами
- •1.Реакции присоединения
- •Химические свойства циклобутана и его гомологов
- •2.Окисление
- •3.Реакции термического разложения
- •4.Реакции присоединения
- •Взаимные превращения циклов
- •Способы получения
- •Химические свойства
- •Отличительные реакции
- •2.Отличительные особенности химических свойств циклопентадиена.
- •Ароматические соединения
- •Основные признаки ароматичности
- •Ароматические соединения
- •1 Группа – ароматические соединения бензоидного строения (ароматические углеводороды)
- •Отличительные особенности химического поведения ароматических углеводородов
- •Гомологический ряд, изомерия и номенклатура ароматических углеводородов
- •Названия ароматических радикалов
- •Способы получения ароматических углеводородов
- •Химические превращения углеводородов в процессе ароматизации
- •Б. Синтетические способы получения ароматических углеводородов
- •Физические свойства ароматических углеводородов
- •Химические свойства
- •Механизм электрофильного замещения
- •I. Реакции электрофильного замещения в ароматическом ядре
- •Правила электрофильного замещения в ароматическом ядре
- •Нитрование гомологов бензола
- •Реакции присоединения (нетипичны)
- •Галоидпроизводные ароматических углеводородов Классификация, изомерия, номенклатура
- •Получение
- •Физические свойства галогенопроизводных ароматических углеводородов
- •Химические свойства
- •Физические свойства
- •Химические свойства
- •I тип реакций. Реакции, характерные для органических кислот.
- •II тип реакции. Восстановление сульфогруппы
- •III тип реакций. Реакции нуклеофильного замещения сульфогруппы
- •IV тип реакций. Реакции электрофильного замещения в ядре идут в соответствии с правилами замещения
- •Нитросоединения ароматического ряда
- •1.Нитросоединения с нитрогруппой в ядре
- •Физические свойства
- •Химические свойства
- •II. Реакции в ядре
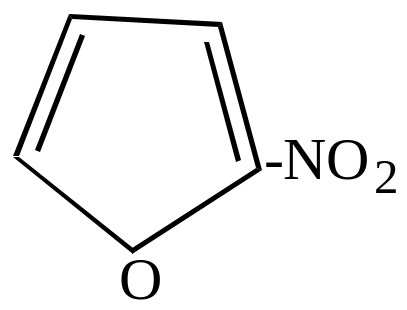
- •II. Нитросоединения с группой no2 в боковой цепи
- •Способы получения
- •Химические свойства ароматических нитросоединений с группой no2 в боковой цепи
- •Ароматические амины Классификация
- •I. По положению аминогруппы относительно ароматического ядра.
- •II. По количеству радикалов, связанных с азотом
- •III. По количеству аминогрупп
- •Получение
- •Физические свойства
- •Химические свойства
- •II. Реакции замещения водорода в аминогруппе
- •IV. Окисление
- •V. Реакции замещения в ароматическом ядре
- •Механизм реакции галоидирования
- •VI. Реакции конденсации ароматических аминов с другими органическими и неорганическими соединениями
- •Диазо- и азосоединения
- •Ароматические диазосоединения
- •Способы получения
- •1. Реакция диазотирования - -получение солей диазония.
- •Таутомерия и физические свойства ароматических диазосоединений
- •Химические свойства солей диазония
- •I. Реакции с выделением азота
- •II. Реакции диазосоединений без выделения азота
- •Азокрасители
- •Связь строения с цветностью
- •Индикаторные свойства азокрасителей
- •Ароматические оксисоединения
- •Классификация
- •Способы получения
- •Физические свойства фенолов
- •Химически свойства фенолов
- •I. Реакции подвижного водорода в группе он
- •II. Реакции электрофильного замещения в ядре
- •III. Окислительно-восстановительные реакции
- •IV. Конденсация фенолов с другими органическими соединениями
- •Ароматические спирты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Ароматические альдегиды и кетоны
- •Способы получения
- •II. Частные способы получения альдегидов и кетонов
- •Физические свойства
- •Химические свойства
- •Отдельные представители альдегидов
- •Отдельные представители кетонов
- •Ароматические кислоты
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Двухосновные ароматические кислоты
- •Другие поликарбоновые ароматические кислоты
- •Полициклические ароматические углеводороды и их производные
- •Ароматические углеводороды с изолированными ядрами
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Наиболее важные группы многоядерных соединений. Группа дифенила
- •Группа трифеиилметана
- •Красители типа трифенилметана
- •Полициклические ароматические углеводороды с конденсированными ядрами
- •Получение
- •Физические свойства
- •Особенности химических свойств
- •Аминопроизводные нафталина
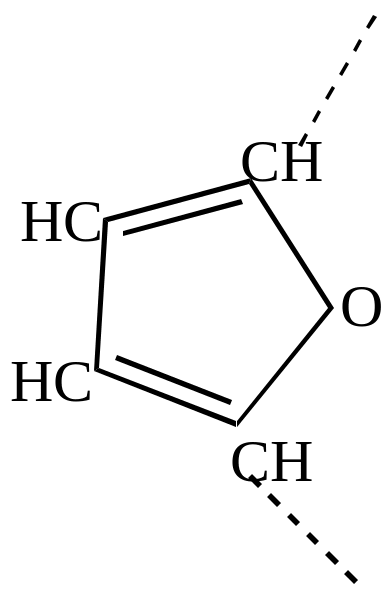
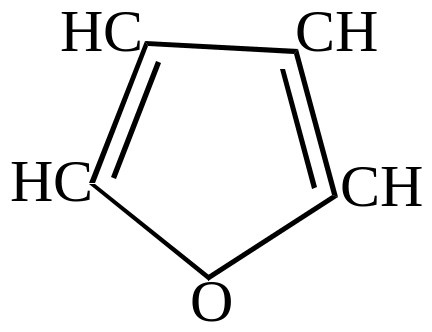
- •Гетероциклические соединения
- •Ароматические гетероциклические соединения
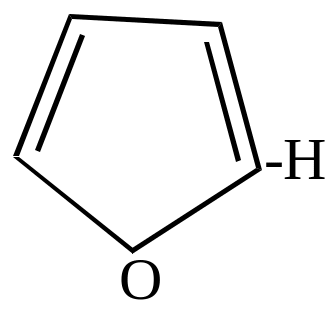
- •Ароматические моноциклические пятичленные гетероциклы
- •Номенклатура гетероциклических соединений
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Пятичленные гетероциклы с несколькими гетероатомами
- •Получение
- •Отличительные особенности свойств
- •Бициклические соединения с пятичленными гетероциклами
- •Получение инденкумароновых смол
- •Химические свойства
- •Значение
- •Применение и значение пятичленных гетероциклических соединений
- •Шестичленные гетероциклы с одним гетероатомом
- •Получение
- •Реакционноспособность некоторых заместителей в пиридиновом кольце
- •Получение
- •Понятие об алкалоидах
Химические свойства
Подразделяются на:
I. Свойства, в которых проявляется ароматический характер кольца.
II. Реакции, в которых проявляется ненасыщенный характер кольца.
III. Кислотно-основные свойства, обусловленные наличием гетероатомов.
Соотношение этих свойств связано с тем, насколько равномерно распределена электронная плотность в ядре гетероцикла. Все гетероатомы (кислород, азот, сера) обладают более высокой электроотрицательностью, чем углерод, и поэтому притягивают к себе электроны соседних связей, сообщая соединению дипольный момент, направленный к гетероатому.
У насыщенных (полностью гидрированных) гетероциклов дипольный момент направлен к гетероатому, например,
тетрагидрофуран |
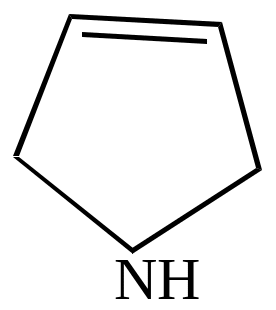
пирролидин |
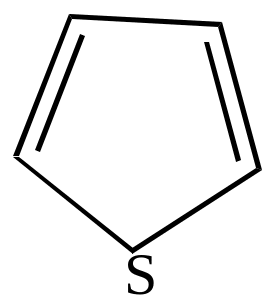
Тиофан |
|
|
|
=1,68Д |
=1,57Д |
=1,87Д |
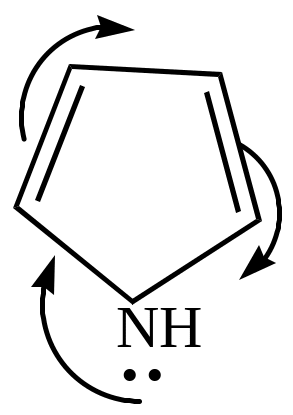
У ароматических гетероциклов наблюдается уменьшение дипольных моментов и даже (в случае пиррола) изменение его направления.
|
|
|
=1,70Д |
=1,80Д |
=1,52Д |
Это вызвано наличием сопряжения неподеленных пар электронов гетероатомов с -электронами кольца, вследствие чего р-электроны гетероатомов оттягиваются на кольцо. Происходит делокализация электронной плотности, приводящая к появлению ароматических свойств, что видно из величин энергии сопряжения (делокализации)
|
фуран |
пиррол |
тиофен |
Бензол |
Е, кДж/моль |
92,4 |
109,2 |
130,2 |
150,0 |
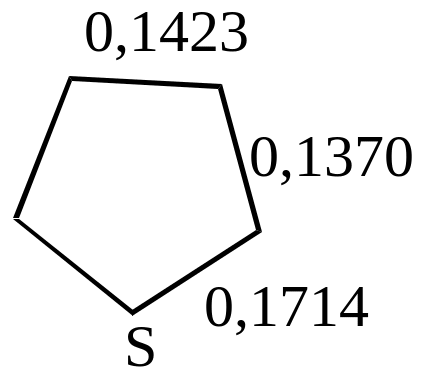
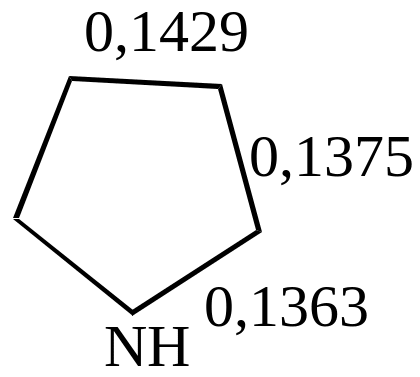
а также данных о длинах связей (в нм)
|
|
|
т.е. наиболее высокой степенью ароматичности обладает тиофен, у которого энергия делокализации лишь на 10% меньше, чем у бензола.
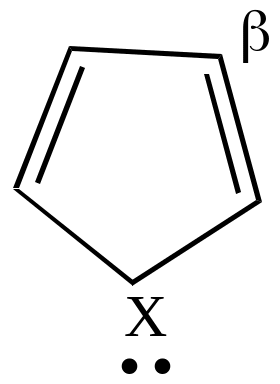
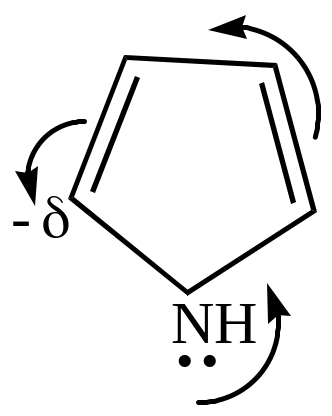
В целом распределение электронной плотности в кольцах гетероциклов не вполне равномерное. Наиболее высокая плотность электронных зарядов во всех трех гетероциклах наблюдается в положении .
Рассмотрим, как эти закономерности проявляются в конкретных реакциях.
I. Реакции, обусловленные ароматическим характером кольца.
1) Реакции электрофильного замещения.
Чрезвычайно легко идут у фурана и пиррола. Тиофен менее реакционноспособен, чем пиррол и фуран, но более активен, чем бензол, он вступает в реакцию электрофильного замещения в 1000 раз быстрее, чем бензол.
Активность ароматических пятичленных гетероциклов в реакциях электрофильного замещения больше, чем у бензола, т.к. у бензола на 6 С-Н связей приходится 6 -электронов, а у пятичленных гетероциклов на 4 С-Н связи - 4 +2р-электрона, вследствие чего электронная плотность у каждого атома углерода больше. Кроме того, -комплекс дополнительно стабилизируется за счет образования ониевых структур атомами О и N.
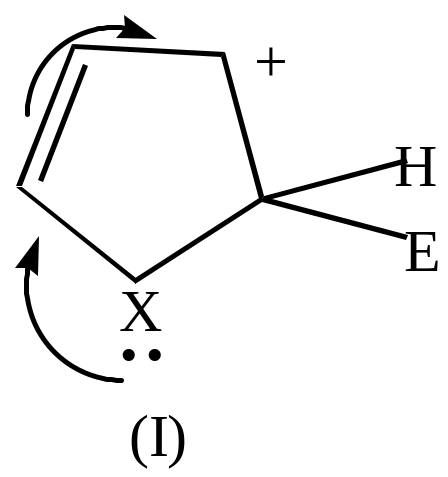
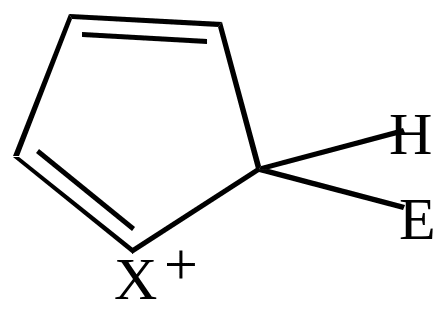
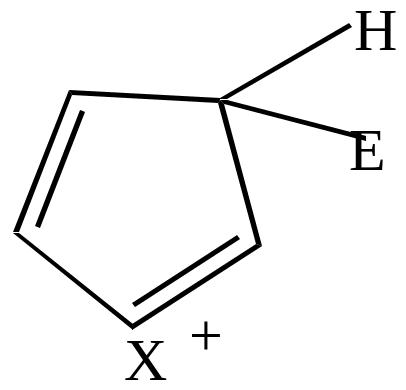
Если электрофильный реагент Е+ присоединяется в -положение, то
|
+Е+ |
|
|
|
Если электрофильный реагент Е+ присоединяется в -положение, то
|
+Е+ |
|
|
|
Комплекс (I) более устойчив, чем комплекс (II), т.к. делокализация положительного заряда в случае (I) идет по 4-м атомам, а в случае (II) – только по 2-м (поэтому замещение идет преимущественно в положение ).
П иррол
фуран тиофен бензол
иррол
фуран тиофен бензол
увеличивается активность в реакциях электрофильного замещения
Следует отметить особый подбор реагентов для реакций электрофильного замещения в пятичленных гетероциклах, связанный с тем, что фуран и пиррол проявляют явную ненасыщенность. Азотная кислота, серная кислота, хлор вызывают реакции полимеризации диенов (“осмоление”), поэтому применяют более мягкие агенты.
А. Галоидирование
1. Хлорирование свободным хлором возможно лишь для тиофена, при этом образуется смесь моно- и полихлорпроизводных.
|
+Cl2 -HCl |
|
+Cl2 -HCl |
|
+Cl2 … -HCl |
.2. Монохлорирование пиррола осуществляется действием хлористого сульфурила (хлоран4гидрида серной кислоты)
|
+SO2Cl2 |
|
+SO2 + HCl |
|
|
-хлорпиррол |
|
3. Монобромирование фурана можно провести под действием диоксандибромида.
|
+ |
|
2 |
|
+ |
|
|
|
|
|
-бромфуран |
|
диоксандигидробромид |
В. Сульфирование
1. Тиофен сульфируется концентрированной H2SO4 уже при комнатной температуре
|
комн. + HOSO2OH |
|
+ H2O |
|
|
-сульфотиофен |
|
2. Фуран и пиррол сульфируются под действием пиридинсульфотриоксида.
|
+ |
|
|
|
+ |
|
|
|
|
|
-сульфофуран |
|
пиридин |
С. Нитрование
Нитрование фурана и пиррола осуществляется действием концентрированной HNO3 в уксусном ангидриде.
|
|
|
+ HO-NO2
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
ацетилнитрат |
|
|
+ |
|
|
|
|
|
ацетилнитрат |
|
|
|
+ |
|
|
|
-нитрофуран |
|
|
|
D. Алкилирование и ацилирование
|
+ |
|
H2SO4 (75%)
|
|
|
|
пропилен |
|
-изопропилтиофен |
|
+ |
|
AlCl3 безв.
|
|
+ HCl |
|
||||
|
|
хлористый ацил |
|
метил-2-тионилкетон |
|
|
||||
|
+ |
|
SnCl2
|
|
+ CH3-COOH |
|||||
|
|
|
|
метил-2-фурилкетон |
|
|||||
II. Реакции, обусловленные ненасыщенным характером гетероциклов.
1) Реакции присоединения
а) присоединение атомарного водорода по концам системы сопряженных двойных связей.
|
+2H (Zn + CH3COOH) |
|
|
|
пирролин |
При восстановлении молекулярным водородом на металлическом катализаторе происходит полное гидрирование кольца.
|
Pt +2H2 |
|
пиррол |
|
пирролидин |
Также может гидрироваться тиофен.
|
Pd на угле +2H2 2-4 атм. |
|
(Pt)
+2H2 |
|
+ H2S |
тиофен |
|
тиофан |
|
бутан |
сероводород |
б) диеновый синтез
Реакции диенового синтеза гладко протекают у фурана.
|
+ |
|
|
|
фуран |
|
малеиновый ангидрид |
|
ангидрид-3,6-эндоксо-1,2,3,6-тетрагидрофталевой кислоты |
2) Окисление
В реакции окисления с разрывом двойных связей кольца могут вступать фуран и пиррол. Тиофен к окислению устойчив.
|
+3[O] |
|
+H2O |
|
|||
фуран |
|
малеиновый ангидрид |
|
|
|||
|
+3[O] |
|
+H2O |
||||
пиррол |
|
имид малеиновой кислоты |
|
||||
3) полимеризация.
Под действием кислот фуран и пиррол осмоляются за счет протекания процессов полимеризации. Первой стадией процесса является протонирование, приводящее к образованию катиона.
|
H+
|
|
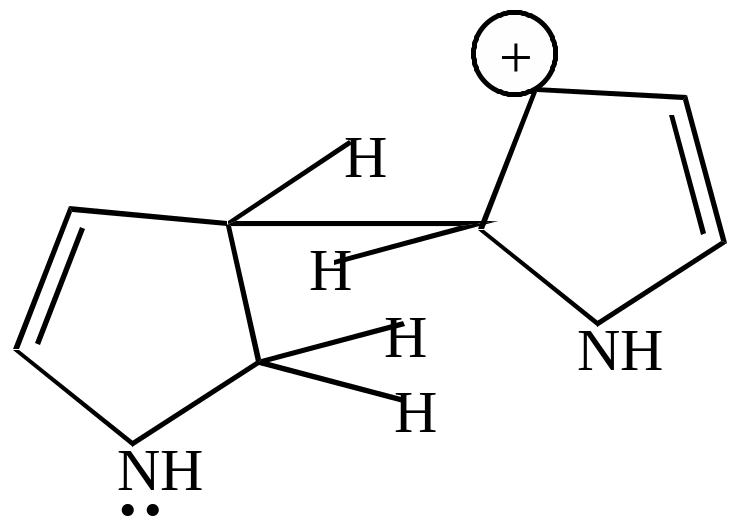
Образовавшийся катион атакует молекулу пиррола по -положению.
|
+ |
|
|
|
… |
|
III. Кислотно-основные свойства.
1) Кислотно-основные свойства пиррола
а) пиррол, как и все азотистые основания, должен проявлять свойства оснований за счет наличия аминного азота. Его основные свойства чрезвычайно слабы, т.к. неподеленная пара электронов азота входит в состав ароматического секстета. Пиррол может образовывать соли только с очень сильными кислотами. Атака протона приводит к нарушению ароматического секстета, образующийся катион пиррилия ведет себя как сопряженный диен и вступает дальнейшее превращение – полимеризацию и осмоление.
б)
пиррол проявляет вполне ясные кислотные
свойства, которые тоже определяются
участием неподеленной пары электронов
азота в ароматическом секстете, т.к.
оттягивание неподеленной пары азота в
кольцо приводит к понижению электронной
плотности у азота и увеличению полярности
связи N
Н.
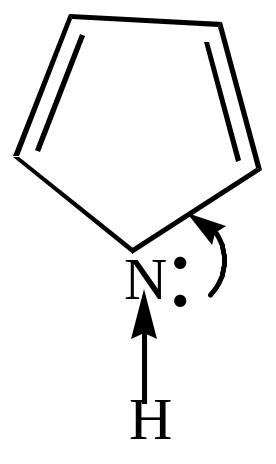
Кислотные свойства пиррола проявляются в следующих химических реакциях.
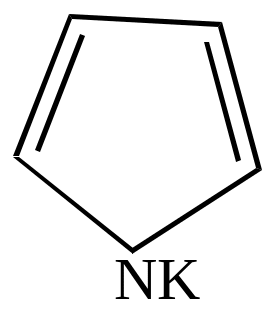
Образование солей с металлами
|
+K (или Na) H + |
|
|
||
пиррол |
|
пирролкалий |
|
||
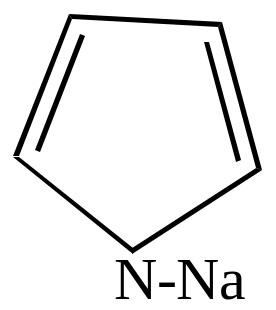
|
+C2H5ONa |
|
+C2H5OH |
||
|
|
пирролнатрий |
|
||
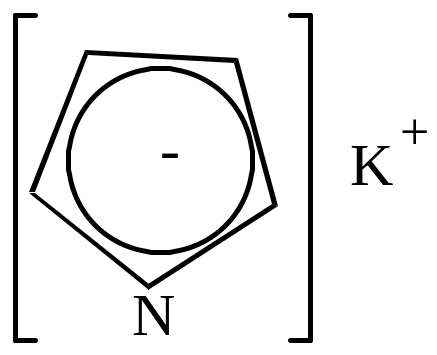
Эти соли имеют ионный тип связи вследствие устойчивости образующегося аниона.
|
|
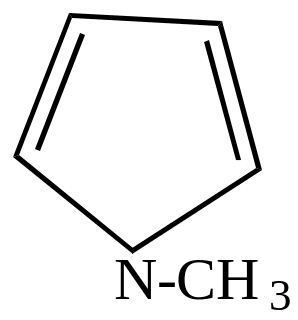
Металлические производные пиррола используются для получения различных соединений ряда пиррола. При взаимодействии этих солей с галоидными алкилами или ацилами при нагревании происходит перемещение группы, связанной с азотом, в ядро.
|
+ CH3Cl KCl + |
|
нагр.
|
|
||||||
пирролкалий |
хлористый метил |
N-метилпиррол |
|
-метилпиррол |
||||||
|
+ |
|
KCl +
|
|
нагр.
|
|
||||
|
|
|
|
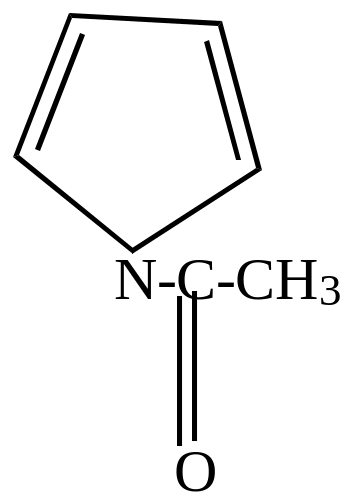
N-ацетилпиррол |
|
-ацетилпиррол |
||||
Металлические производные пиррола широко распространены в природе. Так, гемоглобин содержит в своей структуре группировку из 4-х пиррольных колец, соединенных с атомом железа двумя ковалентными и двумя координационными связями.
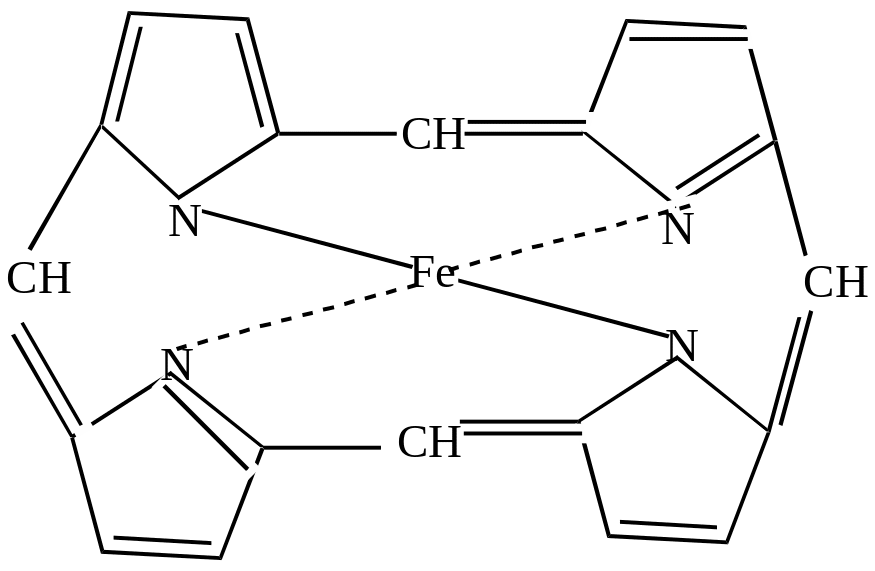
Такая же группировка, только с атомом магния, входит в состав хлорофилла.
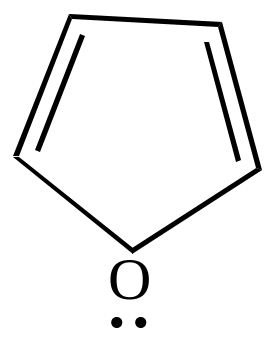
2). Кислотно-основные свойства фурана.
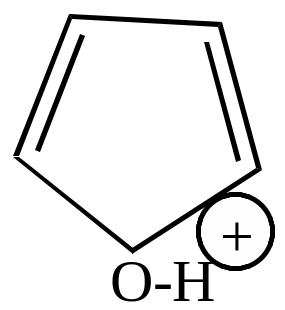
Фуран проявляет основные свойства. Так, он может протонироваться под действием концентрированных минеральных кислот. Протонирование идет в основном по кислороду. Образовавшийся катион обладает свойствами непредельных соединений, легко полимеризуется.
|
+H+ |
|
Кислотных свойств фуран не проявляет.
3) Тиофен практически не проявляет ни кислотных, ни основных свойств. Тиофен кислотами не осмоляется (см. свойства тиосоединений).