
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.5.2. Строение фенола и бензилового спирта
Строение фенола имеет общие черты со строением галогенобензолов. Это прежде всего природа и направленность электронных эффектов. Однако имеются особенности, отражающиеся в конечном счёте на химическом поведении как самого фенола, так и его производных.
А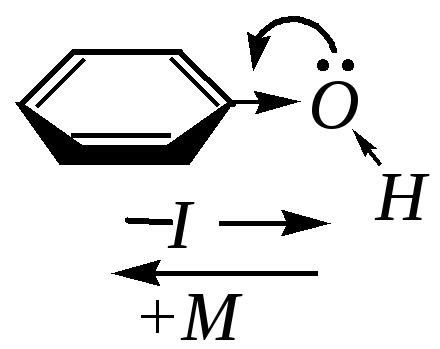 том
кислорода гидроксогруппы взаимодействует
с бензольным кольцом посредством –I-
и +М-эффектов.
В молекуле фенола +М-эффект
больше –I-эффекта
(по модулю). Значительный положительный
мезомерный эффект объясняется
соответствием геометрической конфигурации
внешних (взаимодействующих) р-орбиталей
углерода и кислорода, оба этих атома —
это атомы II
периода Периодической таблицы химических
элементов. В результате суммарный
электронный эффект, которым обладает
гидроксогруппа по отношению к бензольному
кольцу, — это донорный эффект. Это
подтверждается и направлением дипольного
момента связи
C–О.
том
кислорода гидроксогруппы взаимодействует
с бензольным кольцом посредством –I-
и +М-эффектов.
В молекуле фенола +М-эффект
больше –I-эффекта
(по модулю). Значительный положительный
мезомерный эффект объясняется
соответствием геометрической конфигурации
внешних (взаимодействующих) р-орбиталей
углерода и кислорода, оба этих атома —
это атомы II
периода Периодической таблицы химических
элементов. В результате суммарный
электронный эффект, которым обладает
гидроксогруппа по отношению к бензольному
кольцу, — это донорный эффект. Это
подтверждается и направлением дипольного
момента связи
C–О.
За счёт р--сопряжения увеличивается степень двоесвязанности между углеродом и кислородом: эта связь имеет 23.7 % -характера. Строение фенола должно быть сходно со строением несуществующего винилового спирта (гл. 5.1.2, 5.3.1). Но в отличие от винилового спирта фенол не изомеризуется благодаря устойчивой сопряжённой системе бензольного кольца. Длина связи C–О в феноле меньше, чем в спиртах (в феноле 0.136 нм, в метаноле 0.143 нм), а прочность этой связи больше, чем в спиртах. Кроме того, вследствие р--сопряжения на атоме кислорода появляется дефицит электронной плотности (частичный положительный заряд), за счёт которого увеличивается полярность связи О–Н настолько, что фенолы проявляют свойства слабых кислот.
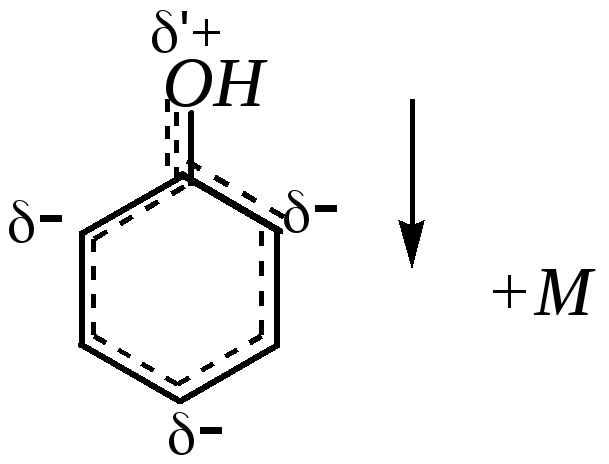
Положительный мезомерный эффект гидроксогруппы приводит к значительному увеличению электронной плотности на бензольном кольце и главным образом в о- и п-положениях (гл. 10.1.1). В результате сопряжения образуется единая -молекулярная орбиталь. Этому состоянию отвечает мезоформула
В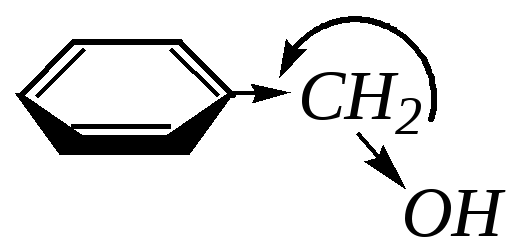 молекуле бензилового спирта атом
кислорода гидроксогруппы непосредственно
не связан с ароматическим кольцом,
поэтому сопряжение между ними невозможно.
Гидроксогруппа влияет на бензольное
кольцо только посредством индуктивного
эффекта (–I-эффект),
уменьшая тем самым величину электронной
плотности на нём. Но -электронная
система бензольного кольца может
взаимодействовать с С–Н-связями
-углеродного
атома (сверхсопряжение аналогичное
тому, какое наблюдается в толуоле).
Поэтому электронная плотность в
ароматическом кольце в целом несколько
понижена по сравнению с бензолом, но
орто-
и особенно пара-положение
в меньшей степени испытывают это
понижение. Длина и прочность связей С–О
и О–Н
мало отличаются
от таковых для алифатических спиртов,
так как влияние бензольного кольца на
фрагмент С–О–Н
невелико.
молекуле бензилового спирта атом
кислорода гидроксогруппы непосредственно
не связан с ароматическим кольцом,
поэтому сопряжение между ними невозможно.
Гидроксогруппа влияет на бензольное
кольцо только посредством индуктивного
эффекта (–I-эффект),
уменьшая тем самым величину электронной
плотности на нём. Но -электронная
система бензольного кольца может
взаимодействовать с С–Н-связями
-углеродного
атома (сверхсопряжение аналогичное
тому, какое наблюдается в толуоле).
Поэтому электронная плотность в
ароматическом кольце в целом несколько
понижена по сравнению с бензолом, но
орто-
и особенно пара-положение
в меньшей степени испытывают это
понижение. Длина и прочность связей С–О
и О–Н
мало отличаются
от таковых для алифатических спиртов,
так как влияние бензольного кольца на
фрагмент С–О–Н
невелико.
Физические и химические свойства фенолов
По агрегатному состоянию фенолы представляют собой бесцветные твёрдые вещества или, реже, жидкости с сильным своеобразным запахом. При хранении на воздухе постепенно окисляются и, как следствие, приобретают окраску от розовой до жёлто-коричневой.
Фенолы труднорастворимы в воде, а высокие температуры кипения их обусловлены наличием межмолекулярных водородных связей (аналогично спиртам).
Химические свойства фенолов обусловлены взаимным влиянием гидроксогруппы и бензольного кольца, поэтому для них характерны как реакции по бензольному кольцу, так и реакции с участием гидроксильной группы.
10.5.3.1. Кислотно-оснόвные свойства
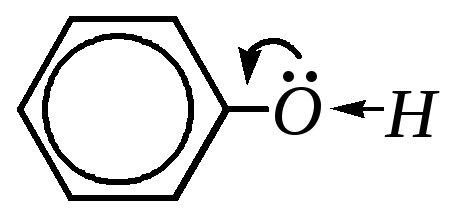
Кислотные свойства у фенолов выражены сильнее, чем у спиртов (алифатических и ароматических). Это обусловлено значительно более сильной поляризацией связи О–Н за счёт смещения электронной плотности от атома кислорода к бензольному кольцу (гл. 1.6):
Кислотные свойства фенолов могут быть также объяснены большей устойчивостью фенолят-иона, который образуется при диссоциации фенола. В фенолят-анионе в делокализации отрицательного заряда принимает участие -электронная система ароматического кольца:
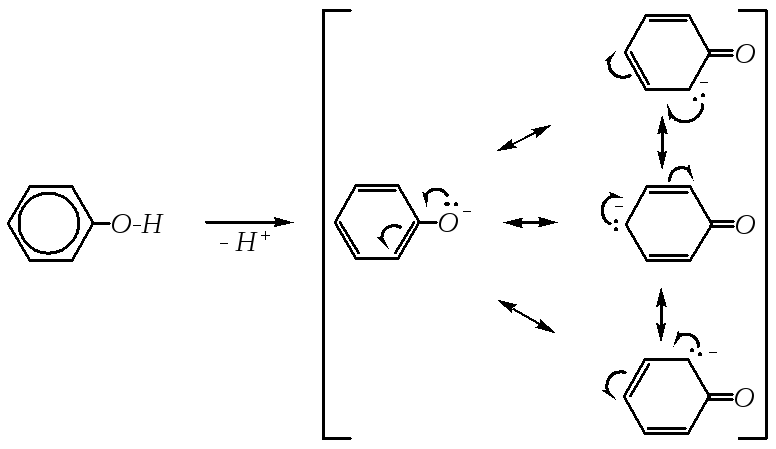
Однако кислотные свойства фенолов выражены слабее, чем у карбоновых кислот, диссоциация фенолов в водных растворах протекает, но равновесие этой реакции смещено влево. Значение рКа для фенола и его гомологов лежит в пределах от 9.9 до 10.4, в то время как для уксусной кислоты рКа = 4.76, а для угольной — рКа = 6.35 (по первой ступени диссоциации). То есть фенол не взаимодействует с гидрокарбонатами металлов, но может взаимодействовать со средними солями угольной кислоты, превращая их в кислые соли, так как по второй ступени диссоциации угольная кислота слабее фенола.
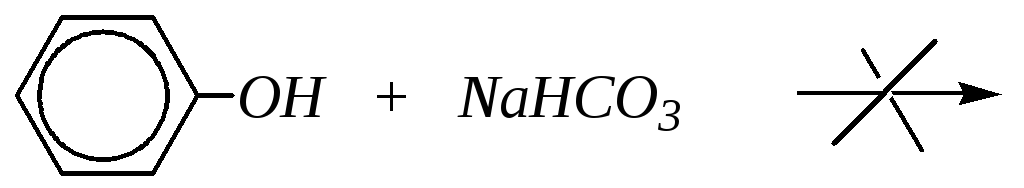
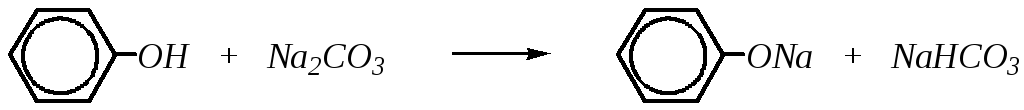
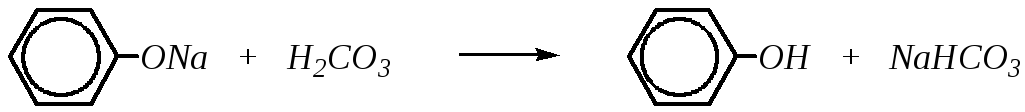
Соли фенола, феноляты, при взаимодействии с угольной кислотой превращаются в фенол:
Введение электронодонорных или акцепторных заместителей в ароматическое кольцо фенола (особенно в о- и п-положениях) соответственно понижает или повышает его кислотные свойства. Это влияние аналогично действию заместителей на ароматическое кольцо сульфокислот (гл. 10.3.3.4). Так же, как и в аренсульфокислотах, электроноакцепторные заместители увеличивают кислотные свойства за счёт более полной делокализации отрицательного заряда в анионе; электронодонорные заместители, наоборот, уменьшают кислотные свойства, так как в этом случае их электронный эффект препятствует делокализации заряда аниона:
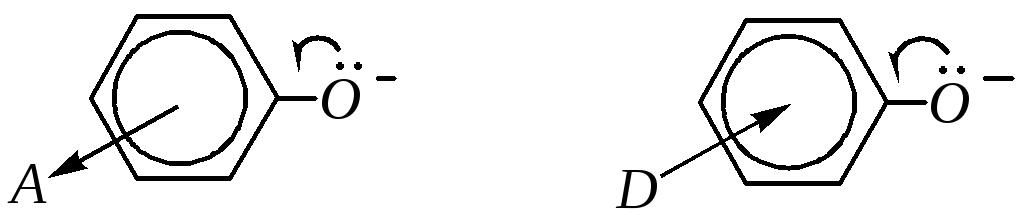
По тем же причинам (из-за р--сопряжения, в котором участвует неподелённая электронная пара электронов кислорода) основность фенолов значительно понижена по сравнению со спиртами.
10.5.3.2. Нуклеофильные свойства
За счёт +М-эффекта гидроксильной группы в молекуле фенола понижены как основные, так и нуклеофильные свойства. Поэтому реакции, в которых фенол играет роль нуклеофила, протекают с трудом. Повышению реакционной способности фенола способствует щелочная среда, при этом молекула фенола переходит в фенолят-ион. Такими реакциями являются алкилирование и ацилирование.
Алкилирование (образование простых эфиров). В общем случае щелочная среда способствует протеканию реакции поSN2-механизму, поэтому легче должны алкилироваться субстраты, имеющие доступный электрофильный реакционный центр с высоким эффективным положительным зарядом. Такими субстратами могут быть первичные алкилгалогениды и прежде всего — производные метана.
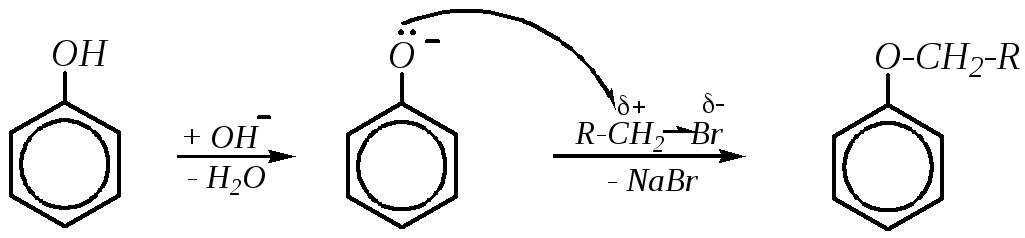
В ряде случаев в качестве метилирующего средства используется диметилсульфат, в частности, при синтезе метиловых эфиров гидрохинона, м-крезола, 4-метил-2-нитрофенола и др. Например:
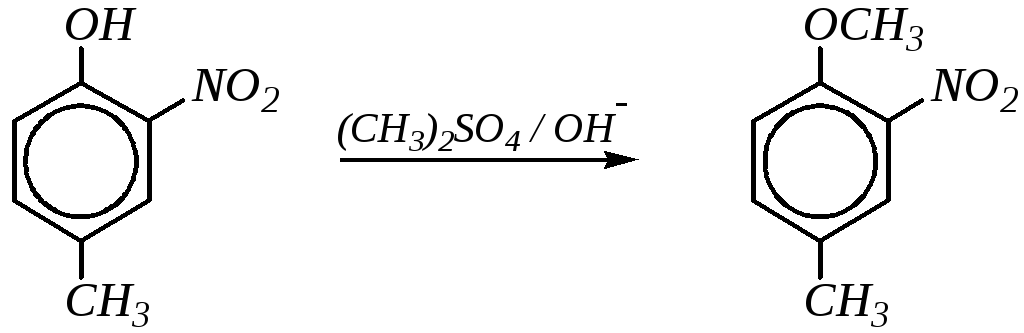
4-метил-2-нитрофенол 4-метил-1-метокси-2-нитробензол
Этим же способом можно получать о- и п-нитроанизолы из о- и п-нитрофенолов.
Ацилирование (образование сложных эфиров). По причине пониженной нуклеофильности гидроксогруппы фенолы могут подвергаться атаке только высокореакционноспособных ацилирующих агентов, таких как ангидриды и галогенангидриды карбоновых кислот. Реакцию проводят в слабощелочной среде (обычно в присутствии карбонатов):
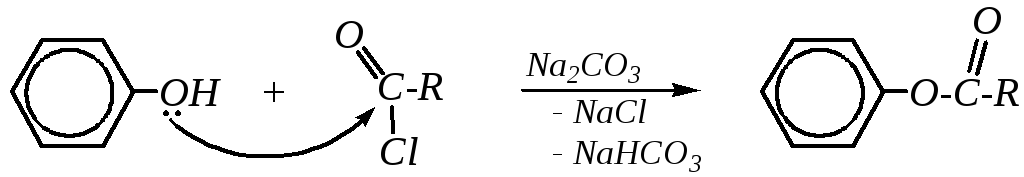
Ацилирование салициловой кислоты уксусным ангидридом используется в производстве препарата аспирин:
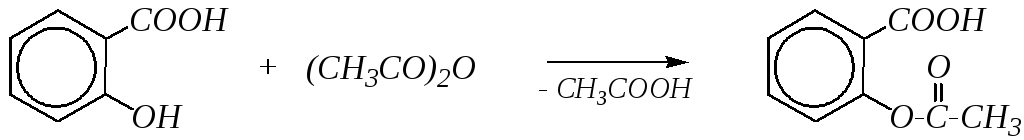
салициловая кислота аспирин
(О-ацетилсалициловая кислота)
Этерификация под действием карбоновых кислот для фенолов обычно не идёт и становится возможной только в присутствии сильных водоотнимающих средств (PCl3,POCl3,P2O5). Эта реакция используется в производстве лекарственного препаратасалол:
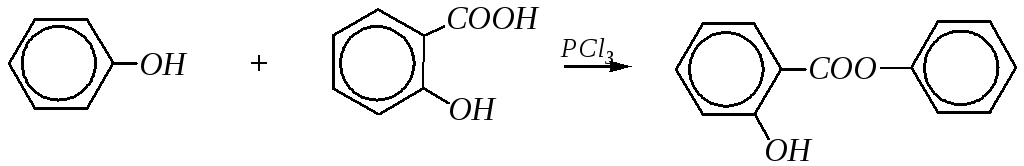
салициловая кислота салол (фенилсалицилат)
10.5.3.3. Электрофильное замещение
Фенолы подобно многим ароматическим соединениям способны вступать в реакции электрофильного замещения (SE). Более того, реакции фенолов с электрофильными реагентами протекают значительно легче, чем бензола и аренов. Это связано с большим+М-эффектом, оказываемым гидроксильной группой по отношению к бензольному кольцу (гл. 10.1.1). В результате электронная плотность на кольце повышена, и это повышение наблюдается главным образом во-ип-положениях.
Поэтому механизм взаимодействия фенола с электрофильной частицей можно представить следующим образом:
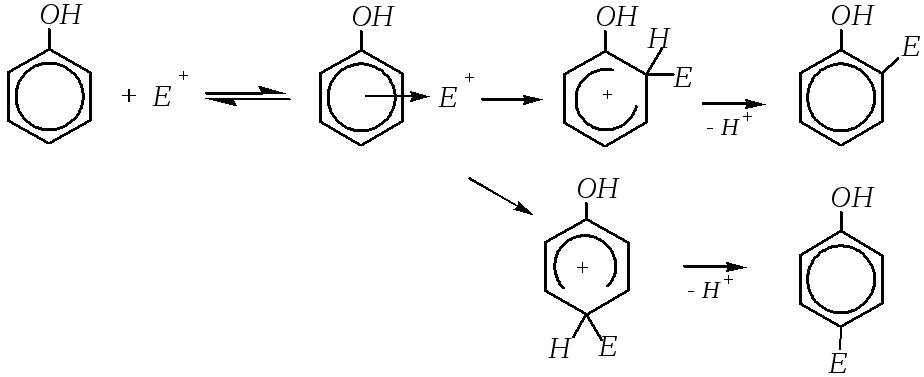
Вступление электрофила в о- и п-положения бензольного кольца может быть объяснено также динамическим подходом, то есть сравнением устойчивости образующихся -комплексов.
Рассмотрим некоторые примеры и особенности протекания реакций SEдля фенолов.
Галогенирование протекает легко. Катализатор не требуется. При хлорировании
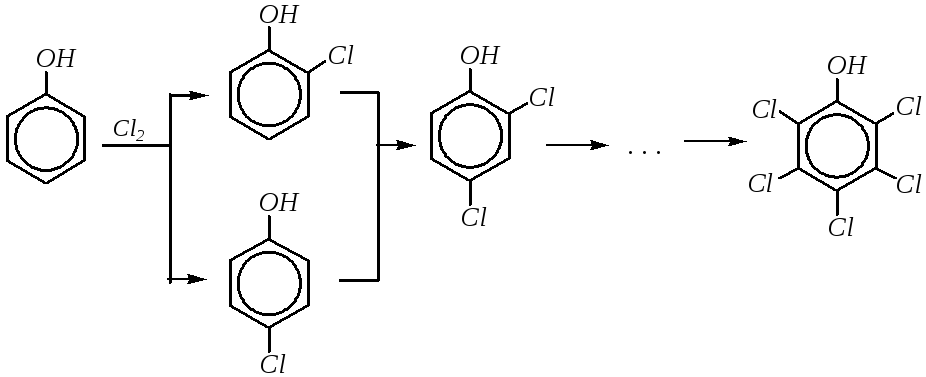
конечным продуктом может быть пентахлорфенол. Бромирование, как правило, проводят в разбавленных водных растворах. При этом осаждается бесцветный продукт тетрабромирования — 2,4,4,6-тетрабромциклогексадиен-2,5-он-1:
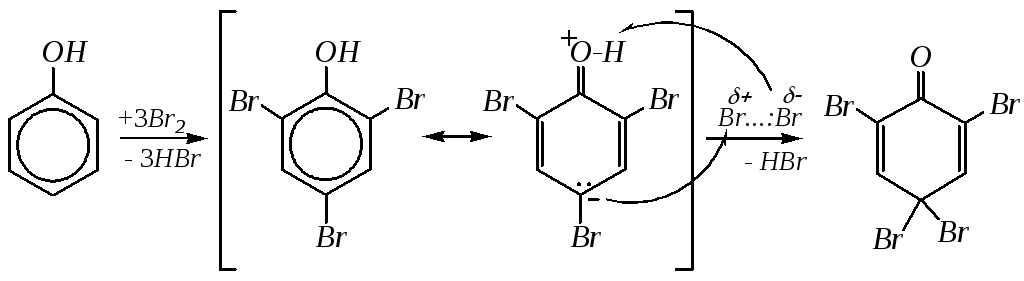
Нитрование может проводиться как концентрированной, так и разбавленной азотной кислотой. Концентрированная азотная кислота нитрует фенол сразу до ди- и тринитропроизводных, например:
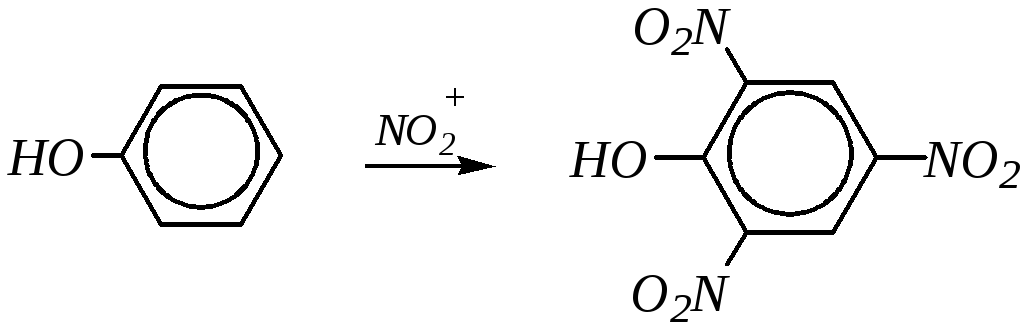 ,
,
при этом протекает сильное осмоление фенола.
В молекулах фенолов и их эфиров ароматическое кольцо в большой степени активировано для электрофильной атаки, поэтому может происходить не только замещение атома водорода, но и пространственно доступных алкильных групп:
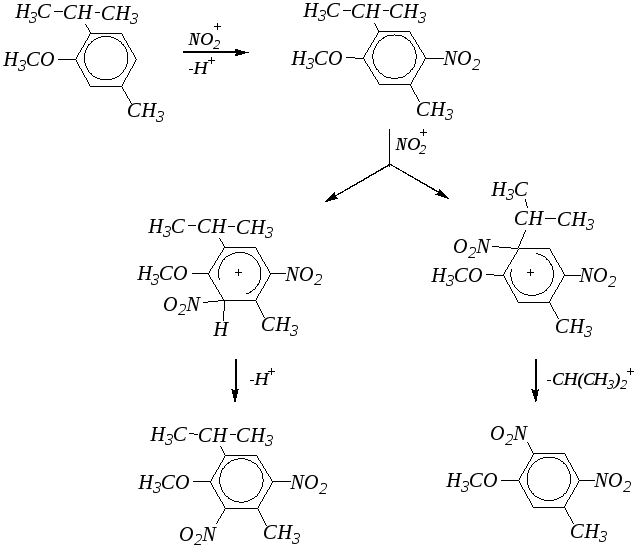
Действие разбавленной азотной кислоты на фенолы при комнатной температуре приводит к орто- ипара-замещённым мононитрофенолам:
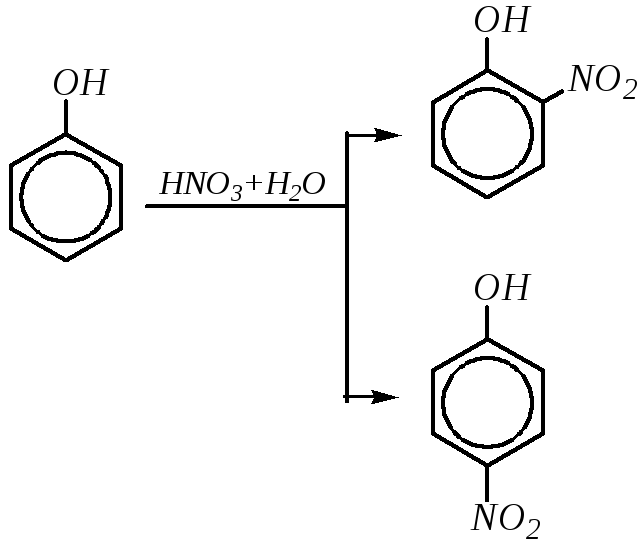
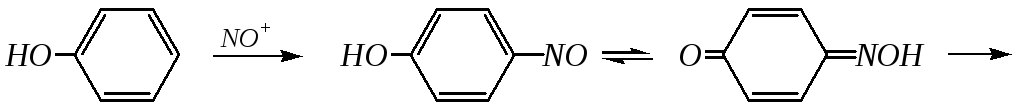
Учитывая, что в разбавленной кислоте нитроний-катион не образуется и потому нитрование по электрофильному механизму невозможно, реакция в данном случае представляет окислительное нитрозирование (за счёт диоксида азота, содержащегося в азотной кислоте):
2 NO2 NO+ + NO3¯
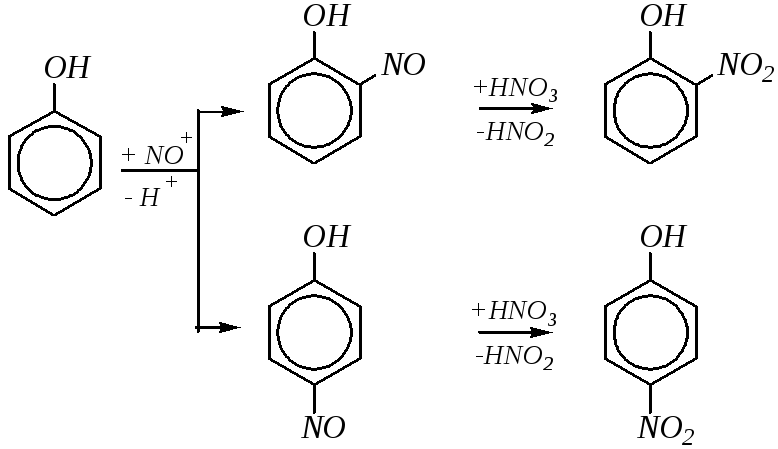
Поэтому для проведения мононитрования вместо разбавленной азотной кислоты может быть использована смесь азотной и азотистой кислот.
Кроме этого, нитрозированиеиспользуется и для определения фенолов (реакция Либермана). Фенол обрабатывают концентрированной серной кислотой и добавляют несколько капель водного раствора нитрита натрия. При разбавлении раствор приобретает красное окрашивание, при добавлении щёлочи окраска переходит в голубую. Эта цветная реакция объясняется образованием индофенола, анион которого имеет синюю окраску:
NaNO2 + H2SO4 NaHSO4 + HNO2
HNO2 + H2SO4 NO+ + HSO4¯ + H2O
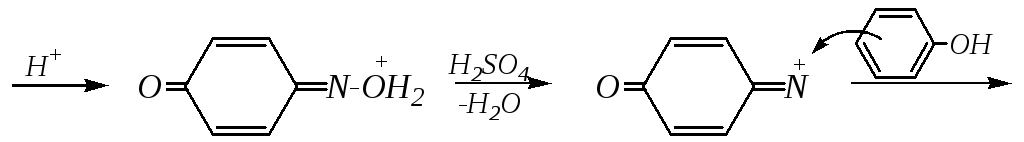

индофенол (красный цвет) синий цвет
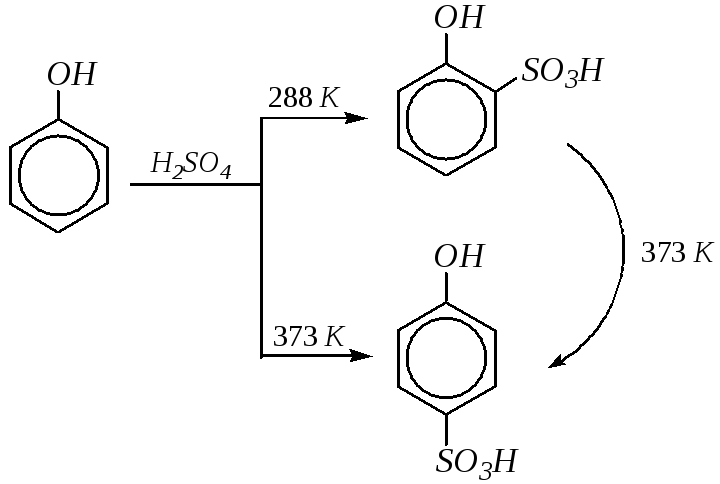
Сульфирование фенолов приводит к фенолсульфоновым кислотам. Соотношениеорто- ипара-изомеров определяется температурой реакции.о-Изомер образуется уже при 288К, но при температуре 373Ки выше он перегруппировывается в более стабильныйп-изомер.
Алкилирование. Как отмечалось в главе 10.5.3.2, алкилирование в щелочной среде протекает гладко по атому кислорода и приводит к образованию простых (алкилариловых) эфиров. Однако в кислой среде (или в присутствии кислотных катализаторов) нуклеофильность атома кислорода будет в значительной степени понижена, и реакция может протекать по бензольному кольцу с образованием более прочных углерод-углеродных связей. В качестве алкилирующих агентов обычно используют спирты и алкены в присутствии протонных кислот (H2SO4,H3PO4) или кислот Льюиса (BF3). Электрофильная частица образуется по схеме:

или
![]()
Взаимодействие таких электрофилов с фенолами приводит к образованию продуктов алкилирования в ароматическое кольцо:
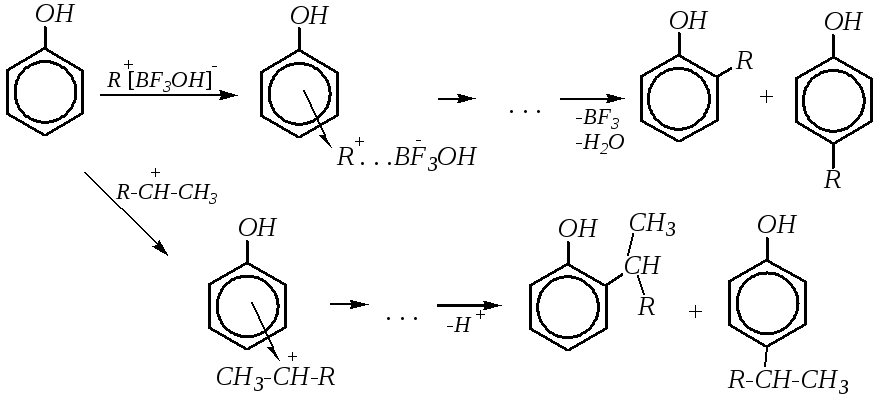
Кроме того, простые эфиры фенолов (полученные, в частности, при алкилировании фенолов по атому кислорода) в ряде случаев могут претерпевать перегруппировку, приводящую к образованию о- ип-алкилфенолов. Таким превращением являетсяперегруппировка Кляйзена, заключающаяся в миграции аллильного (или замещённого аллильного) радикала в аллиловых эфирах фенолов и приводящая к образованиюС-аллильных производных:
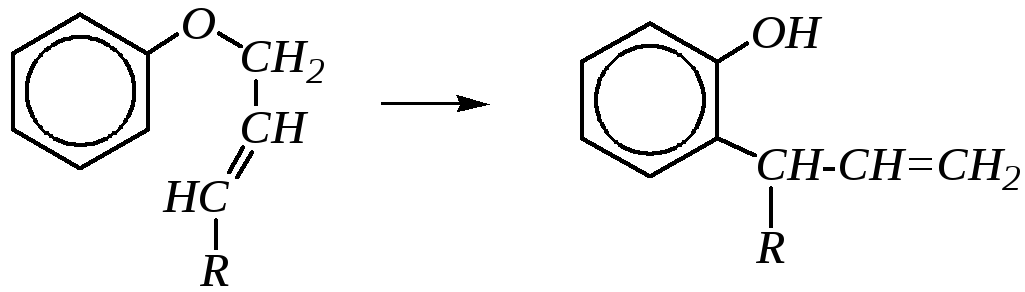
Механизм реакции учитывает повышение электронной плотности в о- ип-положениях бензольного кольца и возможность электрофильной атаки аллильного фрагмента по кольцу:
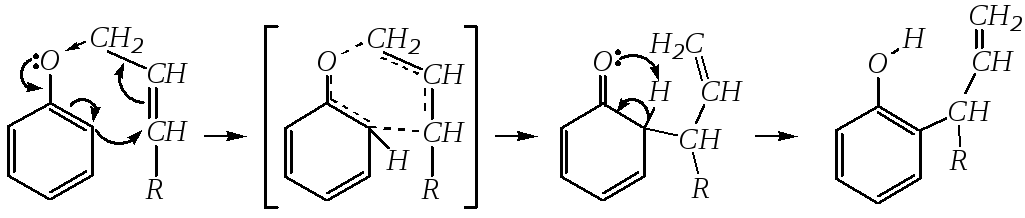
Если оба о-положения заняты и прототропная таутомерия промежуточного циклического кетона невозможна, то протекает повторная перегруппировка и образуетсяп-аллильное производное:

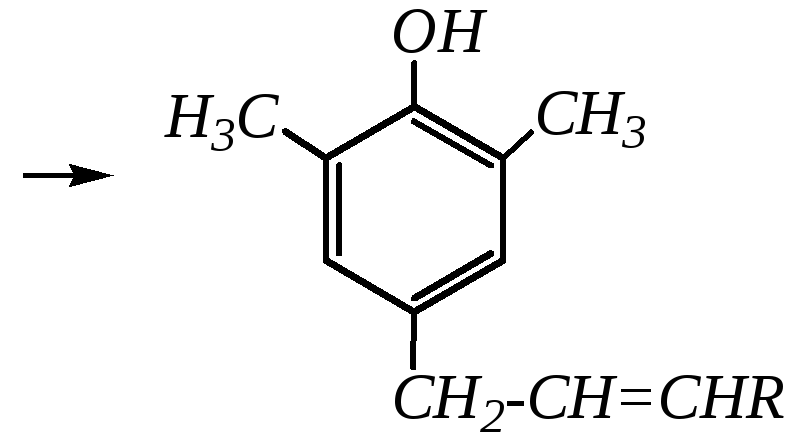
Ацилирование фенолов, как и алкилирование, может протекать не только по атому кислорода, но и по атомам углерода бензольного кольца. Однако для этого требуется применение кислот Льюиса (AlCl3) в качестве катализатора. Это типичная реакция Фриделя–Крафтса в ароматическом ряду:
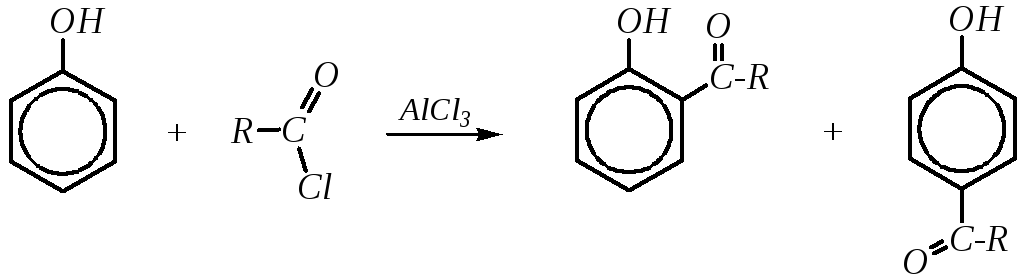
Аналогичные ацилфенолы могут быть получены перегруппировкой сложных эфиров фенолов (перегруппировка Фриса*). Для этого также необходимо применение кислот Льюиса:
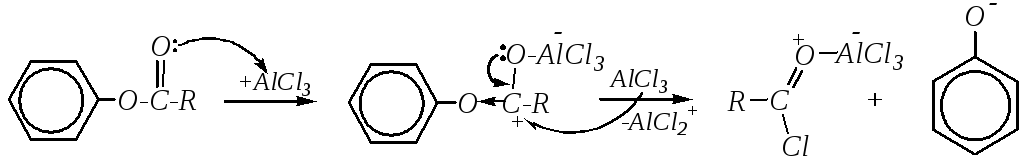
Дальнейшее взаимодействие образовавшихся ацилхлорида и фенолят-иона — это реакция Фриделя–Крафтса. В целом схему перегруппировки Фриса можно изобразить следующим образом:
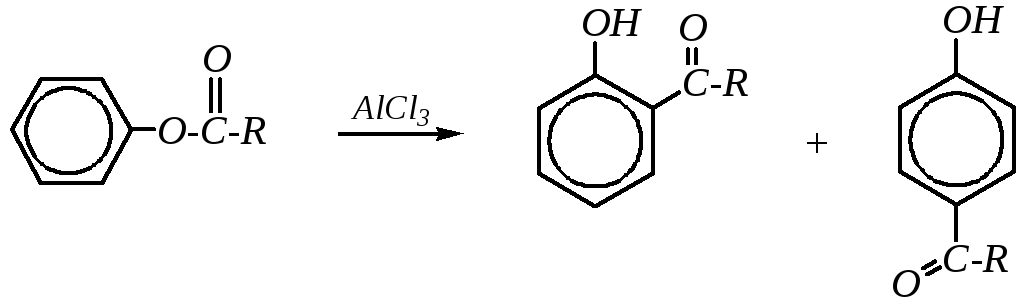
Взаимодействие с формальдегидом. Так же, как и алкилирование и ацилирование фенолов, взаимодействие с формальдегидом — типичная реакция электрофильного замещения в ароматическое кольцо, характерная для активированных ароматических соединений. При проведении реакции в мягких условиях образуютсяорто-ипара-гидроксиметилфенолы:
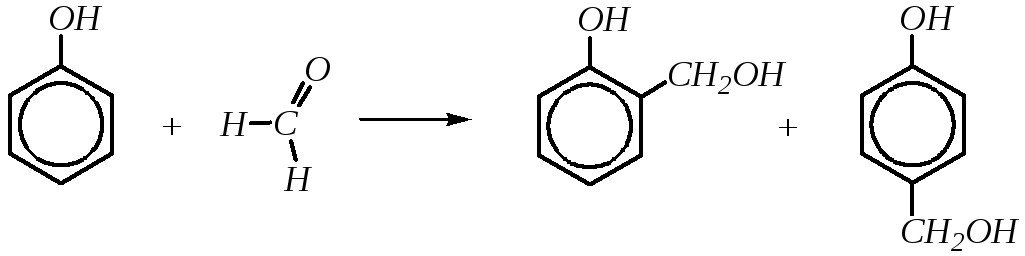
Реакция может идти как в кислой, так и в щелочной среде. Кислая среда активирует электрофильный реагент, превращая молекулу формальдегида в карбокатион:
![]() ,
,
который далее взаимодействует с молекулой фенола как электрофил с обычным ароматическим субстратом. Щелочная среда активирует молекулу субстрата, превращая её в фенолят-ион, способный к взаимодействию даже с очень слабыми электрофилами:
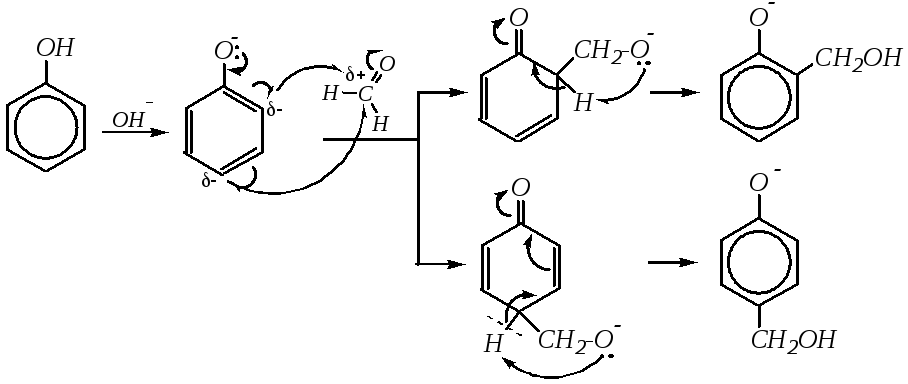
Далее гидроксиметилфенол может снова вступать во взаимодействие со следующей молекулой формальдегида за счёт свободных о- ип-положений, а может взаимодействовать с молекулой фенола в качестве алкилирующего агента. Таким образом, в жёстких условиях образуются продукты поликонденсации — фенолоформальдегидные смолы, как линейные, так и разветвлённые:
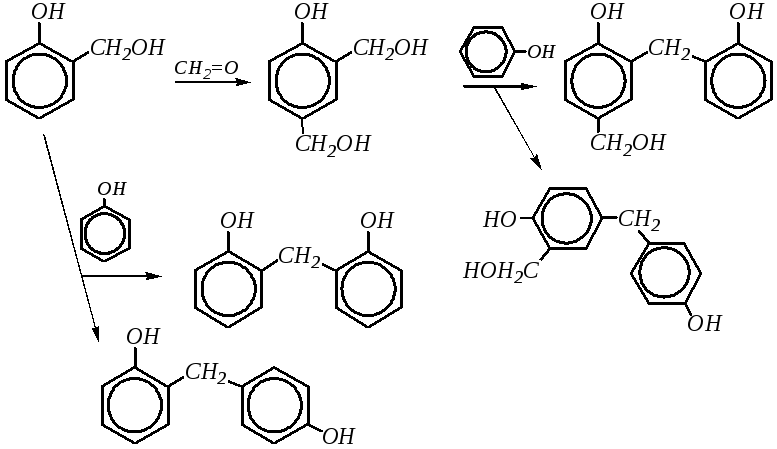
В целом схему образования линейного полимера можно представить следующим образом:
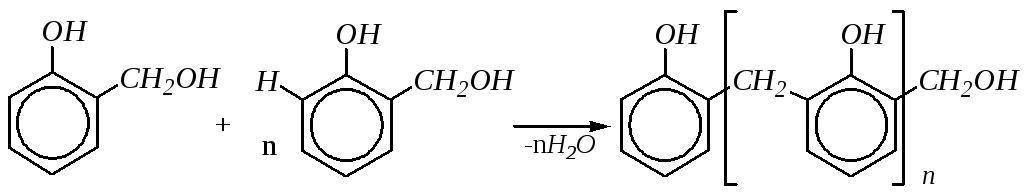
Карбоксилирование с образованием фенолкарбоновых кислот можно условно считать частным случаем реакции ацилирования, в которой в качестве ацилирующей частицы выступает молекулаCО2. В частности, реакцию получения салициловой кислоты из фенолята натрия
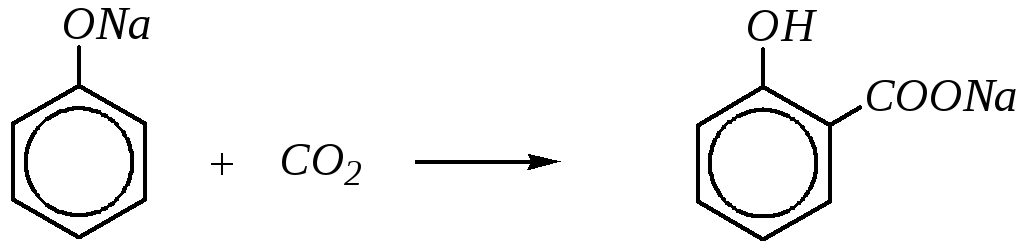
салицилат натрия
называют реакцией Кольбе–Шмитта*. По методу Кольбе (1860 г.) фенолят натрия нагревают с диоксидом углерода под давлением при 453—473К. В 1885 г. Шмитт улучшил метод Кольбе, предложив проводить реакцию при менее высокой температуре (400К) в течение более длительного времени. Механизм реакции можно представить так:
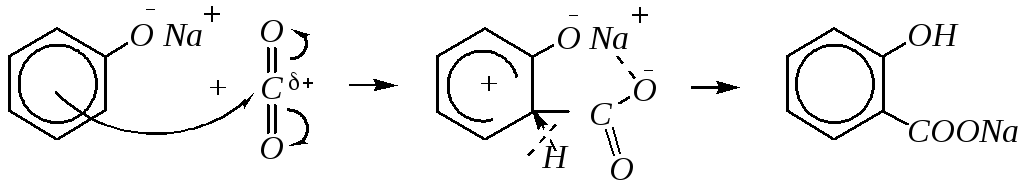
10.5.3.4. Нуклеофильное замещение гидроксогруппы
В молекулах фенолов, не содержащих сильных электроноакцепторных групп, OН-группа не замещается, в частности на галоген, при обработке галогеноводородными кислотами. А при действииPCl3вместо ожидаемого хлорбензола образуются эфиры фосфористой кислоты, а при действииPОCl3— эфиры фосфорной кислоты. Например:
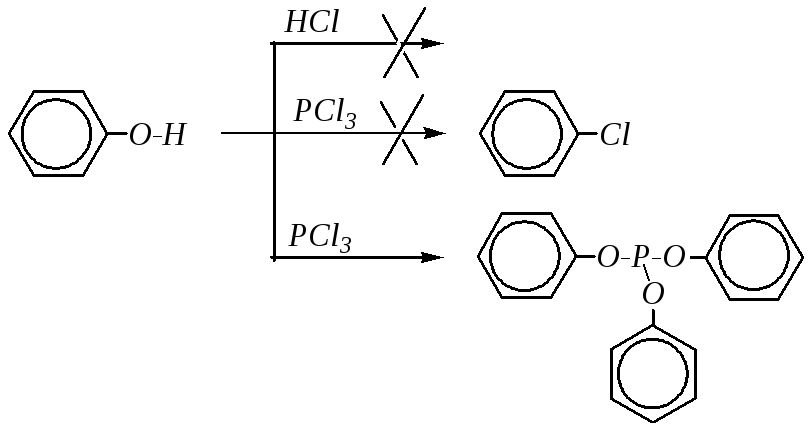
Однако при наличии в орто- ипара-положениях сильных электроноакцепторов нуклеофильное замещение идёт легко при действии, например,PCl5:
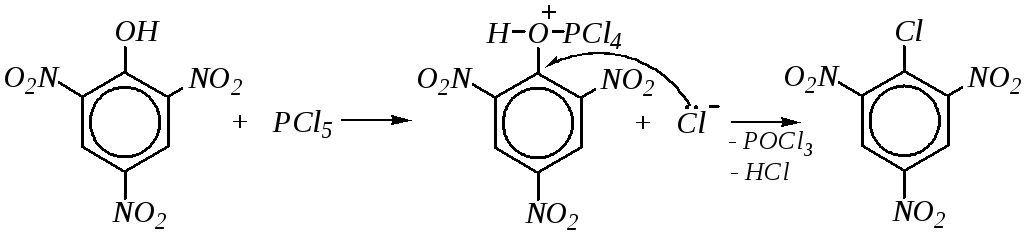
10.5.3.5. Окисление и восстановление
Фенолы сравнительно легко окисляются. Эта способность связана с возможностью образования устойчивого феноксильного (ароксильного) радикала
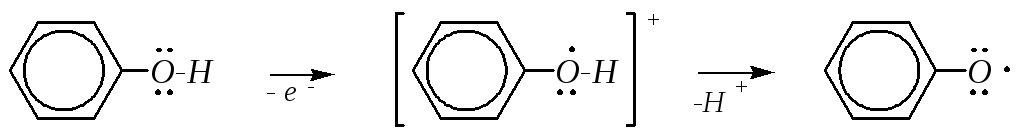 ,
,
в котором неспаренный электрон делокализован за счёт р--сопряжения с бензольным кольцом. Особенно легко происходит окисление в щелочной среде, при этом окисляется фенолят-ион:
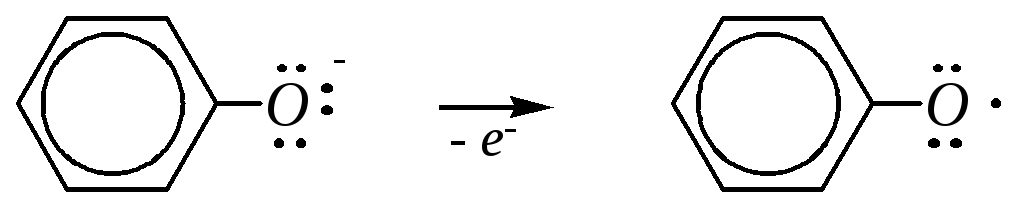
Дальнейшие превращения феноксильного радикала приводят обычно к продуктам димеризации и олигомеризации, например:
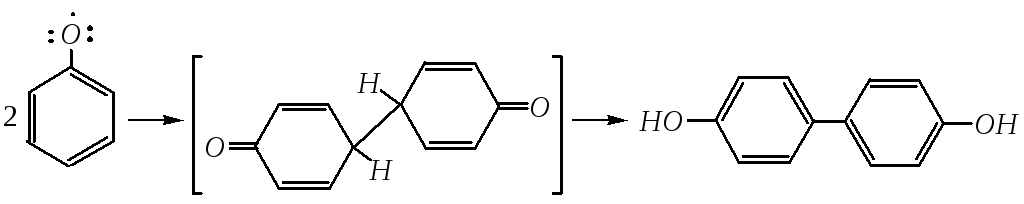 п,п-дигидроксидифенил
п,п-дигидроксидифенил
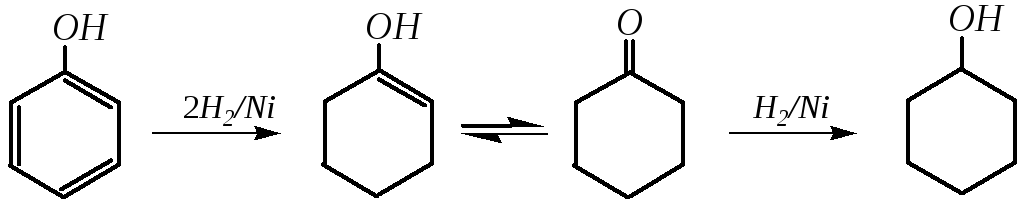
Реакции восстановления фенолов сводятся либо к гидрированию бензольного кольца, приводящему к образованию циклических спиртов и кетонов, либо к восстановлению самой гидроксогруппы с сохранением бензольного кольца. При гидрировании фенола на никелевом катализаторе (1 МПа, 400—410К) получается циклогексанол, в качестве промежуточного продукта можно получить циклогексанон:
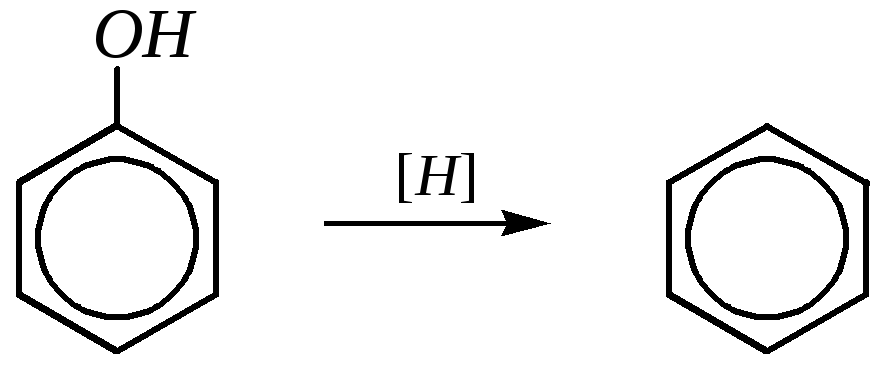
В более жёстких условиях, например, при обработке цинковой пылью или сульфидом молибдена (II) при нагревании и под давлением, фенол может восстанавливаться до бензола:
Особенности свойств двухатомных фенолов
К двухатомным фенолам относят как родоначальные соединения: пирокатехин, резорцин и гидрохинон (гл. 10.5.1), так и их гомологи и производные. Двухатомные фенолы дают те же реакции, что и фенол. Это кислотно-оснόвные свойства, реакции алкилирования, ацилирования как по атому кислорода, так и в ароматическое кольцо, другие реакции электрофильного замещения.
Кислотные свойства пирокатехина, резорцина и гидрохинона по первой ступени диссоциации близки к кислотным свойствам фенола. Но наибольшими кислотными свойствами среди них обладают резорцин (рКа = 9.20) из-за отсутствия мезомерного взаимодействия двух гидроксогрупп между собой и пирокатехин (рКа = 9.25) из-за возможности образования внутримолекулярной водородной связи между гидроксогруппами:
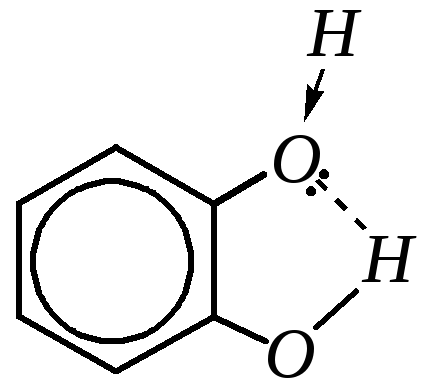
пирокатехин
Реакции алкилирования по атому кислорода для двухатомных фенолов протекают легко, причём пирокатехин при взаимодействии с дигалогеналканами может образовывать циклические эфиры:
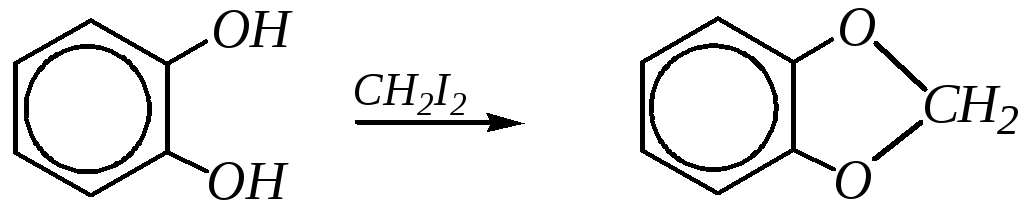
Электрофильное замещение по ароматическому кольцу для двухатомных фенолов также протекает легко, и особенно легко для резорцина, в бензольном кольце которого гидроксильные группы согласованно повышают электронную плотность на 2, 4 и 6-м атомах углерода. Поэтому резорцин может, например, вступать в реакцию карбоксилирования в обычных условиях в среде водного раствора гидрокарбоната калия:
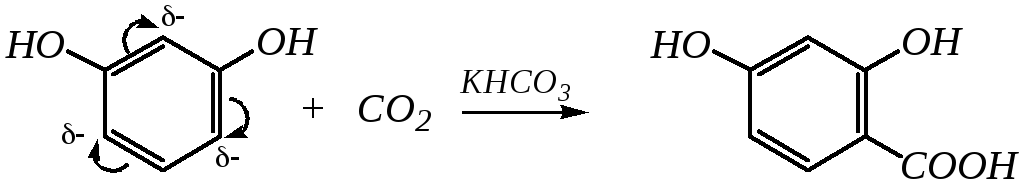
резорцин резорциловая кислота
Реакции окисления пирокатехина и гидрохинона протекают легче, чем фенола; в результате образуются хиноны:
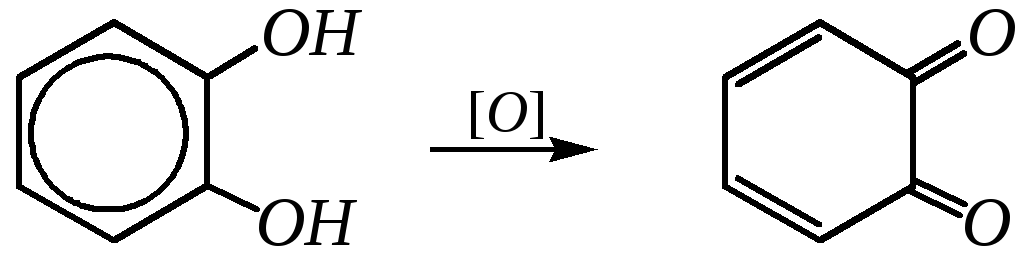
о-бензохинон
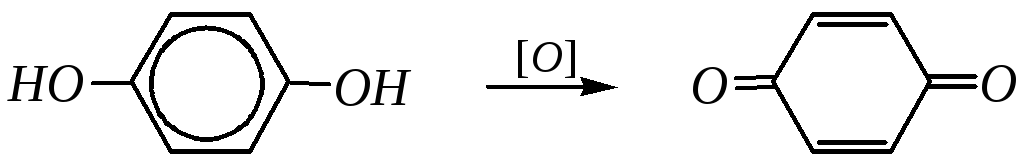
п-бензохинон
Так, гидрохинон легко окисляется, например, хлоридом железа (III) или солями арендиазония (гл. 10.7), поэтому реакция азосочетания, характерная для фенолов (гл. 10.7.4.3), для него не протекает.
Резорцин устойчивее к окислению, для него невозможно образование хинона. Но он легче подвергается восстановлению, это обусловлено способностью к кето-енольной таутомерии:
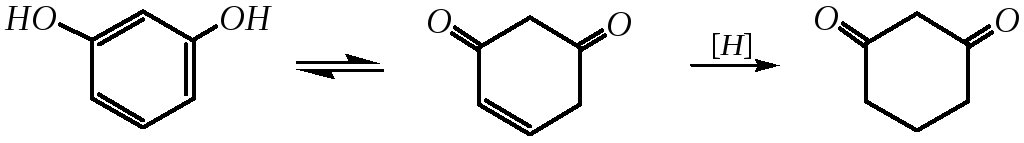
Восстановление может проводиться амальгамой натрия или каталитически в щелочной среде.
Как и сам фенол, двухатомные фенолы дают цветные реакции с FeCl3: для фенола она красно-фиолетовая, для пирокатехина — зелёная, для резорцина — ярко-фиолетовая, для гидрохинона — синяя. Окраска связана с образованием комплексных фенолятов с участием иона Fe3+.
Особенности свойств ароматических спиртов
Как следует из строения, химические свойства фенолов и ароматических спиртов должны сильно различаться. Так, свойства фенолов должны определяться, с одной стороны, возможностью протекания реакций по ароматическому кольцу (как для любых замещённых бензолов), а с другой стороны — способностью к взаимодействиям с участием гидроксильной группы. Аналогично и для ароматических спиртов. Их свойства определяются наличием как бензольного кольца, так и фрагмента алифатического спирта.
Ароматические спирты по своим кислотно-основным свойствам близки к алифатическим спиртам, однако для бензилового спирта и его производных характерны высокие оснóвные свойства, обусловленные образованием устойчивого карбокатиона при диссоциации молекулы спирта по связи С–О.
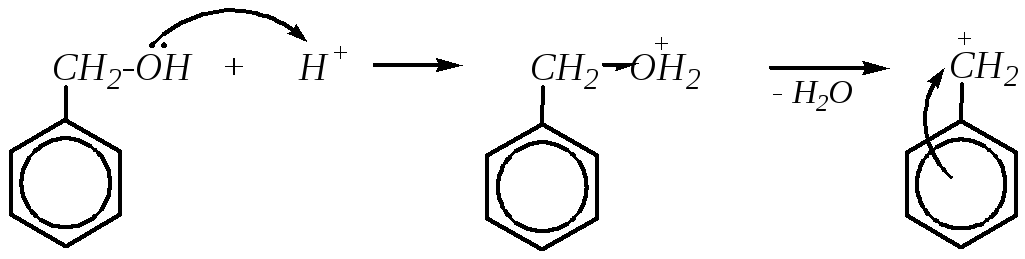
бензиловый спирт
По той же причине, то есть за счёт образования устойчивого карбокатиона, бензиловый спирт и его производные легко вступают в реакции нуклеофильного замещения гидроксогруппы, протекающие по механизму SN1.
способы получения фенолов и ароматических спиртов
Фенол и его ближайшие гомологи получают из продуктов коксования каменного угля и синтетически.
Среди синтетических способов получения фенолов и ароматических спиртов наибольшее значение имеют следующие.
1. Щелочной гидролиз хлорбензола, протекающий в жёстких условиях (гл. 10.2.4.2). Более экономичным в промышленности является парофазный каталитический гидролиз хлорбензола при 670 К и атмосферном давлении, протекающий по схеме:

Гидролизом галогенопроизводных углеводородов получают также гидрохинон (из п-дихлорбензола) и можно получать любые ароматические спирты аналогично алифатическим спиртам (гл. 3.2.2.1), в частности таким способом получают бензиловый спирт.
2. Кумольный метод получения фенола является наиболее экономичным. Он был разработан Р.Ю. Удрисом и П.Г. Сергеевым для получения фенола из изопропилбензола (кумола).
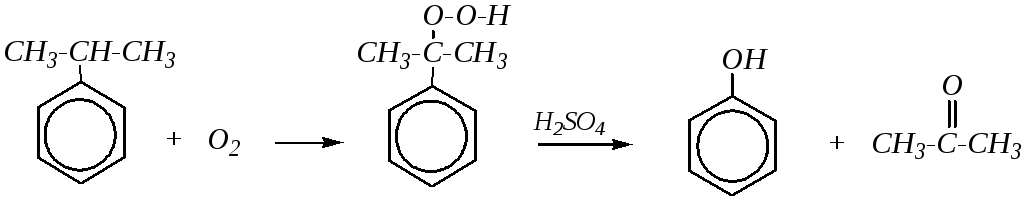
Механизм реакции:
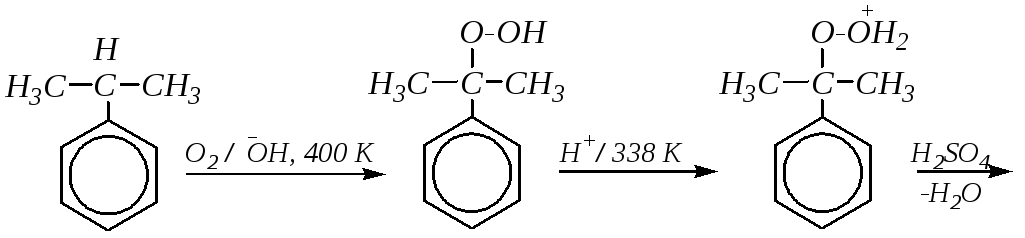

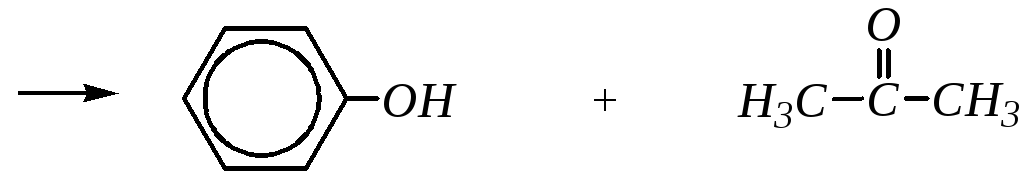
Но этот метод может применяться и для получения гомологов и производных фенолов:
Ar-CH(CH3)2
![]() Ar-C(CH3)2-OOH
Ar-C(CH3)2-OOH
![]() Ar-OH
+CH3-CO-CH3
Ar-OH
+CH3-CO-CH3
Щелочное плавление солей ароматических сульфокислот может применяться для получения одноатомных фенолов, но широкое применение этот способ нашёл для получения резорцина:
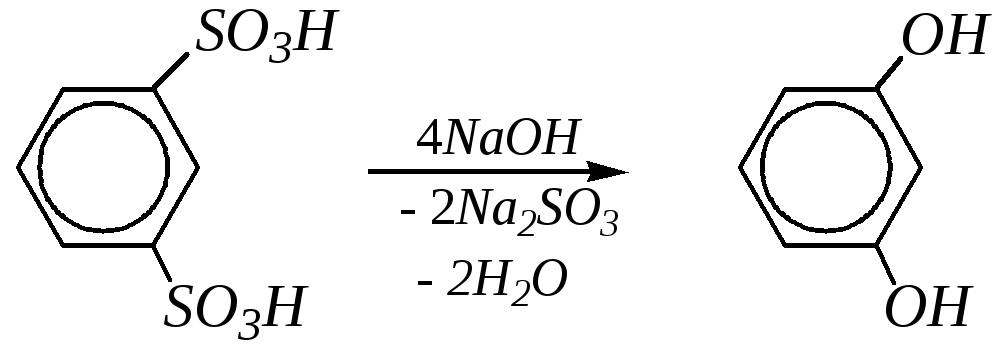
Фенолы могут быть получены при замене первичной аминогруппы в ароматическом кольце (через образование диазосоединения и последующий его гидролиз):
Ar-NH2
![]() [Ar-N2]+Cl¯
[Ar-N2]+Cl¯
![]() Ar-OH
+
HCl + N2
Ar-OH
+
HCl + N2
Окислительное декарбоксилирование бензойной кислоты при температуре 520 К может применяться для получения фенола, так как способ экономически выгодный (сама бензойная кислота получается при окислении толуола). Схема процесса:
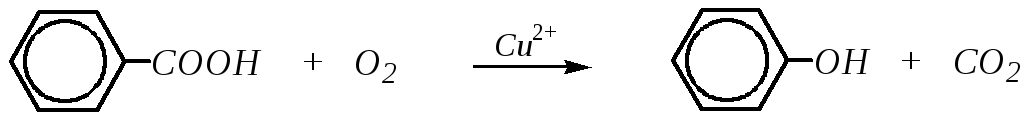
Для получения ароматических спиртов, содержащих гидроксогруппу у -углеродного атома (например, 2-фенилэтанол-1), используется алкилирование бензольного кольца с помощью эпоксиэтана:
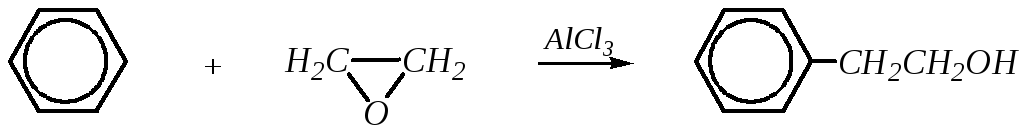
Ароматические спирты можно также получать и обычными методами, характерными для алифатических спиртов. Кроме гидролиза галогенопроизводных углеводородов, применяются металлорганический синтез, восстановление карбонильных соединений и другие способы (гл. 3.3.4).
хиноны
Хиноны можно рассматривать как циклические непредельные дикетоны с сопряжёнными связями. Моноциклическими являются бензохиноны: 1,2-бензохинон (о-бензохинон), 1,4-бензохинон (п-бензохинон) и их производные, например: толухинон, хлоранил.
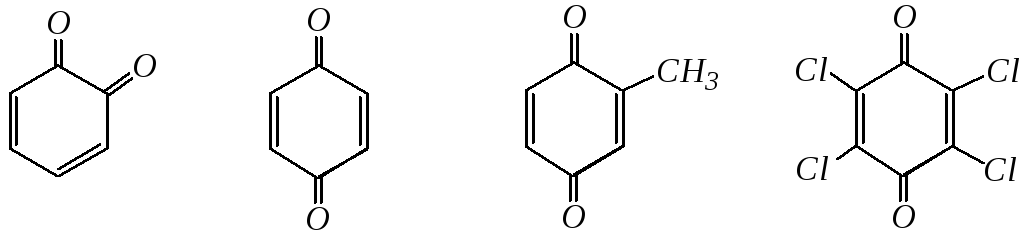
о-бензохинон п-бензохинон толухинон хлоранил
(метил-1,4-бензохинон) (2,3,5,6-тетрахлор-
1,4-бензохинон)
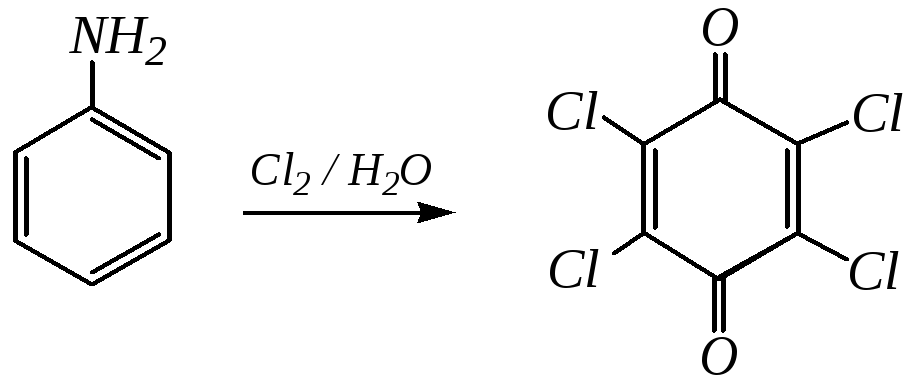
орто- и пара-бензохиноны обычно получаются при окислении соответствующих двухатомных фенолов — пирокатехина и гидрохинона (гл. 10.5.4). В качестве окислителей могут быть использованы хромовая смесь (K2Cr2O7 + H2SO4), оксид серебра, хлорид железа (III). А хлоранил, например, получается при энергичном хлорировании анилина:
Хиноны являются окрашенными кристаллическими веществами: о-бензохинон окрашен в красный цвет, п-бензохинон — в жёлтый цвет.
В молекулах хинонов карбонильные группы оказывают значительный электроноакцепторный эффект. Поэтому на атомах углерода наблюдается существенный дефицит электронной плотности, причём в молекуле п-бензохинона все атомы углерода идентичны между собой:
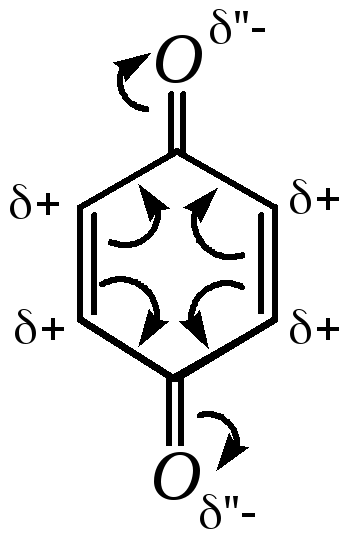
Таким образом, хиноны — соединения с выраженными электроноакцепторными свойствами и обладающие окислительной способностью.
При присоединении электрона (на катоде или при действии восстановителей) образуется семихинон:
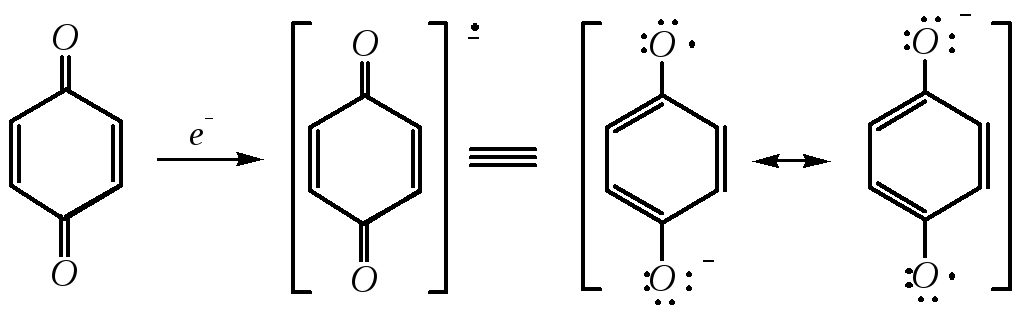 ,
,
который способен присоединять ещё один электрон и превращаться в анион гидрохинона:
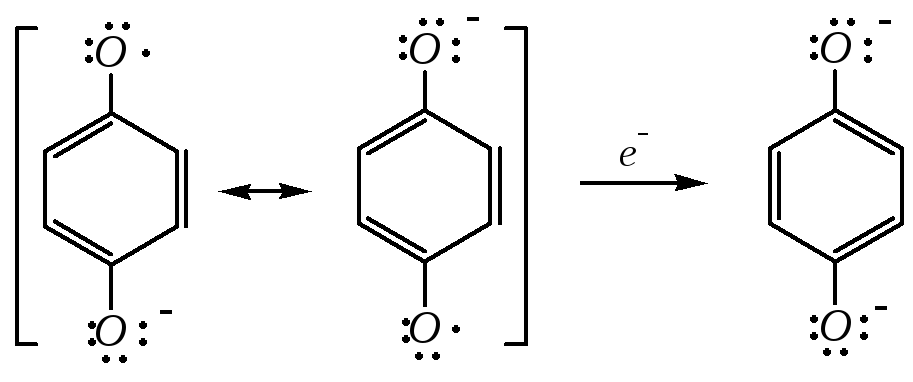
В результате хинон и гидрохинон образуют окислительно-восстановительную систему:
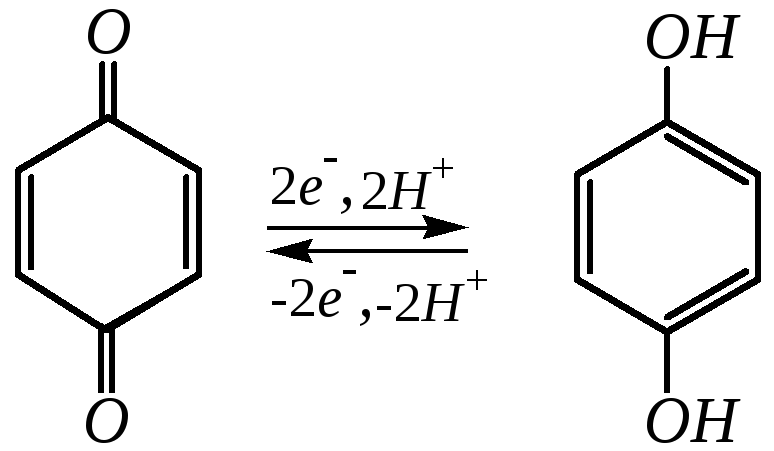 ,
,
причём эквимолярная смесь хинона и гидрохинона представляет собой комплекс, называемый хингидроном, являющийся основой используемого в электрохимии хингидронного электрода.
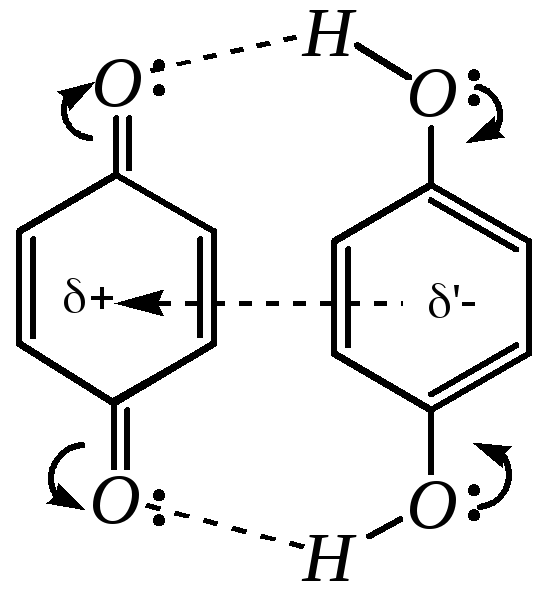
хингидрон
Такой комплекс является комплексом с переносом заряда. (Аналогичные комплексы с переносом заряда образуют нитросоединения — гл. 10.4.3.4).
Бензохиноны способны присоединять различные нуклеофильные реагенты, такие как спирты, тиоспирты, амины, галогеноводороды. Присоединению способствует кислотный катализ. При этом образуются соответствующие замещённые двухатомные фенолы. Например:
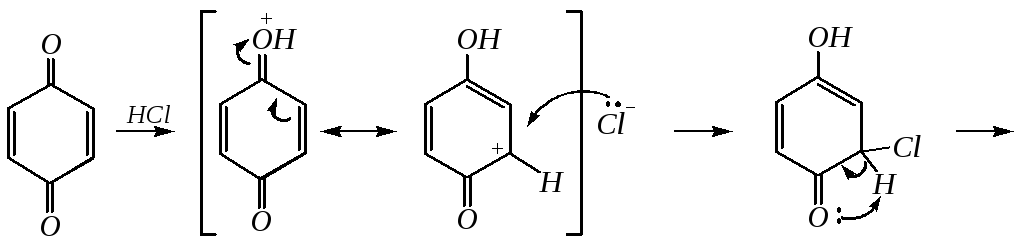
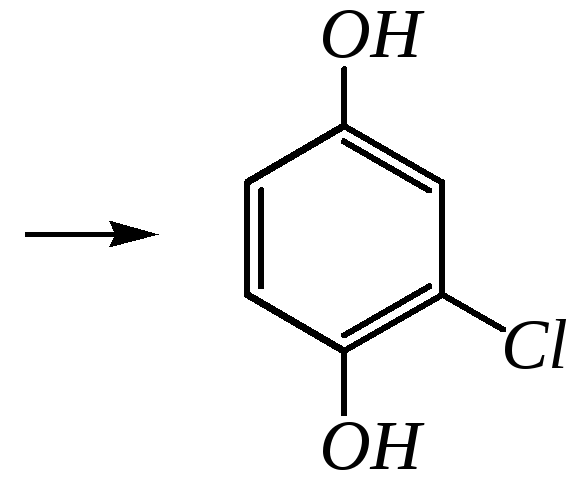
2-Хлоргидрохинон окисляется исходным хиноном до 2-хлор-1,4-бензохинона:
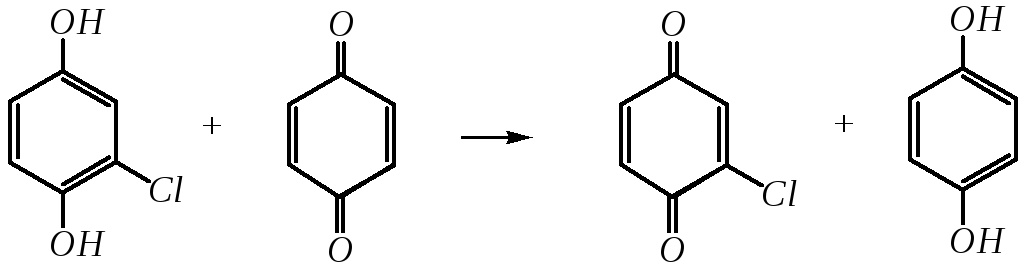 ,
,
который может дальше присоединять хлороводород. В результате образуются ди-, три- и тетрахлорбензохиноны.
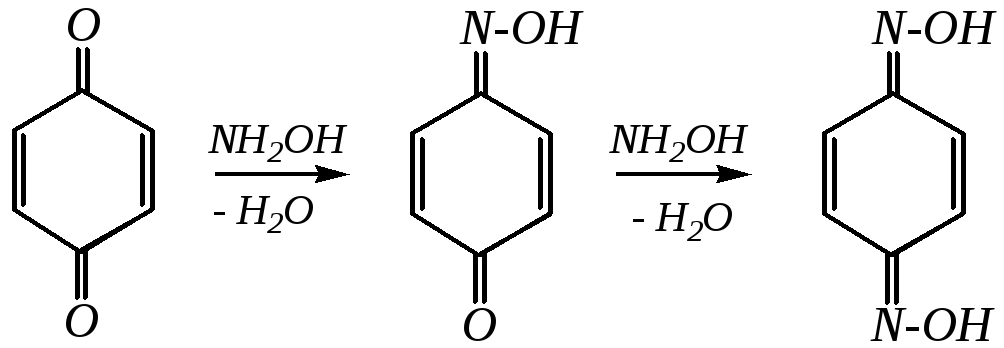
Однако 1,4-бензохиноны могут вступать в типичные реакции 1,2-присоединения по карбонильной группе. С гидроксиламином они дают, например, моно- и диоксимы (гл. 6.1.4.1):
Но при взаимодействии с ароматическими аминами реакция протекает как 1,4-присоединение (см. выше):


2,5-бис-(ариламино)-1,4-бензохинон
Хиноны участвуют в реакциях диенового синтеза в качестве диенофилов. Например:
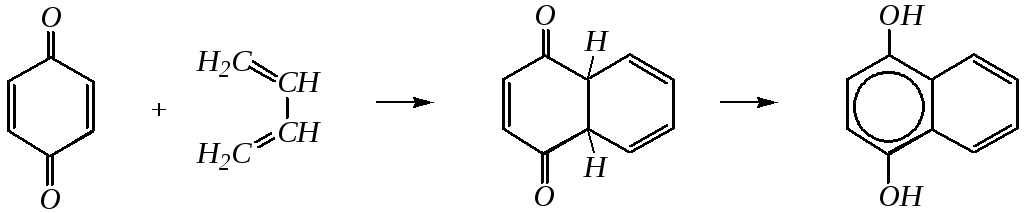
физиологическое действие и Важнейшие представители
К классу фенолов относится большая группа лекарственных веществ, обладающих антисептическими свойствами. Антисептические свойства фенолов основаны на их способности свёртывать белки. При введении в молекулу фенола таких заместителей, как алкил, алкоксил, галоген, усиливается бактерицидная активность. Увеличение длины алкильной цепи или разветвление её приводит к усилению антисептического действия. В отличие от алифатических спиртов при увеличении числа гидроксильных групп в ароматическом кольце увеличивается токсичность соединения.
Смесь о-, п- и м-крезолов также используется в качестве антисептика. Раздражающее и токсическое действие крезолов на организм выражено слабее, что связано с их меньшей растворимостью.
Двухатомный фенол, резорцин, по токсичности близок фенолу, но антисептические свойства у него выражены сильнее. Резорцин находит применение при лечении кожных заболеваний.
Фенол — кристаллическое вещество с температурой плавления 314 К и своеобразным запахом. При комнатной температуре малорастворим в воде, но при 340 К смешивается с водой в любых соотношениях. При попадании на кожу фенол вызывает ожоги. Проявляет антисептические свойства.
В промышленности фенол получают главным образом синтетически — кумольным методом.
Основное количество фенола используется для получения фенолоформальдегидных смол, применяемых в производстве пластмасс, и для получения циклогексанола, используемого в производстве синтетического волокна.
Ионол (2,6-ди-трет-бутил-4-метилфенол) — бесцветное кристаллическое вещество с температурой плавления 343 К.
Получают ионол алкилированием п-крезола. Широко применяется в качестве антиоксиданта для стабилизации полимерных материалов, парфюмерно-косметических изделий.
Пирокатехин (1,2-дигидроксибензол) — бесцветное кристаллическое вещество с температурой плавления 377 К, хорошо растворимое в воде.
В промышленности пирокатехин получают прямым гидроксилированием фенола пероксидом водорода или пероксокислотами. Используется в качестве восстановителя в фотографии и как аналитический реагент для определения некоторых металлов.
Резорцин (1,3-дигидроксибензол) — бесцветное кристаллическое вещество со слабым запахом и температурой плавления 384 К, хорошо растворимое в воде.
Резорцин получают щелочным плавлением м-бензолдисульфокислоты. Используется для получения красителей, антисептиков, антиоксидантов, взрывчатых веществ.
Гидрохинон (1,4-дигидроксибензол) — бесцветное кристаллическое вещество с температурой плавления 443 К. Растворим в воде.
Гидрохинон получают щелочным плавлением п-бензолдисульфо-кислоты, гидролизом п-хлорфенола и прямым гидроксилированием фенола пероксокислотами. Широко используют в производстве красителей, в качестве восстановителя в фотографии, а также антиоксиданта и ингибитора полимеризации.
Бензиловый спирт — бесцветная жидкость с приятным запахом и температурой кипения 479 К. Содержится в эфирных маслах некоторых растений.
Синтетически получают из бензилхлорида. Используют в парфюмерии и лакокрасочной промышленности.
2-Фенилэтанол-1 — бесцветная жидкость с запахом роз и температурой кипения 494 К. Содержится в розовом масле.
Синтетически получают из бензола и эпоксиэтана. Применяют в парфюмерии.
Анизол — бесцветная жидкость с приятным запахом, нерастворимая в воде; температура кипения 428 К. Используют в органическом синтезе и в качестве растворителя в парфюмерной промышленности.
Гваякол — бесцветное кристаллическое вещество; температура плавления 371 К. Используют для синтеза душистых и лекарственных веществ.
Вератрол (диметиловый эфир пирокатехина, 1,2-диметоксибензол) — бесцветное вещество; температура плавления 296 К; температура кипения 480 К. Используют в органическом синтезе для получения душистых веществ.
п-Бензохинон — жёлтое кристаллическое вещество со своеобразным запахом, напоминающим запах хлора; температура плавления 389 К; легко возгоняется. Получают окислением анилина и используют его для получения гидрохинона и в качестве исходного вещества для дальнейших синтезов.
Хлоранил — жёлтое кристаллическое вещество со слабым своеобразным запахом; температура плавления 563 К; легко возгоняется. Получают хлорированием анилина или фенола и используют его в качестве окислителя и для получения синтеза красителей.
