- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.2.3. Физические свойства
Среди галогенопроизводных ароматических углеводородов преобладающее большинство — жидкости. Температуры кипения зависят от природы галогена и увеличиваются от фторопроизводных к йодопроизводным, так как с увеличением геометрических размеров молекул и их поляризуемости возрастают силы сцепления между молекулами. Плотность галогенопроизводных больше 1 г/мл и при увеличении числа атомов галогена в кольце заметно увеличивается. Все галогенопроизводные, как правило, нерастворимы в воде, но растворяются в органических растворителях. Соединения с атомом галогена в -положении боковой цепи обладают сильным слезоточивым запахом.
10.2.4. Химические свойства
Химические свойства рассматриваемых соединений должны определяться, с одной стороны, возможностью протекания реакций по ароматическому кольцу (как для любых замещённых бензолов), а с другой стороны — способностью к взаимодействиям с участием атома галогена.
10.2.4.1. Электрофильное замещение в ароматическом кольце арилгалогенидов
За счёт электроноакцепторного индуктивного эффекта галогена электронная плотность на бензольном кольце понижена по сравнению с незамещённым бензолом, и поэтому электрофильные реакции затруднены. Реакции нитрования, сульфирования и галогенирования протекают в более жёстких условиях и с меньшей скоростью, чем для бензола.
Атомы галогенов в этих реакциях ориентируют вступающие группы в о-ип-положения, что обусловлено проявлением этими атомами +М-эффекта по отношению к бензольному кольцу, который усиливается благодаря временной поляризации молекулы субстрата при приближении электрофила:
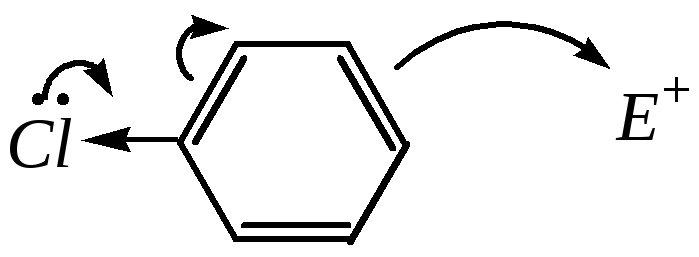
Поэтому механизм взаимодействия хлорбензола с электрофильной частицей можно представить следующим образом:

Примеры реакций электрофильного замещения в молекуле хлорбензола:
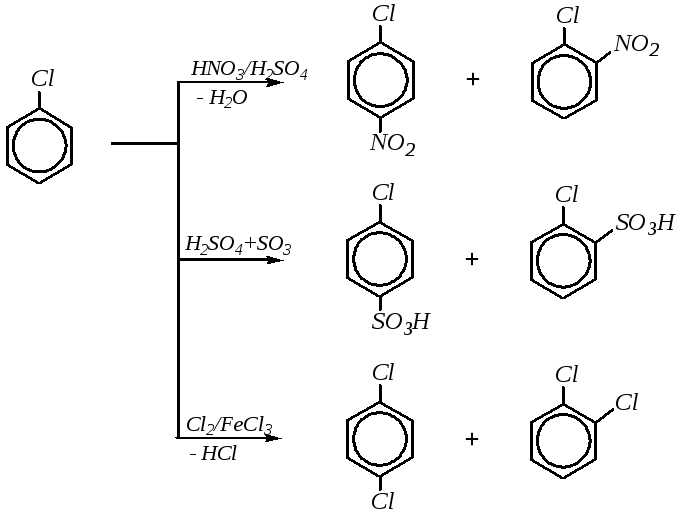
При этом преимущественное направление реакции (в о- или п-положение) и относительные количества орто- и пара-изомеров определяются различными факторами (гл. 10.1.2).
10.2.4.2. Нуклеофильное замещение в ароматическом кольце арилгалогенидов
Реакционная способность по отношению к нуклеофилам у арилгалогенидов низкая. Для замещения их галогена требуются жёсткие условия, активные реагенты либо наличие активирующих функциональных групп, особенно в орто- ипара-положениях относительно галогена. Как правило, взаимодействие протекает при температурах выше 450К. Это является следствием того, что атом галогена в этих соединениях менее подвижен, чем в алкилгалогенидах (см.строение арилгалогенидов, гл. 10.2.2). Наиболее типичные случаи замещения атома галогена в бензольном кольце приведены на схеме:
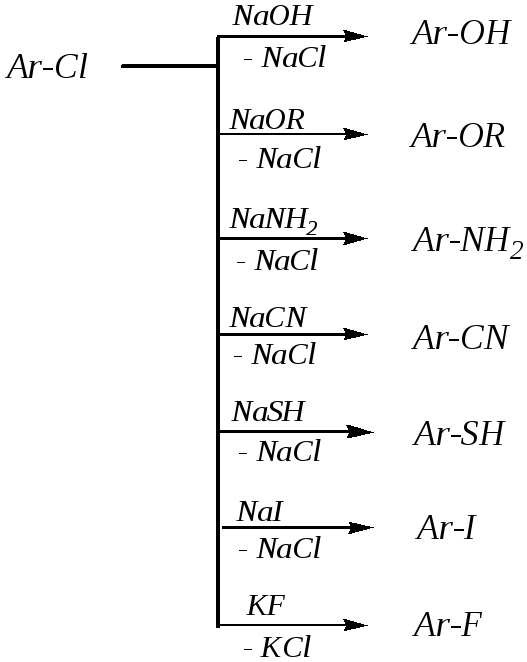
Эти реакции могут быть использованы для получения различных функциональных производных аренов.
Если в молекуле галогенобензола нет других заместителей или содержится алкильный заместитель, то такие соединения называют неактивированными. Нуклеофильное замещение в молекулах таких арилгалогенидов возможно, например, при взаимодействии хлорбензола с 40%-м водным растворомNaОH при температуре 600—650Ки давлении 30МПа, а также при взаимодействии того же хлорбензола (а также бромбензола, йодбензола) с амидами щелочных металлов (NaNH2,KNH2) в жидком аммиаке.
Неактивированные субстраты вступают в реакции нуклеофильного замещения по ариновому механизму (механизм отщепления-присоединения). На первой, медленной, стадии происходит отщепление частиц Н+ иСl¯; затем на второй стадии — быстрое присоединение нуклеофильного реагента:
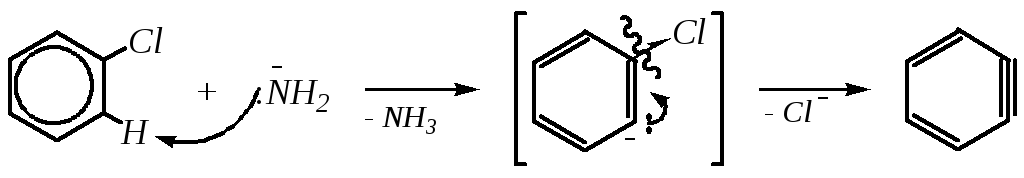
дегидробензол

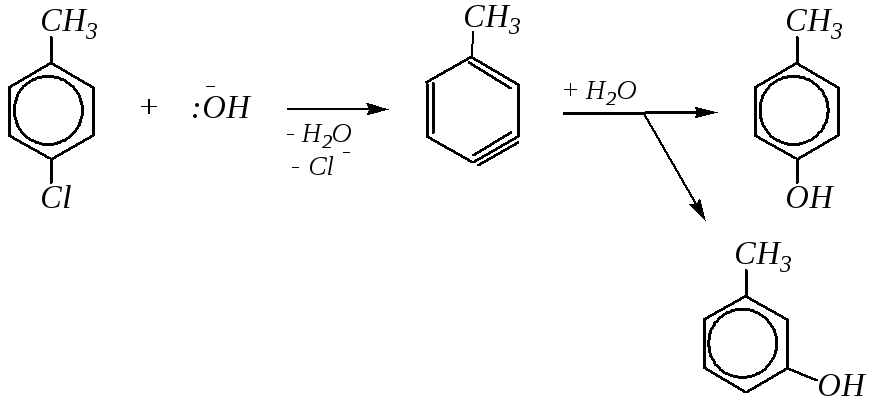
В общем случае при использовании галогенаренов возможно образование двух изомерных продуктов примерно в равных количествах. Например, из п-хлортолуола в результате замещения хлора гидроксид-ионом образуются м- и п-крезолы:
|
|
п-крезол
м-крезол |
Если в бензольном кольце исходной молекулы галогенарена имеются дополнительные заместители, то они могут сильно влиять на подвижность атома галогена. Присутствие сильных электронодонорных заместителей (-ОН, -NН2 и др.) делает эту реакцию неосуществимой из-за высокой электронной плотности на бензольном кольце и невозможности подхода нуклеофила. Напротив, сильные электроноакцепторные заместители в бензольном кольце (-NO2, -CN и др.) будут активировать молекулу арилгалогенида в реакции нуклеофильного замещения. Такие соединения (с дополнительными акцепторными группами) называютактивированнымидля нуклеофильной атаки.
Арилгалогениды с сильными электроноакцепторными заместителями могут вступать во взаимодействие с нуклеофилами по механизму бимолекулярного нуклеофильного замещения (механизм присоединения-отщепления). Для того чтобы наблюдался такой механизм, достаточно в структуре арилгалогенида хотя бы одного сильного электроноакцепторного заместителя в орто- или пара-положении к замещаемой группе, так как именно в этих положениях заместители, обладающие –М-эффектом, понижают электронную плотность. При этом увеличивается положительный заряд на атоме углерода, связанном с галогеном, и становится возможной нуклеофильная атака по нему. Первая стадия протекания реакции (медленная и обратимая) — присоединение нуклеофильной частицы к молекуле субстрата за счёт образования новой -связи, а вторая стадия — отрыв галогенид-иона (быстрая и необратимая):

-комплекс
Примером протекания реакции по механизму SN2аром является щелочной гидролиз п-нитрохлорбензола:
 ,
,
который протекает в водном растворе при температуре 420 К и давлении 0.6 МПа. Для орто-изомера аналогичная реакция протекает в более мягких условиях (400 К и 0.3 МПа) из-за сильного –I-эффекта нитрогруппы, который сказывается главным образом на ближайших атомах (т.е. в орто-положении). Так получают о-нитроанизол при нагревании в автоклаве при 380 К о-нитрохлорбензола с 80—90%-м метиловым спиртом и щёлочью в течение 4—5 часов:

о-нитроанизол
о-Нитроанизол служит для получения о-анизидина, а последний используется для синтеза гваякола и лекарственных препаратов на его основе.
В отличие от орто- и пара-нитрохлорбензолов для м-изомера щелочной гидролиз протекает в значительно более жёстких условиях — это соединение реагирует, по-видимому, по ариновому механизму.
Реакционная способность арилгалогенидов определяется величиной частичного положительного заряда на атоме углерода, связанном с галогеном. Поэтому наиболее легко будет замещаться атом фтора за счёт большого индуктивного эффекта этого атома во фторбензолах, а труднее всего — атом йода. Наличие нескольких электроноакцепторных заместителей в орто- и пара-положениях также будет существенно увеличивать реакционную способность арилгалогенидов. Однако скорость реакции определяется не только строением субстрата, но и нуклеофильностью реагента, поэтому, например, взаимодействие с амидами осуществляется легче, чем с гидроксидами, и в ряде случаев реакцию проводят с аммиаком или аминами. Так, например, действием аммиака на амид п-хлорбензолсульфокислоты можно получить важный лекарственный препарат белый стрептоцид:

п-аминобензолсульфамид
(белый стрептоцид)
С другой стороны, замещение хлора в полихлорбензолах будет протекать, по-видимому, по ариновому механизму из-за слабого акцепторного влияния атомов хлора в бензольном кольце. При действии на такие соединения спиртовой щёлочи можно заместить лишь один атом хлора. Таким образом могут быть получены п-хлорфенол

п-хлорфенол
и пентахлорфенол (являющийся антисептиком)
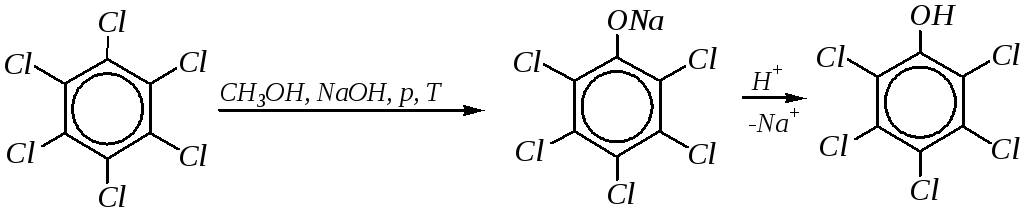
пентахлорфенол
10.2.4.3. Взаимодействие с металлами
При участии щелочных металлов арилгалогениды вступают в реакцию Вюрца–Фиттига, которая приводит к получению ароматических углеводородов (гл. 9.6).
Магний реагирует с арилгалогенидами в условиях, обычных для образования магнийорганических соединений – в среде диэтилового эфира:
Ar-Br + Mg Ar- MgBr
Образующиеся в этой реакции магнийорганические соединения относятся к реактивам Гриньяра и могут использоваться в различных органических синтезах (гл. 6.1.4.1, п.6), в частности для введения ароматического радикала (т.е. для арилирования).
10.2.4.4. Реакции галогенаренов с атомом галогена в боковой цепи
Н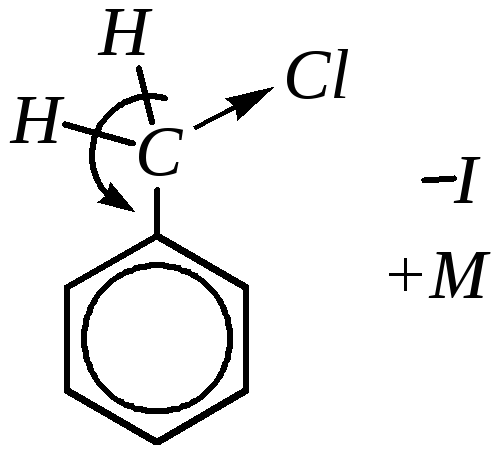 а
реакции электрофильного замещения в
ароматическом кольце атом галогена,
находящийся в боковой алкильной цепи,
будет влиять только за счёт своего
индуктивного эффекта. При этом наиболее
сильное влияние оказывает атом (или
атомы) галогена в-положении
боковой цепи. Так, в-хлорметилтолуоле
за счёт этого будут затруднены
электрофильные реакции в кольцо, однако
ориентация электрофильного замещения
будет такая же, как и в толуоле, — ворто-ипара-положения. При наличии у-углеродного атома
нескольких атомов галогена значительно
увеличивается суммарный акцепторный
эффект и меняется ориентация замещения.
Т
а
реакции электрофильного замещения в
ароматическом кольце атом галогена,
находящийся в боковой алкильной цепи,
будет влиять только за счёт своего
индуктивного эффекта. При этом наиболее
сильное влияние оказывает атом (или
атомы) галогена в-положении
боковой цепи. Так, в-хлорметилтолуоле
за счёт этого будут затруднены
электрофильные реакции в кольцо, однако
ориентация электрофильного замещения
будет такая же, как и в толуоле, — ворто-ипара-положения. При наличии у-углеродного атома
нескольких атомов галогена значительно
увеличивается суммарный акцепторный
эффект и меняется ориентация замещения.
Т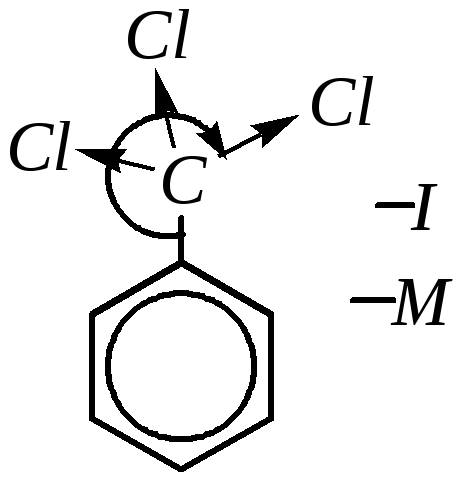 ак,
например, группировка -CCl3сильно дезактивирует кольцо и ориентирует
вступающий электрофил исключительно
вмета-положение за счёт обратной
гиперконъюгации. А такой заместитель,
как -CНCl2,
будет ориентировать во все положения
кольца, но преимущественно вм-положение.
ак,
например, группировка -CCl3сильно дезактивирует кольцо и ориентирует
вступающий электрофил исключительно
вмета-положение за счёт обратной
гиперконъюгации. А такой заместитель,
как -CНCl2,
будет ориентировать во все положения
кольца, но преимущественно вм-положение.
Наличие атома галогена у -углеродного атома и далее (-, -) в углеродной цепи мало сказывается на скорости и направлении электрофильного замещения. Такие соединения ведут себя аналогично аренам. Акцепторное влияние атома галогена на скорость замещения будет уменьшаться по мере его удаления от бензольного кольца.
Нуклеофильное замещение атома галогена в боковой цепи в значительной мере зависит от природы атома углерода, связанного с галогеном. -Галогенозамещённые аренов отличаются высокой активностью в реакциях нуклеофильного замещения по механизму SN1:
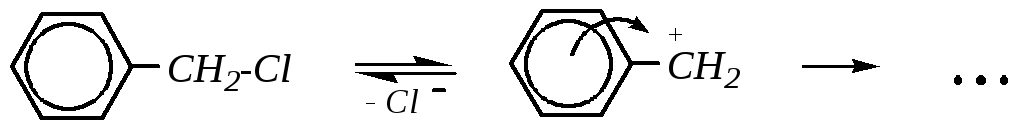
Такая лёгкость протекания реакции связана с образованием устойчивого катиона бензильного типа, в котором положительный заряд делокализован с участием -электронной системы кольца (за счёт р--сопряжения):
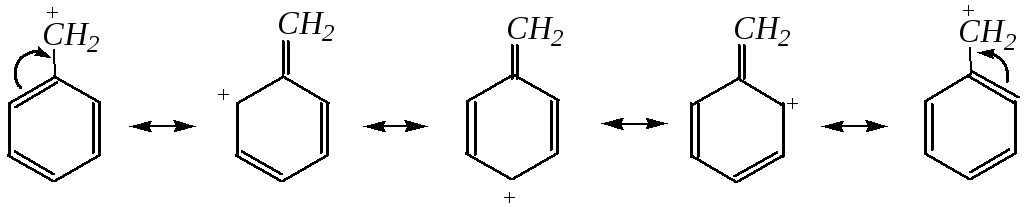
Реакционная способность соединений, в которых атом галогена находится у -углеродного атома и далее (-, -) в углеродной цепи, по отношению к нуклеофилам близка реакционной способности соответствующих галогеналканов. Скорость и механизм замещения определяются в соответствии с факторами, рассмотренными для нуклеофильного замещения в галогеналканах (гл. 3.1.1).