
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.6.3. Физические и химические свойства ароматических аминов
Ароматические амины — бесцветные жидкости или кристаллические вещества со специфическим запахом, темнеющие на воздухе. Низшие амины плохо растворимы в воде, высшие — в воде нерастворимы. Плотности большинства соединений близки к 1 г/мл.
Химические свойства ароматических аминов определяются наличием аминогруппы и бензольного кольца, причём высокая эффективность взаимодействия этих структурных составляющих приводит к значительному изменению активности аминов в реакциях как с участием аминогруппы, так и ароматического кольца.
10.6.3.1. Электрофильное замещение
Как и многие ароматические соединения, ароматические амины могут вступать в реакции электрофильного замещения (SE) по бензольному кольцу. Аминогруппа является одним из самых сильных электронодоноров в ароматическом кольце за счёт большого+М-эффекта. В результате электронная плотность на кольце повышена, и это повышение наблюдается, главным образом, во-ип-положениях. Таким образом, реакции ароматических аминов с электрофильными реагентами протекают значительно легче, чем для бензола и аренов. Механизм взаимодействия анилина с электрофильной частицей можно представить следующим образом:
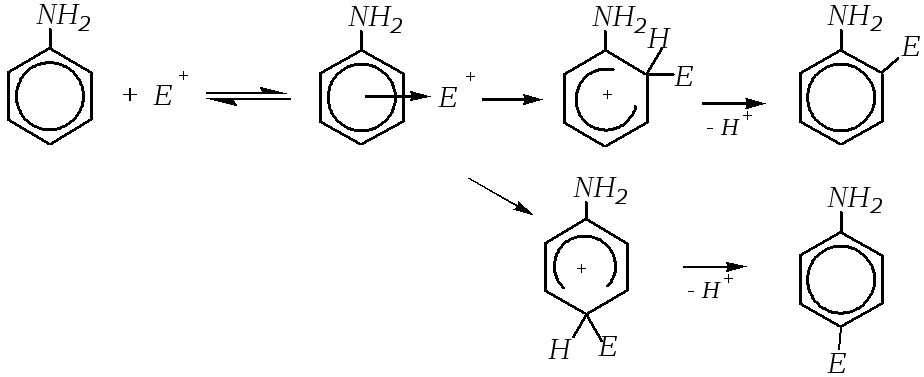
Вступление электрофила в о- и п-положения бензольного кольца может быть объяснено также динамическим подходом.
Однако помимо высокой реакционной способности ароматических аминов по отношению к электрофилам замещение в бензольном кольце аминов имеет ряд существенных особенностей. Эти особенности связаны прежде всего с тем, что большинство электрофильных реакций протекает в кислой среде.
Галогенирование протекает легко. При этом наиболее гладко протекает бромирование. Так, обработка анилина бромной водой сразу приводит к образованию 2,4,6-триброманилина:
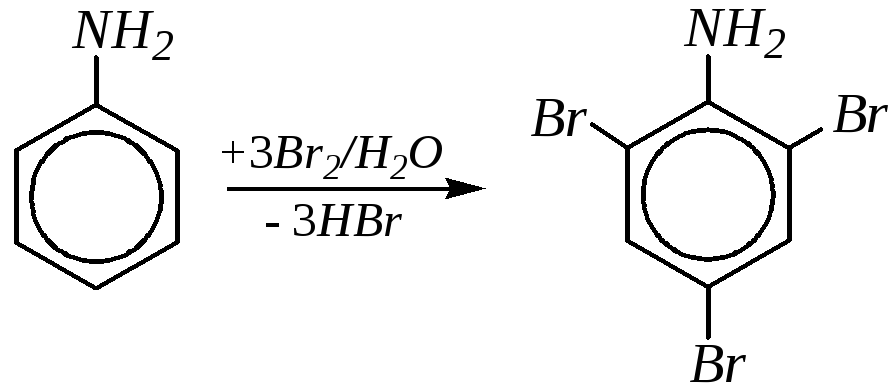
Электрофильной частицей здесь является бромоний-катион Br+, который образуется при диспропорционировании молекулы брома в водной среде. Для получения монобромпроизводных ароматические амины предварительно ацилируют и затем бромированию подвергаютN-ацильное производное:
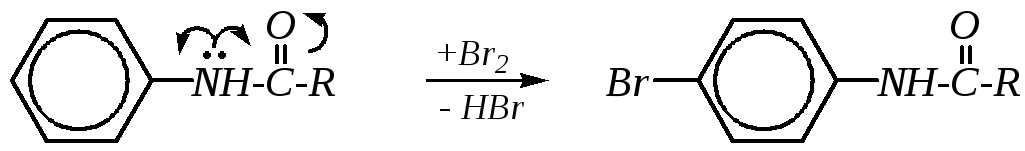
Ацильная группа за счёт сопряжения уменьшает электронодонорную активность аминогруппы, и реакционная способность ароматического кольца уменьшается. После проведения бромирования ацильную защиту снимают, проводя гидролиз в кислой среде.
Хлорирование в водной среде сопровождается образованием продуктов окисления, например образованием хлоранила — см. гл. 10.5.7.
Нитрование ароматических аминов в бензольное кольцо можно проводить нитрующей смесью с образованиемм-нитроанилина в качестве основного продукта, так как в кислой среде амины превращаются в соли замещённого аммония, а аммонийная группа в кольце является сильным акцептором. Поэтому для проведения нитрования требуются жёсткие условия, и преимущественная ориентация замещения — вмета-положение:

Такое направление замещения в катионе замещённого аммония объясняется динамическим подходом. Для этого требуется сравнить устойчивость -комплексов. Несмотря на то, что число граничных структур-комплексов при вступлении электрофила ворто-,мета- ипара-положения одинаково,-комплексы с электрофильной частицей ворто- ипара-положениях по отношению к аммонийной группе менее устойчивы, так как одна из трёх граничных структур в этих случаях сильно дестабилизирована за счёт локализации положительного заряда на атоме углерода, связанном с аммонийным атомом азота. Эти граничные структуры изображены последними в соответствующих рядах.
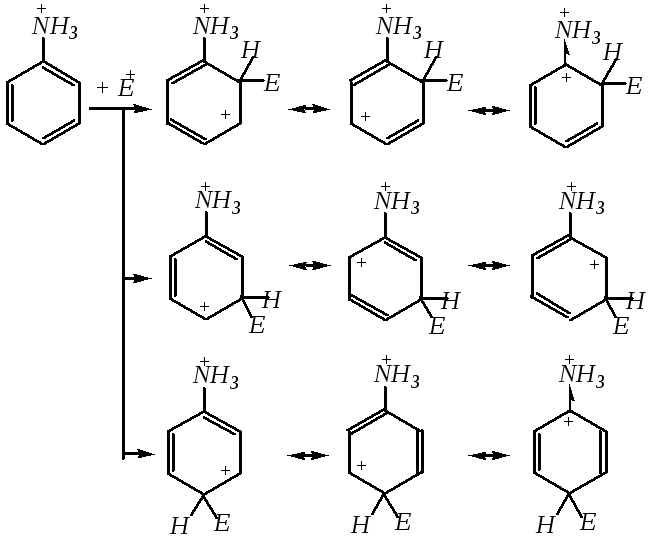
Нитрование ароматических аминов нельзя проводить концентрированной азотной кислотой, так как это требует нагревания, а при повышенных температурах усиливаются окислительные свойства азотной кислоты. Поэтому при применении концентрированной азотной кислоты происходит не нитрование, а окисление амина. Использование других нитрующих агентов, например тетрафторобората нитрония [NO2]+BF4¯при низких температурах, может привести к продуктам нитрования по атому азота (N-нитроариламинам).
Для получения продуктов нитрования в орто- ипара-положения ароматического кольца необходимо предварительно ввестиацильную защиту, которая заключается в предварительном ацилировании аминогруппы (см. также гл. 10.6.3.3). Продукты ацилирования,N-ацилариламины, не обладают оснóвными свойствами, и поэтому в кислой среде электронодонорная активность атома азота сохраняется, хотя величина +М-эффекта будет значительно меньше, чем у исходного амина, так как ацильная группа также вступает в сопряжение с аминогруппой. В связи с этим уменьшается реакционная способность ароматического кольца.

При нитровании нитрующей смесью N-ацилариламинов получается смесьо- ип-изомеров. После проведения нитрования ацильную защиту снимают.
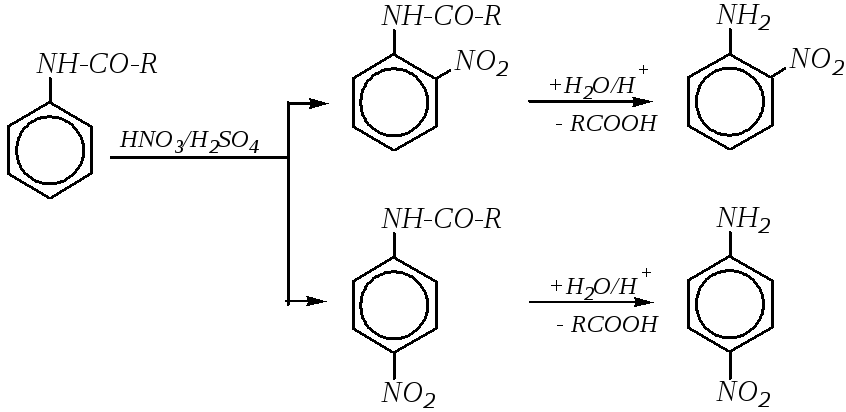
Сульфирование. Взаимодействие анилина с концентрированной серной кислотой при нагревании до 450—460Кприводит к образованию сульфаниловой кислоты (метод «запекания»):
Образование исключительно п-изомера объясняется уменьшением электронодонорной активности аминогруппы в промежуточнойN-сульфокислоте (аналогично применению ацильной защиты при бромировании и нитровании) и большим пространственным эффектом заместителя в этом соединении.
Взаимодействие со слабыми электрофилами. Повышение активности бензольного кольца ароматических аминов делает возможным взаимодействие с такими слабыми электрофилами, как альдегиды, соли диазония и некоторыми другими. Реакция с формальдегидом может рассматриваться как типичная реакцияSEпо отношению к амину или как реакцияAdNпо отношению к альдегиду:

Образующийся продукт присоединения, являющийся ароматическим спиртом, также может проявлять электрофильные свойства и вступать во взаимодействие со следующей молекулой амина. По отношению к ароматическому спирту это уже будет нуклеофильное замещение (механизм реакции, скорее всего, SN1):
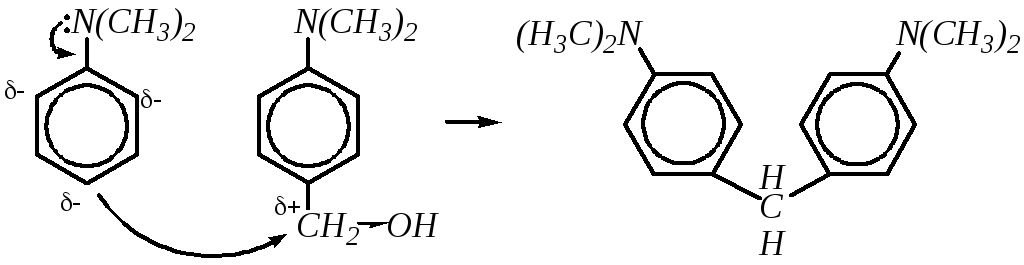
п,п-бис-(диметиламино)-дифенилметан
Взаимодействие ароматических аминов с солями диазония будет рассмотрено далее, в свойствах диазосоединений.
10.6.3.2. Кислотно-оснόвные свойства
Для аминов в целом (и ароматических, и алифатических) характерны слабые кислотные свойства. Это NH-кислоты, и поэтому отщепление катиона водорода происходит труднее, чем в случае OH-кислот, из-за меньшей электроотрицательности атома азота по сравнению с кислородом.
В
молекулах ароматических аминов по
причине р--сопряжения
и сильного смещения электронной плотности
с атома азота на бензольное к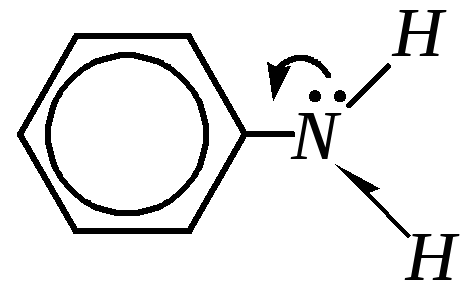 ольцоN–H-связь
более полярна, чем в алифатических
аминах. Поэтому кислотность ароматических
аминов несколько выше, однако она
остаётся достаточно низкой, и кислотные
свойства проявляются только по отношению
к таким реагентам, как активные металлы,
металлорганические соединения или же
металлические производные аммиака и
алифатических аминов. Например:
ольцоN–H-связь
более полярна, чем в алифатических
аминах. Поэтому кислотность ароматических
аминов несколько выше, однако она
остаётся достаточно низкой, и кислотные
свойства проявляются только по отношению
к таким реагентам, как активные металлы,
металлорганические соединения или же
металлические производные аммиака и
алифатических аминов. Например:
![]()
![]()
Бóльшую кислотность ароматических аминов по сравнению с алифатическими можно объяснить также устойчивостью образующегося аниона, в котором отрицательный заряд делокализован с участием -электронной системы бензольного кольца:

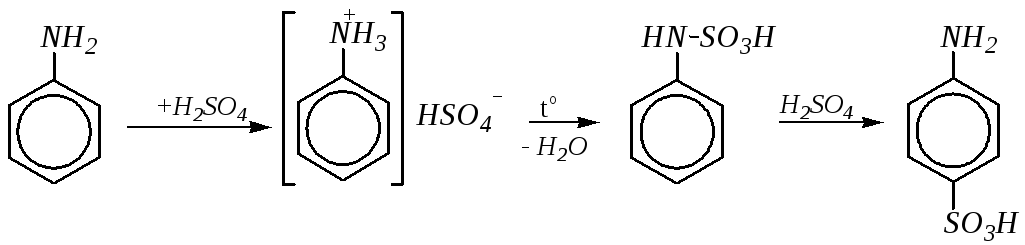
Оснóвные свойства у ароматических аминов, наоборот, слабее выражены, чем у алифатических аналогов. Причина этого та же, что и в случае кислотных свойств: участие неподелённой электронной пары атома азота в сопряжении с -электронной системой бензольного кольца и, как следствие, пониженная электронная плотность на атоме азота по сравнению с аммиаком и алифатическими аминами. Так, значение константы основности для метиламина CH3NH2 примерно в 107 раз выше константы основности анилина: рКb метиламина равно 2.3, анилина — 9.4 (для сравнения: рКb аммиака равно 4.8).
Таким образом, ароматические амины дают соли только с сильными кислотами, например:
Ar-NH2
+ H2SO4
![]() [Ar-NH3]+
HSO4¯
[Ar-NH3]+
HSO4¯
Однако такие соли, являющиеся солями сильных кислот и слабых оснований, легко гидролизуются.
Введение заместителей в ароматическое кольцо влияет на оснóвные свойства ароматических аминов. Электроноакцепторные заместители за счёт более полной делокализации неподелённой электронной пары атома азота ещё сильнее уменьшают оснóвные свойства, а электронодонорные заместители, наоборот, повышают основность ароматических аминов, так как в этом случае их электронный эффект препятствует делокализации неподелённой пары электронов азота. Особенно сильно такое влияние проявляется в о- и п-положениях бензольного кольца.
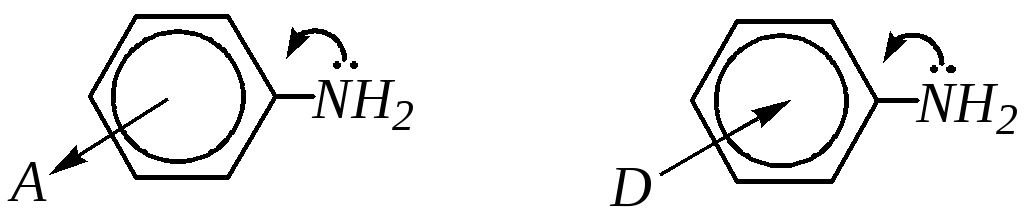
10.6.3.3. Нуклеофильные свойства
Ароматические амины могут проявлять нуклеофильные свойства за счёт атома азота. Однако по сравнению с алифатическими аминами в данном случае нуклеофильность будет понижена вследствие сопряжения, так же как и понижены оснóвные свойства. Тем не менее аналогично алифатическим аминам (гл. 3.7.3) анилин и его производные вступают в реакции алкилирования, ацилирования, взаимодействия с азотистой кислотой, в изонитрильную реакцию, а также в реакции арилирования и образования оснований Шиффа*.
Алкилирование. В данной реакции субстратами могут являться галогеналканы, диалкилсульфаты,п-толуолсульфонаты, реже — спирты. Во всех случаях это типичная реакция нуклеофильного замещения у насыщенного атома углерода, механизм которой приведён в главе 3.1.1. Различия наблюдаются только в природе уходящей группы. Например, для метилирования можно использовать метилйодид, диметилсульфат или метил-п-толуолсульфонат в щелочной среде, как показано в этих некоторых схемах:

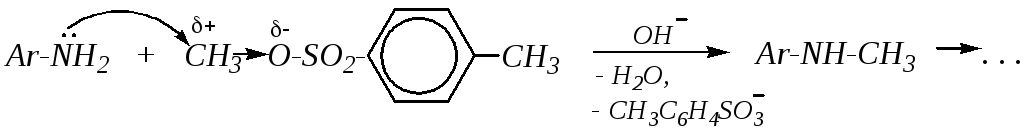
Алкилирование обычно идёт дальше с образованием смеси вторичных, третичных аминов и солей четвертичного аммония.
В случаях алкилирования спиртами реакцию проводят в газовой фазе в присутствии кислот. При этом обычно получаются третичные амины:
![]()
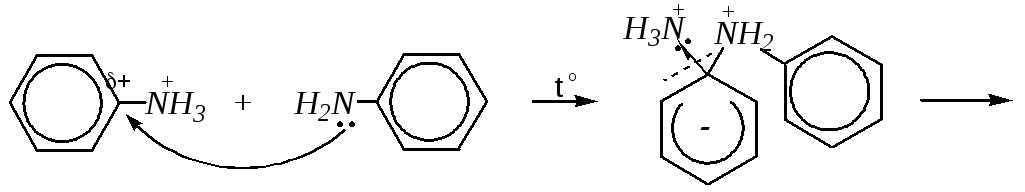
Арилирование. Эти реакции должны протекать в более жёстких условиях, чем реакции алкилирования, так как предполагается замещение галогена в ароматическом кольце, а это означает протекание реакции по ариновому механизму (или механизму SN2аром, если субстрат активирован). Однако достаточно легко реакции могут протекать в тех случаях, когда в ароматическом кольце амина имеются электронодонорные заместители (в орто- и пара-положениях), повышающие его нуклеофильность, а в молекуле арилгалогенида (также в орто- и пара-положениях) — электроноакцепторные группы. Например:


При нагревании до 500 К анилина с его солянокислой солью получают дифениламин. Эта реакция становится возможной за счёт наличия в субстрате очень сильного электроноакцептора аммонийной группы:

Ацилирование. Реакции ацилирования ароматических аминов — это реакции взаимодействия этих соединений с карбоновыми кислотами и их производными, являющимися ацильными агентами. Такие реакции производных карбоновых кислот рассматривались в главе 6.4.4.2. В данном случае ацилирование проводят ангидридами, хлорангидридами кислот и самими карбоновыми кислотами, продуктами при этом являются N-ариламиды:
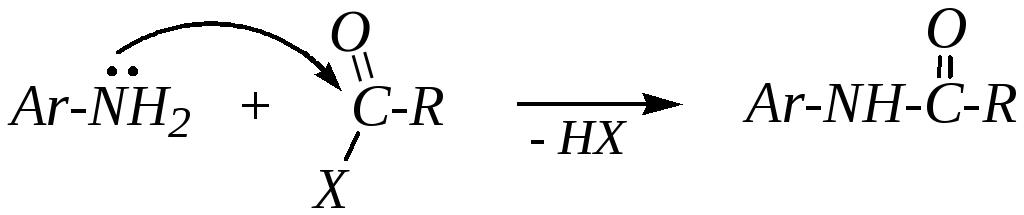
В целом ацилирование ариламинов протекает медленнее, чем ацилирование алифатических аминов.
Взаимодействие аминов с хлорангидридами аренсульфокислот — реакции, аналогичные ацилированию. Действие арилсульфохлоридов на первичные, вторичные и третичные амины приводит к разным продуктам. Так, первичные и вторичные амины легко образуют сульфамиды, третичные — в реакцию не вступают:
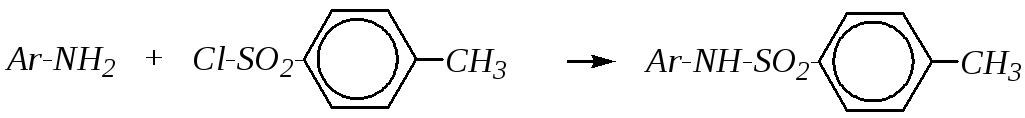

При этом аренсульфамид, полученный из первичного амина, обладает ярко выраженной NH-кислотностью и потому растворяется в водных растворах щелочей:

А сульфамид, образованный из вторичного амина и не содержащий атомов водорода в амидной группе, в щелочах не растворяется. Такое различное отношение первичных, вторичных и третичных ароматических аминов к аренсульфохлоридам лежит в основе разделения смеси аминов.
Образование оснований Шиффа. Первичные ароматические амины при взаимодействии с ароматическими альдегидами образуют основания Шиффа (называемые также анилами, или шиффовыми основаниями):
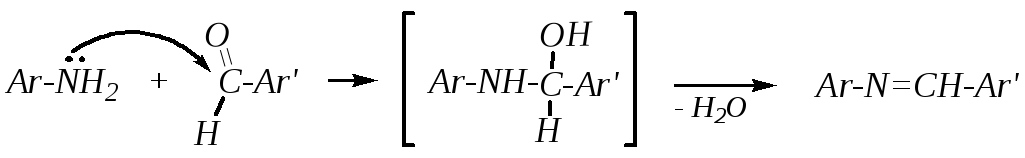
Механизм реакции нуклеофильного присоединения аминов к карбонильным соединениям рассмотрен в главе 6.1.4.1. Образующиеся в общем случае при таком присоединении азометины малоустойчивы и могут гидролизоваться с образованием исходных веществ, в данном случае шиффовы основания стабилизированы сопряжением -электронных систем двух ароматических колец и -связи между этими кольцами (---сопряжение). Поэтому такие соединения устойчивы к щелочам, но могут гидролизоваться в кислой среде.
В биохимических процессах образование оснований Шиффа играет существенную роль. Например, через их образование осуществляется биосинтез аминокислоты триптофана, осуществляется связывание ретиналя с белком опсином — механизм зрения, а также и другие процессы.
Взаимодействие с азотистой кислотой. Как и для алифатических аминов, взаимодействие ариламинов с азотистой кислотой приводит к разным продуктам для первичных, вторичных и третичных аминов, поэтому данную реакцию можно использовать для различия этих аминов. Механизм нитрозирования аминов с участием азотистой кислоты подробно рассмотрен в главах 3.7.3.5 и 10.7.2. При этом из первичных аминов образуются соли арендиазония:
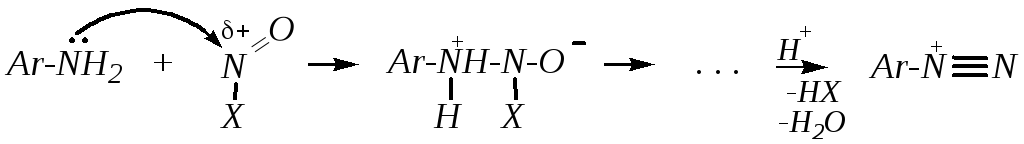 ,
,
из вторичных аминов — N-нитрозоамины:
 ,
,
а из третичных аминов — п-нитрозосоединения:
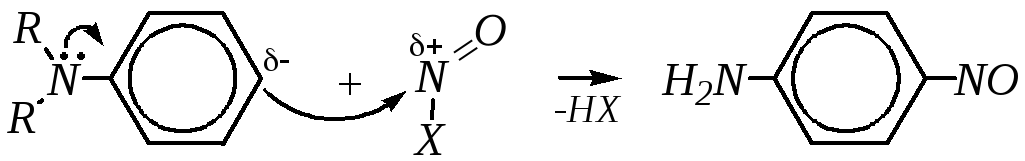 .
.
Однако реакция нитрозирования третичных аминов — это проявление нуклеофильных свойств за счёт ароматического кольца, и по отношению к амину данная реакция является электрофильным замещением атома водорода в ароматическом кольце.
Изонитрильная реакция. Как и алифатические амины, первичные ароматические амины дают изонитрильную реакцию (гл. 3.7.3.6), заключающуюся во взаимодействии аминов с хлороформом в присутствии щёлочи:

Протекание реакции сопровождается неприятным запахом образующегося карбиламина (арилизоцианида), поэтому первичные амины могут быть обнаружены с помощью этой реакции.
10.6.3.4. Окисление
При взаимодействии ариламинов с сильными окислителями (например, NaOCl, CrO3) происходит отрыв электрона и образование катион-радикалов, которые далее превращаются в красители:
![]()
Аминогруппу также можно окислить до нитрозогруппы, применяя пероксисерную кислоту (кислоту Каро) H2SO5, и до нитрогруппы — трифторпероксиуксусной кислотой CF3COOOH, азотной кислотой или перманганатом калия:
![]()
Данную реакцию можно использовать как способ получения нитрозо- или нитросоединений соответственно.
