- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.9.2. Строение бензойной кислоты
К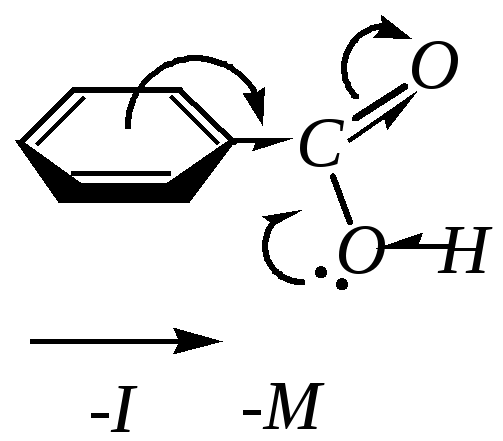 арбоксильная
группа в молекуле бензойной кислоты
оказывает по отношению к ароматическому
кольцу электроноакцепторные индуктивный
и мезомерный эффекты (аналогия со
строением бензальдегида — гл. 10.8.2).
Электронная плотность на кольце понижена,
особенно во-
и п-положениях.
В сопряжение вовлекается и атом кислорода
OH-группы,
в связи с чем вся молекула имеет плоское
строение.
арбоксильная
группа в молекуле бензойной кислоты
оказывает по отношению к ароматическому
кольцу электроноакцепторные индуктивный
и мезомерный эффекты (аналогия со
строением бензальдегида — гл. 10.8.2).
Электронная плотность на кольце понижена,
особенно во-
и п-положениях.
В сопряжение вовлекается и атом кислорода
OH-группы,
в связи с чем вся молекула имеет плоское
строение.
10.9.3. Физические и химические свойства
Ароматические карбоновые кислоты представляют собой белые кристаллические вещества, некоторые из них обладают приятным запахом.
Важнейшими свойствами самих карбоновых кислот (ароматических так же, как и алифатических) и в ряде случаев таких их производных, как амиды, являются их кислотно-основные свойства. При этом оснóвные свойства незначительны и практического значения не имеют.
Так же, как и для алифатических аналогов, для ароматических кислот и их производных характерны реакции в ацильной группе, приводящие к получению одних производных из других.
Ещё одним важным свойством этих соединений являются реакции по бензольному кольцу, что характерно для всех ароматических производных.
10.9.3.1. Кислотные свойства
Кислотные свойства алифатических карбоновых кислот рассматривались ранее (гл. 6.4.4.1). Для ароматических карбоновых кислот кислотность связана также с возможностью отрыва катиона водорода от карбоксильной группы. При этом аренмонокарбоновые кислоты относятся к слабым OH-кислотам. Бензойная кислота лишь ненамного сильнее уксусной (рКа для бензойной равна 4.17 против 4.76 для уксусной). Лучше всего это можно объяснить возможностью более полной делокализации отрицательного заряда аниона кислотного остатка с участием -электронной системы бензольного кольца.
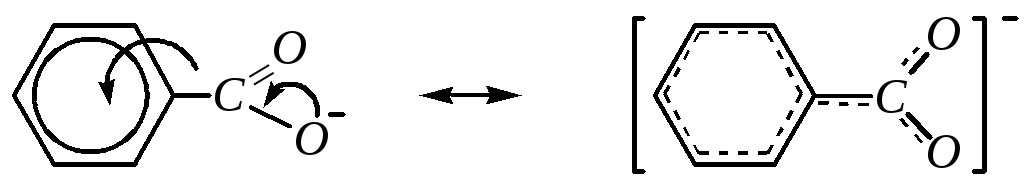
Поэтому так же, как и в случаях с аренсульфокислотами (гл. 10.3.3.4) и фенолами (гл. 10.5.3.1), электроноакцепторные заместители будут увеличивать кислотные свойства, а электронодонорные, наоборот, — уменьшать.

Однако для некоторых заместителей, находящихся в орто-положении бензольного кольца по отношению к карбоксильной группе, влияние на кислотные свойства аренкарбоновых кислот не ограничивается индуктивным и мезомерным эффектами (и пространственным эффектом тоже). Это так называемый орто-эффект, проявляющийся во взаимодействии карбоксильной и находящейся к ней в о-положении р-донорной группы за счёт внутримолекулярных водородных связей. Примером проявления орто-эффекта является взаимодействие функциональных групп в молекуле салициловой кислоты, увеличивающее её кислотность по сравнению с бензойной (рКа = 3.00) за счёт увеличения полярности О–Н-связи в карбоксильной группе и стабилизации образующегося аниона:

салициловая кислота
Это характерно также для антраниловой (о-аминобензойной) кислоты, для фталевой (о-бензолдикарбоновой кислоты) и аналогичных по структуре о-замещённых бензойных кислот.
В целом арендикарбоновые и аренполикарбоновые кислоты являются более сильными, чем монокарбоновые (сказывается акцепторное влияние второй карбоксильной группы).
Значимыми кислотными свойствами обладают также амиды и имиды некоторых кислот. Например, фталимид является типичной (хотя и слабой) NH-кислотой (рКа = 8.3):
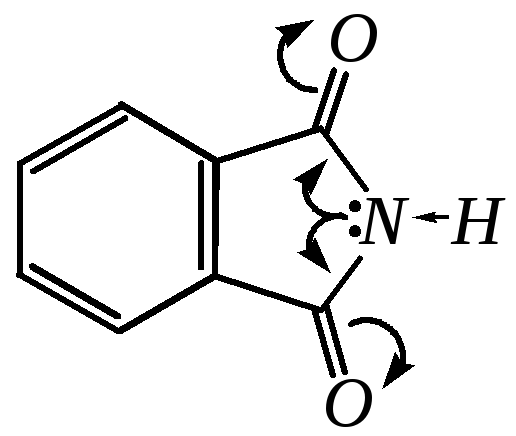
Он растворяется в водных щелочах (солеобразование с последующим гидролизом). Поэтому для получения стабильных солей их синтезируют в безводной среде.
Соли фталимида (например, фталимид калия) нашли применение в получении чистых первичных аминов (синтез Габриэля*):
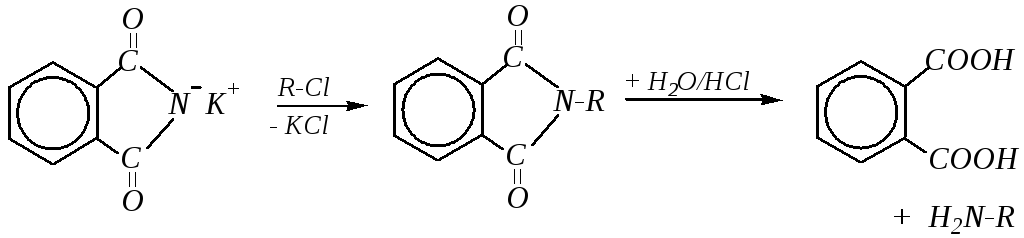
Первая стадия здесь — взаимодействие галогеналкана с фталимидом калия, являющимся нуклеофилом, — типичная реакция SN в ряду галогеналканов. За ней следует гидролиз образовавшегося N-алкилфталимида, который обычно проводят в солянокислой среде.
10.9.3.2. Реакции в ацильной группе
Ранее на примере алифатических аналогов (гл. 6.4.4.2) рассматривались реакции нуклеофильного замещения в карбоксильной группе карбоновых кислот и в ацильных группах производных этих кислот. При этом из одних ацильных производных образуются другие ацильные производные.
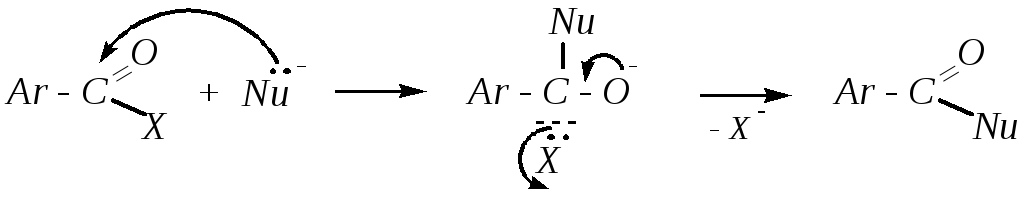
Возможен и кислотный катализ.
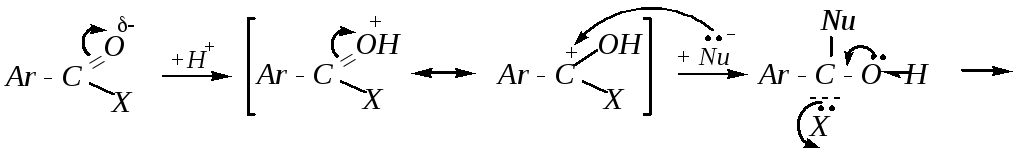

Скорость реакции зависит от пространственных факторов, величины заряда на карбонильном атоме углерода и природы уходящей группы (её основности). Таким образом, реакционная способность ароматических карбоновых кислот и их производных уменьшается в том же ряду, что и их алифатических аналогов:
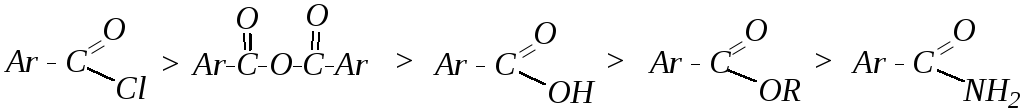
Для аренкарбоновых кислот характерны также реакции декарбоксилирования, начинающиеся с нуклеофильной атаки по карбонильному атому углерода (гл. 6.4.4.4).
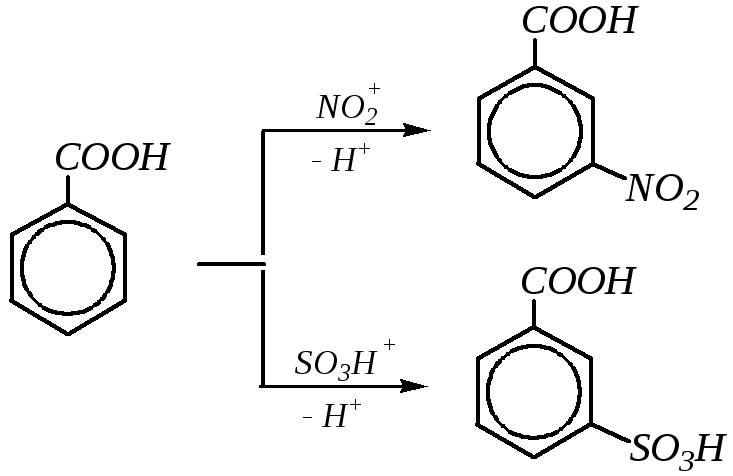
10.9.3.3. Электрофильное замещение
Как следует из строения бензойной кислоты, карбоксильная группа оказывает электроноакцепторное влияние на бензольное кольцо, в связи с чем уменьшает электронную плотность на кольце и направляет вступающий электрофил преимущественно в мета-положение. Это можно показать граничными формулами распределения электронной плотности в исходной молекуле бензойной кислоты:
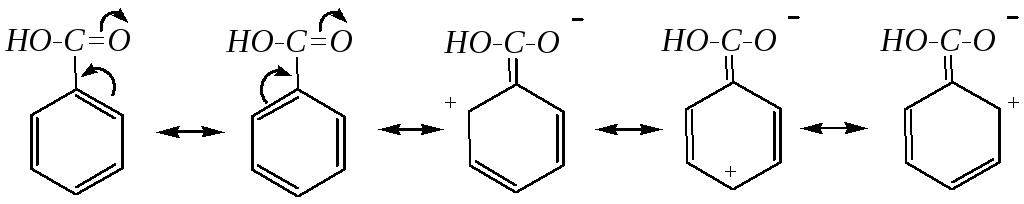
Из SE-реакций для аренкарбоновых кислот (и их ацильных производных) характерны реакции нитрования, сульфирования и галогенирования. Например: