- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.7.3. Амфотерность диазосоединений
Соли арендиазония образуются и существуют в кислой среде. При постепенном добавлении щёлочи происходит превращение одних диазосоединений в другие:
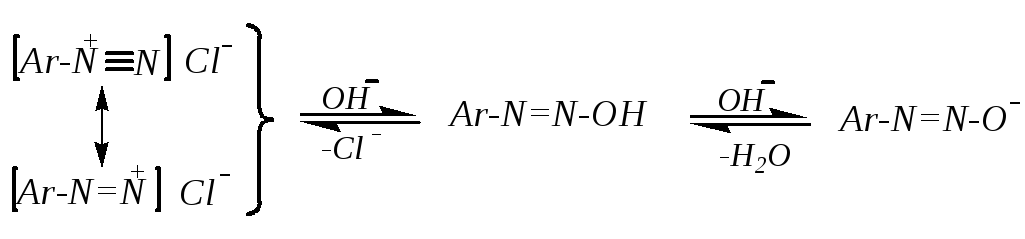
При этом наблюдается образование ковалентной связи N–O, поэтому в отличие от соли диазония все связи в арендиазогидроксиде ковалентные. При дальнейшем отщеплении протона образуется вновь ионное соединение — диазотат металла. Превращение солей диазония в диазотаты обратимо, и в кислой среде происходит обратный процесс:
![]()
Диазотат-ионы существуют в виде двух геометрических изомеров:

Z-диазотат Е-диазотат
В разбавленной щёлочи может образоваться как один, так и другой стереоизомер, а в концентрированном растворе щёлочи образуется исключительно более устойчивый Е-изомер. Е-Диазотаты металлов могут быть выделены в твёрдом виде и используются как устойчивая форма диазосоединений.
10.7.4. Реакции солей арендиазония
По причине своей малой устойчивости соли арендиазония сразу же в растворе используются для синтезов. Это очень реакционноспособные соединения. Пути превращения этих соединений весьма разнообразны.
10.7.4.1. Реакции с выделением азота
Можно выделить несколько типов реакций в зависимости от используемых реагентов и условий, в которых эти реакции проводятся.
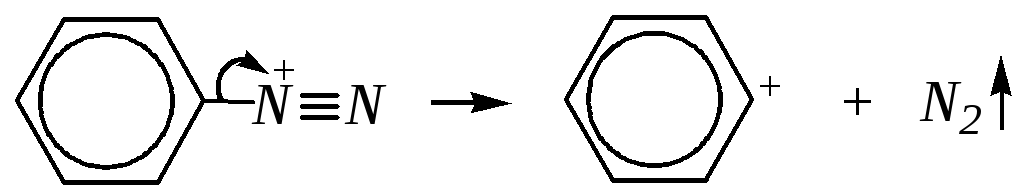
Нуклеофильное замещение диазогруппы осуществляется только жёсткими нуклеофилами (F¯, Cl¯, OH¯). Реакция протекает по механизму SN1, и это единственный случай протекания реакции в ароматическом ряду по такому механизму. Для замены на фтор используют безводную фтороводородную кислоту или тетрафторбораты HBF4 и NaBF4 (реакция Шимана*). Замена диазогруппы на хлор осуществляется взаимодействием с концентрированной соляной кислотой. А для получения фенолов достаточно бывает нагревания водного раствора соли диазония. В случае соли бензолдиазония SN1-механизм такого гидролиза может быть представлен в следующем виде:
|
1) |
|
|
2) |
|
Первая стадия осуществляется медленно и, в отличие от SN1-реакции в алифатическом ряду, необратимо (за счёт удаления из реакционной среды газообразного азота). Образующийся при этом катион арилия крайне неустойчив и поэтому быстро взаимодействует с жёсткой нуклеофильной частицей.
Нуклеофильное замещение диазогруппы используется при получении гваякола из о-анизидина по схеме:
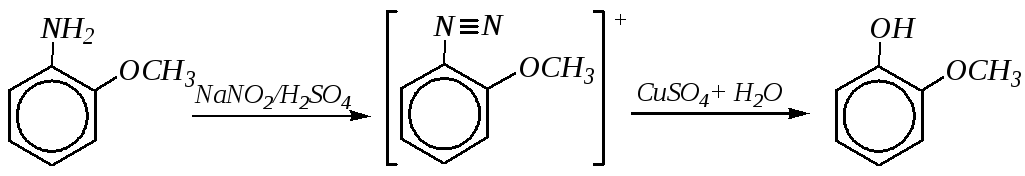
гваякол
Гваякол (2-метоксифенол) служит исходным сырьём для производства ванилина, который в свою очередь используется для синтеза противотуберкулёзного препарата фтивазид. Гваякол применяют как полупродукт в производствепапаверина.
Радикальное замещение диазогруппы осуществляется мягкими нуклеофилами (I¯, SCN¯, N3¯). Реакция протекает по механизму SR:
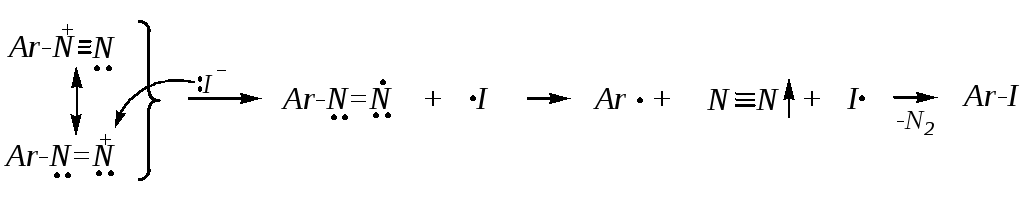
По радикальному механизму может осуществляться замена и на хлор, но для этого необходим катализ солями меди (I) (реакция Зандмейера):
![]()
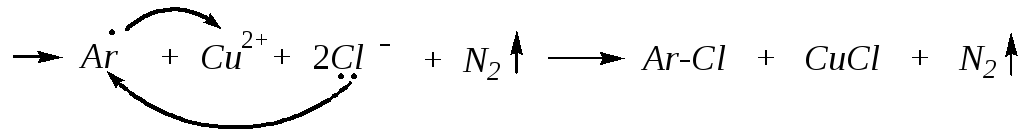
Восстановление с выделением азота может протекать как при действии неорганических восстановителей, так и органических веществ в роли восстановителей. Например, при взаимодействии солей диазония с фосфорноватистой кислотой или её солями протекает восстановление до аренов:

В качестве восстановителей может использоваться также этанол. Механизм его действия можно представить так:

Однако при восстановлении спиртами реакция сопровождается образованием этилариловых эфиров (в данном случае этилфенилового эфира).
10.7.4.2. Реакции восстановления без выделения азота
Реакции восстановления в мягких условиях приводят к образованию арилгидразинов:
![]()
Восстановление проводят в кислой среде, в качестве восстановителей используют:
SnCl2 + HCl,
Zn + CH3COOH,
Na2SO3, NaHSO3 или H2SO3.
10.7.4.3. Реакции азосочетания
Это важнейшие реакции диазосоединений, в результате протекания которых образуются азосоединения. В этих реакциях катион арендиазония проявляет электрофильные свойства. Но из-за большого размера и высокой степени возможной делокализации заряда электрофильные свойства катиона диазония выражены слабо (см. строение катиона — гл. 10.7.2). Поэтому электрофильные реакции таких катионов могут протекать только с ароматическими соединениями, имеющими повышенную электронную плотность на бензольном кольце, то есть преимущественно с фенолами и аминами. При этом скорость реакции азосочетания увеличивают не только электронодонорные заместители в молекуле субстрата (фенола или ароматического амина), но и электроноакцепторные заместители в ароматическом кольце катиона арендиазония, повышающие его электрофильность.
Азосочетание с фенолами проводят в слабощелочной среде, так как в этих условиях фенолы превращаются в более реакционноспособные феноляты:
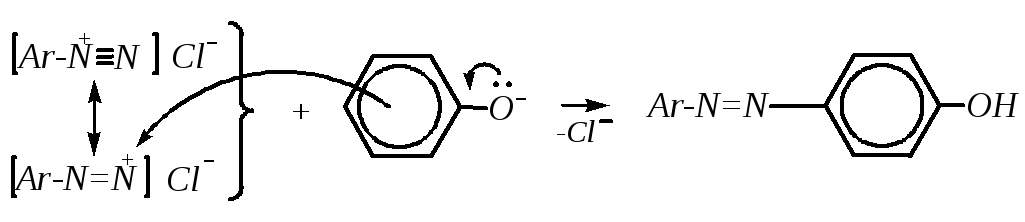
Но сильнощелочная среда недопустима из-за возможности превращения катиона диазония в нереакционноспособные арендиазогидроксид и арендиазотат-анион. Реакция азосочетания с фенолами в нейтральной среде, а также сочетание с алкиловыми эфирами фенолов, как правило, не осуществляются из-за низкой реакционной способности этих субстратов.
Азосочетание с ароматическими аминами проводят в слабокислой среде, так как в этих условиях повышается растворимость амина
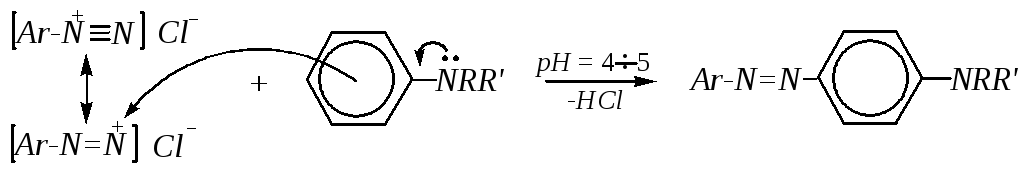 ,
,
но в сильнокислой среде амин превращается в аммонийную соль, неспособную к электрофильному замещению. В нейтральной и слабощелочной среде электрофильная атака осуществляется по атому азота, и вместо продуктов азосочетания образуются триазены (диазоаминосоединения):
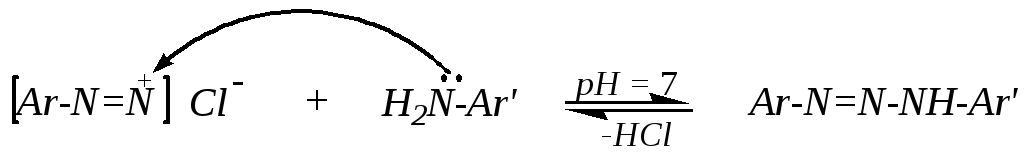 ,
,
которые при нагревании в кислой среде изомеризуются в азосоединения — продукты реакции азосочетания. Это возможно по причине неустойчивости триазенов и связанного с ней наличия равновесия между ними и исходными веществами, которые в кислой среде необратимо превращаются в азосоединения.
Реакция азосочетания всегда проходит в пара-положение ароматического кольца фенола или амина. Это связано с большим пространственным размером электрофильной частицы (диазокатиона) и, значит, стерическими препятствиями при атаке в орто-положение. Однако если п-положение в исходной молекуле фенола или амина занято, то становится возможной электрофильная атака в о-положение.
Если соль арендиазония содержит несколько сильных электроноакцепторных групп в ароматическом кольце, то она может сочетаться не только с аминами и фенолами, но и с некоторыми аренами, например, с мезитиленом:

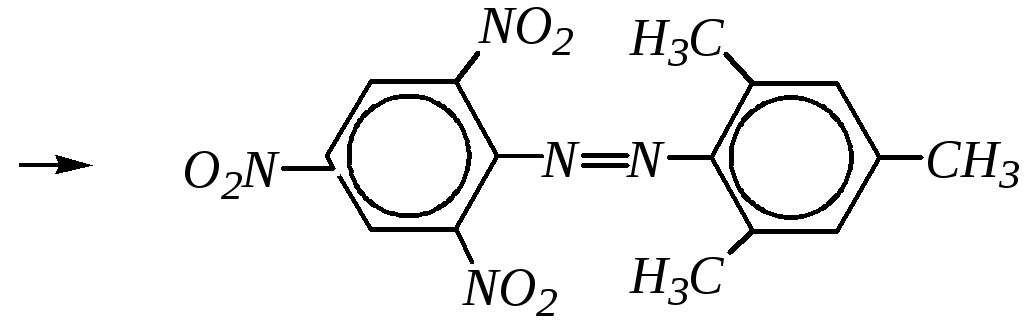
Реакция азосочетания — это не только один из распространённых способов получения азосоединений, но и реакция образования азокрасителей, в молекулы которых входит структурный фрагмент азосоединения. Номенклатура азокрасителей вообще и азосоединений в частности связана с этим способом получения. В реакции азосочетания катион диазония (электрофильный реагент) называется диазосоставляющей, а молекула субстрата (как правило, фенола или амина) — азосоставляющей. Основа названия — азосоставляющая, а диазосоставляющая присутствует в названии как заместитель «арилазо-», например:
|
|
— п-фенилазофенол |
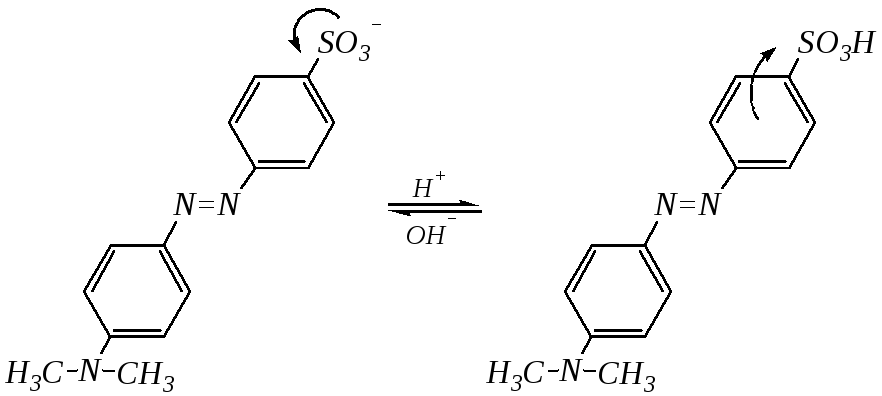
Многие азосоединения интенсивно поглощают в видимой области спектра и могут быть использованы как для крашения тканей, бумаги, полимерных материалов, так и в качестве индикаторов в аналитической химии. Азокрасители содержат в молекуле одну или несколько азогрупп и электронодонорные группы -OH, -NH2, -N(CH3)2, -N(C2H5)2 и др. Кроме того, могут присутствовать и акцепторы -NO2, -SO3H и др. В результате в молекуле создаётся длинная цепь сопряжения, и при поглощении кванта света легко происходят электронные переходы *; за счёт этого вещество поглощает свет определённой длины волны в видимой области.
Известно огромное количество азокрасителей. К ним относятся и индикаторы, меняющие свою окраску в зависимости от рН среды. При протонировании или депротонировании таких молекул сопряжённая система меняет свои свойства и, соответственно, изменяется цвет. Примером индикатора, относящегося к азосоединениям, является метиловый оранжевый: