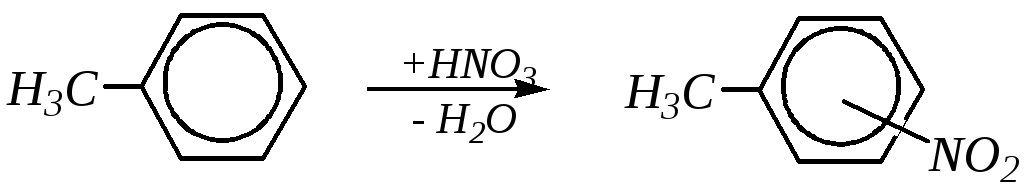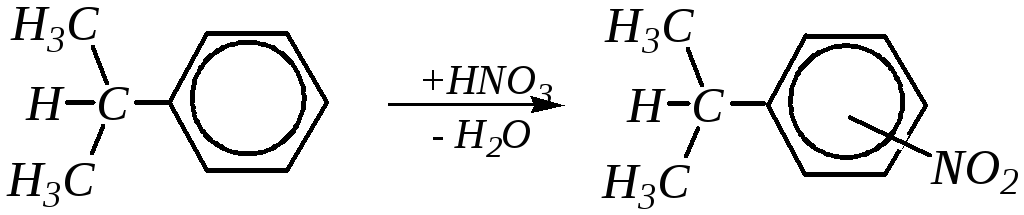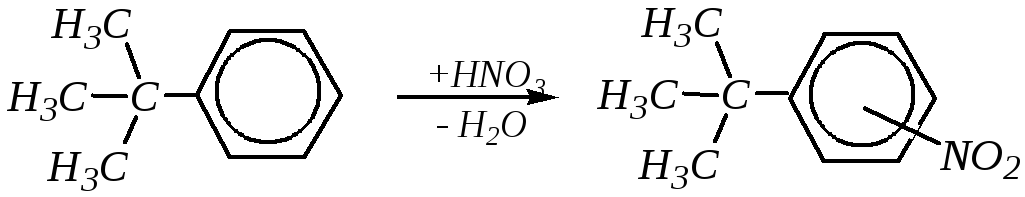- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.1.2. Реакции электрофильного замещения
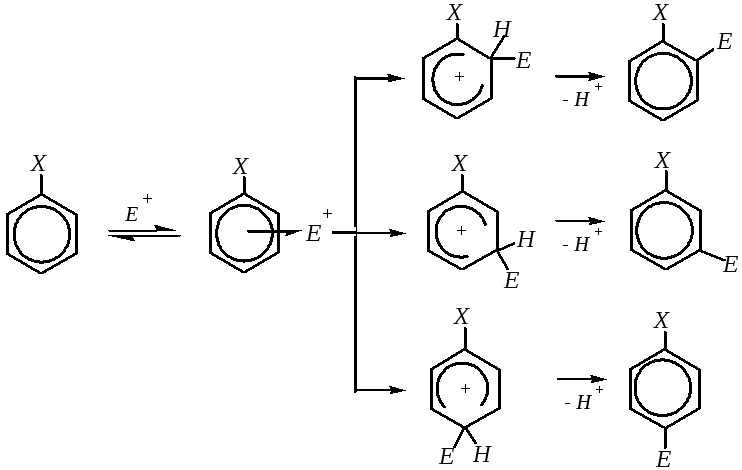
Взаимодействие монозамещённого бензола с электрофильной частицей должно протекать по механизму, рассмотренному на примере бензола (гл. 9.5.1.1). Во всех этих случаях реакция электрофильного замещения бимолекулярна (в лимитирующей стадии принимает участие и субстрат, и электрофил), и, таким образом, для механизма можно применить обозначение SE2:
|
|
о-
м-
п- |
Значительно реже встречается другой механизм, в котором последовательность стадий обратная, то есть уходящая группа отщепляется до электрофильной атаки. Это механизм мономолекулярного электрофильного замещения (SE1). Он возможен лишь тогда, когда центральный атом уходящей группы — это атом углерода (например, реакции декарбоксилирования — гл. 9.6, п.5).
Как следует из приведённой схемы, в результате электрофильного замещения атома водорода в монозамещённых бензолах возможно образование трёх изомерных продуктов реакции. Однако какие преимущественно образуются изомеры, зависит от природы заместителя Х. Заместитель в молекуле ароматического соединения влияет не только на его реакционную способность, но и на направление вступления электрофила Е. Поэтому все заместители по ориентирующему действию делят на две группы:
1) орто-пара-ориентанты (заместители I рода) и
2) мета-ориентанты (заместители II рода).
Ориентирующее действие заместителя зависит прежде всего от распределения электронной плотности в бензольном кольце под влиянием электронных эффектов этого заместителя.
Под влиянием донорных заместителей электронная плотность повышается в основном в орто- и пара-положениях ароматического кольца по отношению к заместителю, как было показано граничными структурами (см. выше). Поэтому все электронодонорные заместители направляют электрофильную частицу в орто- и пара-положения и являются заместителями I рода.
Ориентирующее направление заместителей I рода в о- и п-положения бензольного кольца может быть объяснено также динамическим подходом, то есть сравнением устойчивости образующихся -комплексов. При образовании -связи между электрофилом и углеродным атомом, находящимся в орто-, мета- или пара-положении бензольного кольца, образуются соответственно три -комплекса, строение которых описывается следующими граничными структурами:

В случаях вступления электрофила в о- ип-положения число граничных структур данных-комплексов больше, чем при вступлении электрофила вм-положение бензольного кольца (четыре против трёх). Кроме того, средио- ип-изомеров присутствуют такие структуры, в которых подчёркивается участие неподелённой электронной пары первого атома заместителя в делокализации положительного заряда-комплекса, — это последние из изображённых в соответствующих рядах структур.
На ароматическом кольце галогенозамещённых бензолов электронная плотность понижена, но тем не менее галогены оказывают сильно выраженное орто- и пара-ориентирующее действие, и поэтому галогены тоже относятся к заместителям I рода, хотя и являются электроноакцепторами. Это явление рассматривается при обсуждении свойств арилгалогенидов (гл. 10.2.4.1), но может быть объяснено и динамическим подходом, как и для любого другого заместителя, проявляющего +М-эффект (см. выше).
Все остальные акцепторные заместители проявляют –М-эффект по отношению к бензольному кольцу, и особенно сильное понижение электронной плотности наблюдается в орто- и пара-положениях к заместителю (показано граничными структурами). Поэтому электрофильная частица будет направляться преимущественно в мета-положение, где уменьшение электронной плотности почти не происходит. Таким образом, все электроноакцепторные заместители, за исключением галогенов, относятся к мета-ориентантам, или заместителям II рода.
С другой стороны, мета-ориентирующее действие групп, проявляющих –М-эффект, может быть объяснено и динамическим подходом, то есть сравнением устойчивости образующихся-комплексов. В процессе электрофильного замещения атома водорода в молекуле замещённого бензола могут образоваться три изомерных-комплекса, строение которых описывается граничными структурами:
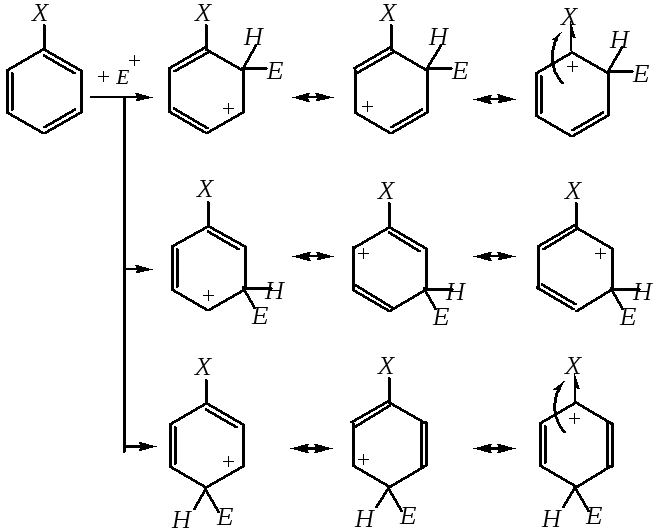
Несмотря на то, что число граничных структур -комплексов при вступлении электрофила ворто-,мета- ипара-положения одинаково,-комплексы с электрофильной частицей ворто- ипара-положениях по отношению к заместителю менее устойчивы, так как одна из трёх граничных структур в этих случаях сильно дестабилизирована за счёт локализации положительного заряда на атоме углерода, связанном с заместителем. Эти граничные структуры изображены последними в соответствующих рядах.
Однако, рассматривая правила ориентации, нельзя забывать, что они определяют лишь преимущественное направление реакции замещения, то есть замещение идёт в то или иное положение преобладающим образом, но не исключительно. Обычно образуется смесь всех трёх изомеров, но они находятся в соотношении, определяемом правилами ориентации.
На возможность преимущественного образования тех или иных изомеров помимо мезомерного эффекта заместителя влияют и другие факторы.
Индуктивный эффект
На соотношение продуктов орто- и пара-замещения может оказывать влияние и величина индуктивного эффекта заместителя. Особенно это характерно для таких заместителей, как -F и -OH, которые содержат атомы сильно электроотрицательных элементов, связанные с бензольным кольцом. В этих случаях за счёт значительного –I-эффекта орто-положение дезактивируется, и, как результат, преобладает доля п-замещения.
Пространственный фактор
Орто- и пара-положения в ароматическом кольце примерно одинаково активированы +М-эффектом донорных заместителей, и по статистике должно получаться 67% орто- и 33% пара-изомеров, так как имеются два орто-положения и только одно пара-положение. Однако продукта пара-замещения часто получается больше. Это объясняется, главным образом, пространственными эффектами. Заместитель, находящийся в ароматическом кольце, экранирует орто-положения и мешает реагенту их атаковать. Пространственные препятствия проявляются тем сильнее, чем больше объём заместителя, связанного с ароматическим кольцом. Так, при нитровании аренов (гл. 9.5.2.1) получается следующее соотношение изомерных продуктов:
|
|
58% о-изомера 4% м-изомера 38% п-изомера |
|
|
|
|
|
30% о-изомера 7.7% м-изомера 62.3% п-изомера |
|
|
|
|
|
15.8% о-изомера 11.5% м-изомера 72.7% п-изомера |
Размер электрофильной частицы также может влиять на соотношение орто- и пара-продуктов замещения. Так, при сульфировании электрофильная частица имеет больший размер, чем при нитровании, и поэтому сульфирование чаще всего приводит к образованию п-изомеров.
Электрофильная активность реагента оказывает прямое влияние на направление реакции замещения. Так, если электрофил обладает высокой энергией, то селективность реакции низкая; если же электрофильные свойства реагента выражены слабо, то в этом случае, как правило, селективность реакции высокая. Так, при взаимодействии толуола с бромом в присутствии AlBr3 образуется 33% о-изомера, 66.7% п-изомера и 0.3% м-изомера, при взаимодействии толуола с азотной кислотой — 58% о-изомера, 38% п-изомера и 4% м-изомера, а при взаимодействии этого же субстрата с серной кислотой — соответственно 32%, 62% и 6%.