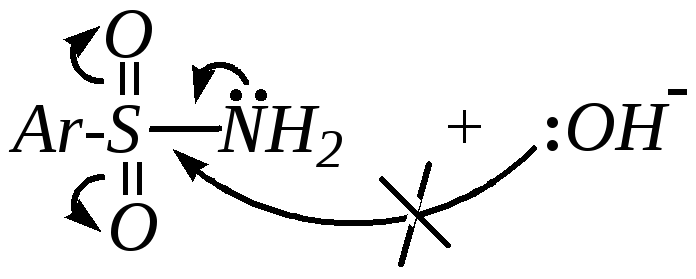- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.1. Номенклатура диазосоединений
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.8.1. Изомерия, номенклатура
- •10.8.2. Строение бензальдегида
- •10.8.3. Физические и химические свойства
- •10.8.4. Способы получения
- •10.8.5. Важнейшие представители
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.9.1. Классификация, номенклатура
- •10.9.2. Строение бензойной кислоты
- •10.9.3. Физические и химические свойства
- •10.9.4. Способы получения
- •10.9.5. Важнейшие представители
- •10.10. Физиологическая роль функциональных производных бензола
- •Вопросы и упражнения
10.3.4. Способы получения
Основным способом получения аренсульфокислот является сульфирование ароматических соединений. В качестве сульфирующих агентов используются концентрированная серная кислота, олеум (SO3+H2SO4), триоксид серы, хлорсульфоновая кислотаClSO3H и различные комплексы. В общем случае схему превращения можно представить так:
Ar-H + X-SO3H Ar-SO3H + HX
где X — это гидроксогруппа -ОH или атом хлора -Cl
или так:
Ar-H + SO3 Ar-SO3H
Подробно механизм сульфирования рассмотрен ранее (гл. 9.5.1.1).
Сульфокислоты могут получаться и при гидролизе аренсульфохлоридов:
Ar-SO2Сl + H2O Ar-SO3H + HCl
Бензолсульфокислоту получают путём сульфирования бензола купоросным маслом (92—93%-я H2SO4) или моногидратом серной кислоты (98—100%-я H2SO4), которые берутся в двойном избытке (2 моля серной кислоты на 1 моль бензола). Сульфирование начинают при температуре 333 К, а заканчивают при температуре 378 К. Наиболее низкий расход серной кислоты достигается при сульфировании в парáх.
10.3.5. Производные сульфокислот
Наиболее важные в практическом отношении производные сульфокислот — это галогенангидриды (в частности, сульфохлориды), сложные эфиры (алкилсульфонаты) и амиды.
10.3.5.1. Аренсульфохлориды
Аренсульфохлориды, или хлорангидриды аренсульфокислот могут быть получены из самих сульфокислот (гл. 10.3.3.5), при взаимодействии с PCl5,SOCl2или некоторыми другими хлорирующими агентами.
Другим способом получения аренсульфохлоридов является прямое сульфохлорирование ароматических соединений, которое осуществляется действием избытка хлорсульфоновой кислоты ClSO3Н. Реакция протекает в две стадии: сначала образуется аренсульфокислота, которая на второй стадии подвергается хлорированию избытком хлорсульфоновой кислоты:
Ar-H
![]() Ar-SO3H
Ar-SO3H
![]() Ar-SO2Cl
Ar-SO2Cl
Сульфохлориды в отличие от сульфокислот более активны в нуклеофильных реакциях по атому серы. Причины их высокой реакционной способности те же, что и для галогенангидридов карбоновых кислот (гл. 6.4.4), — это незначительный эффект сопряжения атома хлора с сульфогруппой и высокая устойчивость уходящего хлорид-аниона.
В связи с малой доступностью тетраэдрического атома серы в сульфохлоридах механизм нуклеофильного замещения атома серы должен быть близок к мономолекулярному:
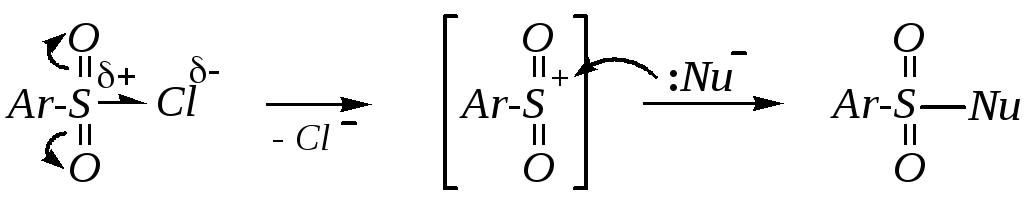
Так, например, сульфохлориды легко гидролизуются, превращаясь в сульфокислоты, легко образуют эфиры и амиды.
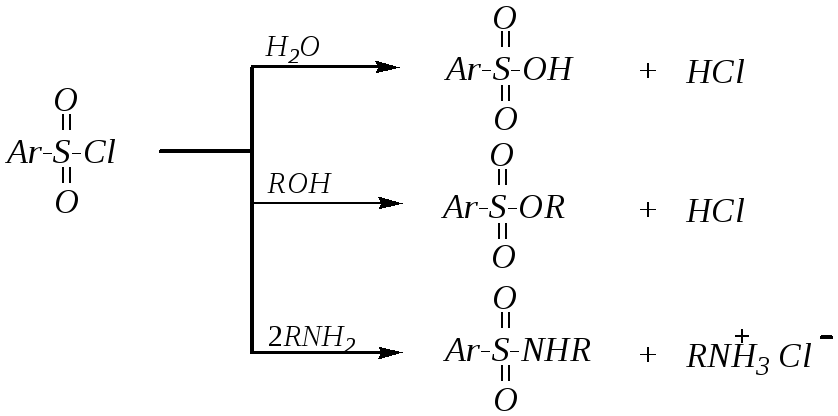
10.3.5.2. Эфиры аренсульфокислот
Эфиры аренсульфокислот, или алкиларенсульфонаты, могут быть получены только из галогенангидридов аренсульфокислот (в частности, из аренсульфохлоридов — см. выше).
Важным свойством этих соединений является их высокая алкилирующая способность. Например, реакционная способность метил-п-толуолсульфоната (метилтозилата) значительно выше, чем алкилгалогенидов и диалкилсульфатов. Это объясняется высокой полярностьюC–РHHkmklmlkmO-связи в алкилсульфонате и, что ещё более существенно, устойчивостью сульфонат-иона. Рассмотрим механизм метилирования этилата натрия. (Аналогичный механизм наблюдается и для реакций алкиларенсульфонатов со спиртами, фенолами, аминами, карбоновыми кислотами и др.).
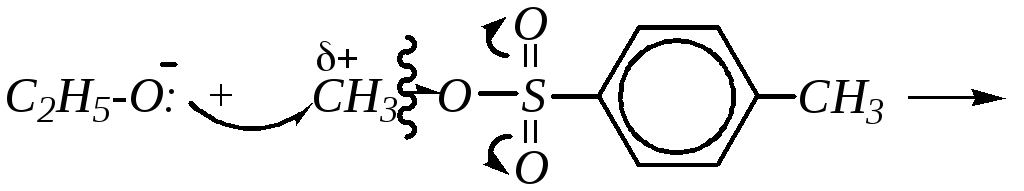
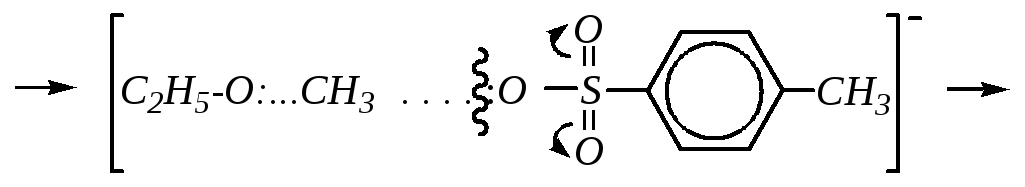

Механизм реакции — промежуточный между SN1 иSN2. Атака нуклеофильной частицей начинается по недиссоциированной молекуле, но её полная диссоциация происходит в момент атаки, то есть разрыв старой-связи значительно опережает образование новой.
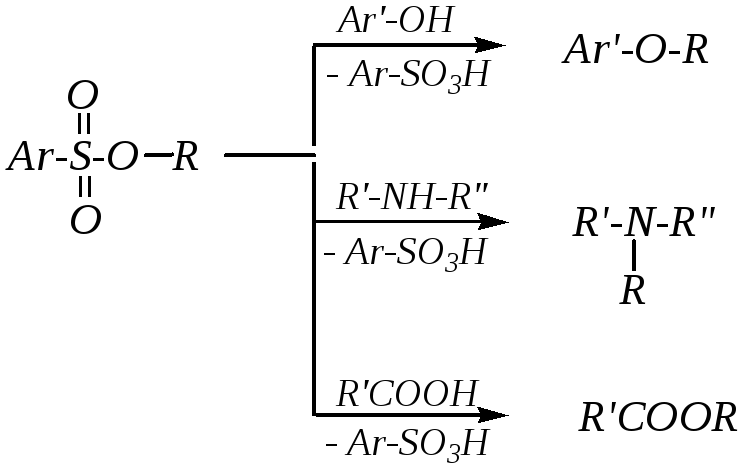
Таким образом, при реакции алкиларенсульфонатов со спиртами и алкоголятами образуются простые эфиры. Если в качестве нуклеофилов использовать фенолы, вторичные амины, карбоновые кислоты, то в результате реакций их с эфирами аренсульфокислот образуются соответственно простые эфиры фенолов, третичные амины, сложные эфиры карбоновых кислот:
Алкилирование метилбензолсульфонатом применялось в производстве лекарственного препарата бензамона (в настоящее время бензамон снят с производства):

Гидролиз алкиларенсульфонатов протекает легко при действии воды или разбавленной щёлочи. Здесь также наблюдается нуклеофильное замещение у насыщенного атома углерода. Если алкильная группа первичная, то механизм близок SN2, и использование щёлочи более эффективно, чем нейтральной воды:
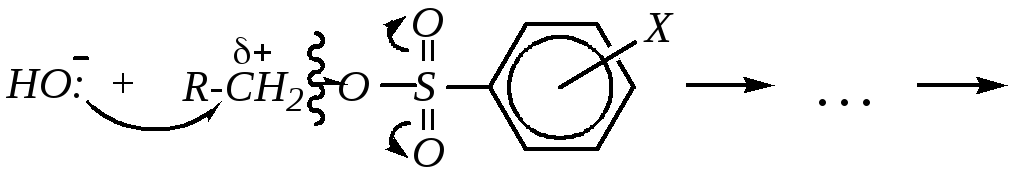

Если алкильный радикал разветвлённый, то механизм может быть и мономолекулярным, и гидролиз так же легко осуществляется и водой.
10.3.5.3. Аренсульфамиды
Амиды аренсульфокислот, так же как и эфиры аренсульфокислот, могут быть получены только из соответствующих хлорангидридов.
В распределении электронной плотности
в сульфамидной группировке большую
роль играет мезомерный эффект, направленный
от атома азота к атому серы, за счёт
которого сильно поляризуются связи
N–H.
Поэтому для сульфамидов характерно
проявление значительных кислотных
свойств. Образующийся при этом
сульфамид-анион устойчив благодаря
сильной делокализации отрицательного
заряда. Эти свойства проявляются,
например, в том, что нерастворимый в
воде сульфамид хорошо растворяется
даже в холодном растворе щелочи:
распределении электронной плотности
в сульфамидной группировке большую
роль играет мезомерный эффект, направленный
от атома азота к атому серы, за счёт
которого сильно поляризуются связи
N–H.
Поэтому для сульфамидов характерно
проявление значительных кислотных
свойств. Образующийся при этом
сульфамид-анион устойчив благодаря
сильной делокализации отрицательного
заряда. Эти свойства проявляются,
например, в том, что нерастворимый в
воде сульфамид хорошо растворяется
даже в холодном растворе щелочи:
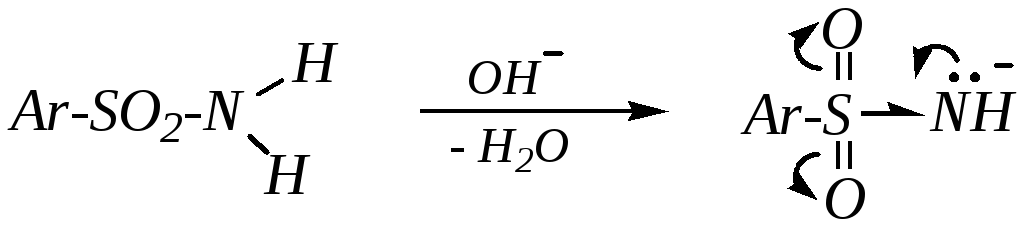
Сульфамид-ион в свою очередь обладает нуклеофильными свойствами. Это проявляется, например, по отношению к галогеналканам; он может также взаимодействовать с такими электрофилами, как молекулы галогенов:

Другая особенность аренсульфамидов заключается в том, что эти соединения, в отличие от амидов карбоновых кислот, не подвергаются гидролизу в щелочной среде, а гидролизуются только в кислой. Щелочной гидролиз связан с атакой гидроксид-иона по атому серы, а такие реакции в аренсульфамидах сильно затруднены, так же как и нуклеофильная атака по сере в молекулах аренсульфокислот. При кислотном гидролизе же происходит протонирование молекулы аренсульфамида, которое активирует дальнейшую атаку молекулами воды образовавшегося катиона.