
- •Предмет физики
- •Структура физического познания.
- •Пространственно-временная область изучаемых физикой объектов
- •Физические теории
- •Раздел 1. Физические основы механики.
- •Глава 1. Кинематика.
- •§1.1. Система отсчета. Инерциальные системы отсчета. Принцип относительности.
- •§1.2. Кинематика материальной точки.
- •§1.3. Равномерное и равнопеременное движения.
- •§ 1.4. Кинематика вращательного движения.
- •§ 1.5. Краткие итоги главы 1.
- •Глава 2. Динамика материальной точки.
- •§ 2.1 .Задача динамики. Состояние материальной точки. Динамические характеристики движения.
- •§ 2.2. Законы Ньютона. Второй закон как уравнение движения.
- •§ 2.3. Силы в механике.
- •§ 2.4. Работа силы. Мощность.
- •§ 2.4. Механическая энергия.
- •§ 2.5. Краткие итоги главы 2
- •Глава 3.Законы сохранения в механике.
- •§ 3.1.Фундаментальный характер законов сохранения
- •§ 3.2. Закон сохранения импульса.
- •§ 3.3. Закон сохранения механической энергии
- •§ 3.4. Столкновения тел
- •Глава 4. Динамика вращательного движения.
- •§ 4.1. Кинетическая энергия вращающегося и катящегося тел
- •§ 4.2. Момент инерции
- •§ 4.3. Работа и мощность при вращательном движении. Момент силы относительно оси
- •§ 4.4. Уравнение динамики вращательного движения.
- •§ 4.5. Закон сохранения момента импульса
- •§ 4.6. Краткие итоги главы 4
- •Раздел 2. Молекулярная физика и термодинамика
- •Глава 5. Кинетическая теория
- •§ 5.1. Тепловое движение
- •§ 5.2. Основное уравнение кинетической теории газа
- •§ 5.3. Уравнение Клапейрона – Менделеева
- •§ 5.4. Молекулярно-кинетический смысл абсолютной температуры. Средняя энергия теплового движения молекулы
- •§ 5.5. Распределение Максвелла молекул газа по скоростям
- •§ 5.6. Барометрическая формула. Распределение Больцмана.
- •§ 5.7. Среднее число столкновений и средняя длина свободного пробега молекул.
- •§ 5.8. Выводы из главы 5.
- •Глава 6. Термодинамика.
- •§ 6.1. Тепловые процессы
- •§ 6.2. Первое начало термодинамики.
- •§ 6.3 Изопроцессы.
- •§ 6.4. Тепловая и холодильная машины
- •§ 6.5. Цикл Карно
- •§ 6.6. Энтропия.
- •§ 6.7. Второе начало термодинамики.
- •§ 6.8. Основные выводы главы 6.
- •Раздел 3. Электромагнетизм
- •Глава 7. Электростатика
- •§7.1.Электрический заряд. Закон Кулона.
- •§7.2. Электрическое поле. Напряженность.
- •§ 7.3. Теорема Гаусса.
- •§ 7.4. Потенциал и работа электростатического поля.
- •§ 7.5. Связь напряженности и потенциала электростатического поля.
- •§ 7.6.Электростатическое поле в веществе.
- •§ 7.7. Электроемкость. Конденсатор.
- •§ 7.8. Энергия электрического поля.
- •Глава 8. Постоянный электрический ток.
- •§ 8.1. Электрический ток: сила тока, плотность тока
- •§ 8.2. Механизм электропроводности
- •§ 8.3. Законы постоянного тока.
- •§ 8.4. Работа и мощность тока
- •Глава 9. Магнитное поле тока
- •§ 9.1 Магнитное взаимодействие. Магнитное поле
- •§ 9.2. Закон Био-Савара-Лапласа
- •9.3. Вихревой характер магнитного поля.
- •§ 9.4. Действие магнитного поля на токи и движущиеся электрические заряды
- •§ 9.5. Магнитное поле в веществе
- •Глава 10. Явление электромагнитной индукции
- •§ 10.1. Основной закон электромагнитной индукции
- •§ 10.2. Самоиндукция и взаимная индукция
- •§ 10.3. Энергия магнитного поля
- •§ 10.4. Вихревое электрическое поле. Уравнения Максвелла
§ 5.3. Уравнение Клапейрона – Менделеева
1. Экспериментальное изучение поведения газов в XVII – XIX веках показало, что состояние газа определяют давление p, объем V и температура Т. Напомним, что температура характеризует степень нагретости тела. Абсолютная температура Т не бываем отрицательной, измеряется в кельвинах (К) и связана с температурой t, измеренной в градусах Цельсия так:
T = (t0C + 273)К (5.3.1)
p, V и Т называются параметрами (или термодинамическими параметрами) состояния газа, и они взаимосвязаны друг с другом. Уравнение, связывающее между собой параметры состояния, называется уравнением состояния. Оно было получено из опытных газовых законов Бойля-Мариотта, Гей-Люссака и Шарля и называется уравнением Клапейрона – Менделеева или уравнением состояния идеального1 газа:
рV=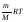 (5.3.2)
(5.3.2)
Здесь m
– масса газа, M –
молярная масса, R –
универсальная (или молярная) газовая
постоянная, в СИ R
= 8,3 Дж/(моль.К). Напомним, что
количество вещества
 в СИ измеряют в моль, оно выражается
так:
в СИ измеряют в моль, оно выражается
так:
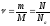 (5.3.3)
(5.3.3)
2. Используя понятие концентрации частиц и постоянную Больцмана
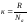 ,
( к = 1,38.10-23 Дж/К)
(5.3.4)
,
( к = 1,38.10-23 Дж/К)
(5.3.4)
получаем еще одну формулу уравнения состояния газа:
р=пкТ (5.3.5)
Уравнение состояния содержит в себе, в частности, закон Авогадро, полученный из опыта. Он гласит, что при одинаковых температурах и одинаковых давлениях в одинаковых объемах любых газов содержится одинаковое число частиц. И это же уравнение содержит в себе опытный факт: при нормальных условиях 2 один моль любого газа занимает объем V=22,4 л. (Вспомните, сколько структурных единиц в 1 моль и оцените, сколько молекул в воздухе того помещения, где Вы сейчас находитесь).
§ 5.4. Молекулярно-кинетический смысл абсолютной температуры. Средняя энергия теплового движения молекулы
1. Сравним уравнения состояния газа в
форме (5.2.3) и в форме (5.3.5). Первое из них
получено теоретически в модели идеального
газа, второе есть обобщение опыта.
Сравнение этих формул раскрывает смысл
абсолютной температуры как меры средней
энергии теплового движения молекул:
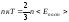 .
Чаще эту формулу записывают так:
.
Чаще эту формулу записывают так:
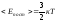 (5.4.1)
(5.4.1)
Формула (5.4.1) показывает, что абсолютная температура Т является статистической характеристикой. Понятие температуры не применимо к одной частице (молекуле) вещества. Оно имеет физический смысл только для равновесного состояния термодинамической системы, и является термодинамическим параметром состояния. В состоянии термодинамического равновесия средняя энергия теплового движения молекул разных газов одинакова при одинаковых температурах. Это означает, что в смеси газов, например, в воздухе, тяжелые частицы, например, молекулы кислорода, движутся в среднем медленнее легких молекул водорода.
Из приведенных рассуждений следует еще один важный вывод: модель идеального газа применима к реальному газу, подчиняющемуся опытным газовым законам, другими словами, идеальный газ - это реальный газ, подчиняющийся уравнению Клапейрона - Менделеева.
2. Напомним, что число независимых координат, однозначно задающих положение тела в пространстве, называют числом степеней свободы и обозначают i. Одноатомные молекулы в модели идеального газа считаются материальными точкам, для них i=3. Это означает, что произвольное движение м.т. в пространстве можно рассматривать как сумму движений по трем осям координат одновременно. При поступательном движении твердого тела все его точки движутся одинаково, так что любое движение одноатомной молекулы, как и поступательное движение а.т.т., имеет три степени свободы поступательного движения: iпост =3. Кинетическая энергия Ек=mυ2/2=m(υx2+υy2+υz2)/2 также является суммой трех слагаемых. Вследствие хаотичности движения средние значения квадратов проекций скоростей на все три оси координат одинаковы, и на каждую степень свободы поступательного движения приходится одинаковая энергия кТ/2. Формулу (5.4.1) можно записать так:
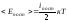 (5.4.2)
(5.4.2)
Из одноатомных молекул состоят инертные газы (He, Ne). Молекулы других газов (H2, O2, CO2, CH4 - метан) состоят из двух-, трех-, многоатомных молекул. Эти газы подчиняются уравнению Клапейрона – Менделеева, и тоже являются идеальными. В модели идеального газа их молекулы являются абсолютно твердыми телами, состоящими из двух, трех и более материальных точек (атомов). Твердое тело может двигаться поступательно и вращаться. Его число степеней свободы складывается из числа степеней свободы поступательного и вращательного движений:
i = iпост + iвращ (5.4.3)
На рис. 21 показаны двухатомная и
трехатомная молекулы. Положение
двухатомной молекулы задают пять
координат. Каждая точка (атом) имеет
три координаты, и эти шесть чисел связаны
между собой уравнением, выражающим
неизменное расстояние между точками.
Зная пять координат, шестую можно
вычислить из этого уравнения. Таким
образом, двухатомная молекула имеет
пять степеней свободы. Рассуждая
аналогичным образом, получаем, что
число степеней свободы трехатомной
молекула равно шести. Напомним, что
моделью многоатомной молекулы служит
а.т.т., положение которого в пространстве
однозначно задают три точки, не лежащие
на одной прямой. Следовательно, число
степеней свободы жесткой молекулы,
состоящей из трех и более атомов, равно
шести. 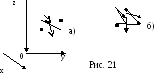
Любое движение молекулы, перемещающее ее в новое положение в пространстве, можно разделить на два: поступательное, задаваемое перемещением ее центра инерции по осям x, y и z, и вращательное вокруг других трех осей координат, жестко связанных с центром инерции. Эти оси координат показаны на рисунке, там же стрелками указаны возможные направления вращений, дающие новое положение молекулы. Итак, для любой молекулы iпост =3. Для двухатомной молекулы iвращ =2, для трех-, многоатомной молекулы iвращ =3 (см. формулу 5.4.3).
3. При столкновениях друг с другом
молекулы обмениваются энергией. В
результате удара поступательно
движущаяся многоатомная молекула может
начать вращаться, или, наоборот,
вращающаяся молекула может начать
двигаться поступательно. В общем случае
кинетические энергии поступательного
и вращательного движений при тепловом
движении молекул газа изменяются
хаотически. Эти соображения составляют
суть теоремы о равном распределении
энергии по степеням свободы (приводим
ее без вывода): на каждую степень
свободы теплового движения частицы
приходится одинаковая средняя
кинетическая энергия, равная
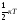 .
.
Средняя энергия теплового движения молекулы с учетом всех ее степеней свободы выражается формулой:
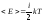 (5.4.3)
(5.4.3)
Еще раз отметим, что в модели идеального газа молекулы жесткие (а.т.т) и имеют только поступательные и вращательные степени свободы. Эта модель дает хорошее согласие с опытом при температурах, не слишком низких, или, наоборот, не слишком высоких. Этому диапазону соответствуют температуры (102 …103) К. При низких температурах «заморожены», т.е. отсутствуют вращательные степени свободы. При высоких температурах молекулы перестают быть жесткими, атомы в них колеблются, возбуждаются колебательные степени свободы. В этих температурных областях проявляются квантовые свойства движения, и классическая теория не работает.
