- •Предмет физики
- •Структура физического познания.
- •Пространственно-временная область изучаемых физикой объектов
- •Физические теории
- •Раздел 1. Физические основы механики.
- •Глава 1. Кинематика.
- •§1.1. Система отсчета. Инерциальные системы отсчета. Принцип относительности.
- •§1.2. Кинематика материальной точки.
- •§1.3. Равномерное и равнопеременное движения.
- •§ 1.4. Кинематика вращательного движения.
- •§ 1.5. Краткие итоги главы 1.
- •Глава 2. Динамика материальной точки.
- •§ 2.1 .Задача динамики. Состояние материальной точки. Динамические характеристики движения.
- •§ 2.2. Законы Ньютона. Второй закон как уравнение движения.
- •§ 2.3. Силы в механике.
- •§ 2.4. Работа силы. Мощность.
- •§ 2.4. Механическая энергия.
- •§ 2.5. Краткие итоги главы 2
- •Глава 3.Законы сохранения в механике.
- •§ 3.1.Фундаментальный характер законов сохранения
- •§ 3.2. Закон сохранения импульса.
- •§ 3.3. Закон сохранения механической энергии
- •§ 3.4. Столкновения тел
- •Глава 4. Динамика вращательного движения.
- •§ 4.1. Кинетическая энергия вращающегося и катящегося тел
- •§ 4.2. Момент инерции
- •§ 4.3. Работа и мощность при вращательном движении. Момент силы относительно оси
- •§ 4.4. Уравнение динамики вращательного движения.
- •§ 4.5. Закон сохранения момента импульса
- •§ 4.6. Краткие итоги главы 4
- •Раздел 2. Молекулярная физика и термодинамика
- •Глава 5. Кинетическая теория
- •§ 5.1. Тепловое движение
- •§ 5.2. Основное уравнение кинетической теории газа
- •§ 5.3. Уравнение Клапейрона – Менделеева
- •§ 5.4. Молекулярно-кинетический смысл абсолютной температуры. Средняя энергия теплового движения молекулы
- •§ 5.5. Распределение Максвелла молекул газа по скоростям
- •§ 5.6. Барометрическая формула. Распределение Больцмана.
- •§ 5.7. Среднее число столкновений и средняя длина свободного пробега молекул.
- •§ 5.8. Выводы из главы 5.
- •Глава 6. Термодинамика.
- •§ 6.1. Тепловые процессы
- •§ 6.2. Первое начало термодинамики.
- •§ 6.3 Изопроцессы.
- •§ 6.4. Тепловая и холодильная машины
- •§ 6.5. Цикл Карно
- •§ 6.6. Энтропия.
- •§ 6.7. Второе начало термодинамики.
- •§ 6.8. Основные выводы главы 6.
- •Раздел 3. Электромагнетизм
- •Глава 7. Электростатика
- •§7.1.Электрический заряд. Закон Кулона.
- •§7.2. Электрическое поле. Напряженность.
- •§ 7.3. Теорема Гаусса.
- •§ 7.4. Потенциал и работа электростатического поля.
- •§ 7.5. Связь напряженности и потенциала электростатического поля.
- •§ 7.6.Электростатическое поле в веществе.
- •§ 7.7. Электроемкость. Конденсатор.
- •§ 7.8. Энергия электрического поля.
- •Глава 8. Постоянный электрический ток.
- •§ 8.1. Электрический ток: сила тока, плотность тока
- •§ 8.2. Механизм электропроводности
- •§ 8.3. Законы постоянного тока.
- •§ 8.4. Работа и мощность тока
- •Глава 9. Магнитное поле тока
- •§ 9.1 Магнитное взаимодействие. Магнитное поле
- •§ 9.2. Закон Био-Савара-Лапласа
- •9.3. Вихревой характер магнитного поля.
- •§ 9.4. Действие магнитного поля на токи и движущиеся электрические заряды
- •§ 9.5. Магнитное поле в веществе
- •Глава 10. Явление электромагнитной индукции
- •§ 10.1. Основной закон электромагнитной индукции
- •§ 10.2. Самоиндукция и взаимная индукция
- •§ 10.3. Энергия магнитного поля
- •§ 10.4. Вихревое электрическое поле. Уравнения Максвелла
§ 6.6. Энтропия.
1. Энтропия (от греч. поворот, превращение)
является функцией состояния
термодинамической системы в том же
смысле, что и внутренняя энергия. Это
значит, что каждому состоянию
термодинамической системы соответствует
определенное значение энтропии. При
переходе системы из одного состояния
в другое изменение энтропии одинаково
для любых процессов, связывающих эти
два состояния, а в цикле изменение
энтропии равно нулю. Рассмотрим цикл
Карно. Его КПД может быть выражен так:
=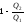
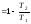 ,
откуда следует:
,
откуда следует:
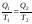 ,
и далее:
,
и далее:
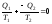 .
Напомним, что тепло – алгебраическая
величина. Q<0 означает,
что у тела «забирают» тепло, т.е. оно
получает отрицательное количество
тепла. Количество тепла, изотермически
сообщенное телу, деленное на температуру,
называют приведенным количеством
тепла. В цикле Карно приведенное
количество тепла равно нулю. В
предыдущем параграфе мы отмечали, что
любой обратимый цикл можно рассматривать
как сумму элементарных циклов Карно,
следовательно, в любом обратимом цикле
приведенное количество тепла равно
нулю. При элементарном изменении
состояния приведенное количество тепла
выразится формулой:
.
Напомним, что тепло – алгебраическая
величина. Q<0 означает,
что у тела «забирают» тепло, т.е. оно
получает отрицательное количество
тепла. Количество тепла, изотермически
сообщенное телу, деленное на температуру,
называют приведенным количеством
тепла. В цикле Карно приведенное
количество тепла равно нулю. В
предыдущем параграфе мы отмечали, что
любой обратимый цикл можно рассматривать
как сумму элементарных циклов Карно,
следовательно, в любом обратимом цикле
приведенное количество тепла равно
нулю. При элементарном изменении
состояния приведенное количество тепла
выразится формулой:
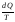 ,
и приведенное количество тепла в
обратимом цикле1
:
,
и приведенное количество тепла в
обратимом цикле1
:
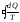 =0
(6.6.1)
=0
(6.6.1)
Полученная
формула показывает, что термодинамическая
система характеризуется некоторой
функцией состояния, изменение которой
равно приведенному количеству тепла.
Эту функцию состояния называют энтропией
и обозначают S. Ее
изменение в элементарном процессе
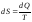 .
При переходе из состояния 1 в состояние
2 изменение энтропии
.
При переходе из состояния 1 в состояние
2 изменение энтропии
S=S2-S1=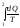 (6.6.2)
(6.6.2)
Найдем формулу энтропии идеального газа. Подставим в формулу (6.6.2) формулу первого начала термодинамики для идеального газа:
S=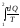 =
=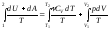 .
Интегрирование с учетом уравнения
состояния идеального газа
.
Интегрирование с учетом уравнения
состояния идеального газа
 дает:
дает:
S=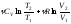 (6.6.3)
(6.6.3)
Из (6.6.3) следует формула энтропии идеального газа:
S=S0
+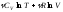 (6.6.4)
(6.6.4)
Здесь S0 – некоторая постоянная.
2. Выясним физический смысл энтропии. На примере идеального газа мы убедились, что энтропия в каждом состоянии тела имеет определенное значение, и, подобно энергии, является функцией состояния. Энергия характеризует способность тела совершать работу и может быть запасена в виде внутренней энергии термодинамической системы. Рассматривая цикл Карно, мы увидели, что внутренняя энергия нагревателя тем эффективнее превращается в работу, чем больше перепад температур нагревателя и холодильника. Если их температуры одинаковы, то КПД равен нулю, и внутренняя энергия не может работать. Напомним, что в равновесной термодинамической системе температура во всех ее областях одинакова. Следовательно, равновесная термодинамическая система может иметь большой запас внутренней энергии, но совершать механическую работу не может. Говорят, что энтропия – мера «обесцененности» внутренней энергии. Знание энтропии позволяет судить о том, можно ли внутреннюю энергию использовать для совершения работы. Мы уже отмечали, что работать может только неравновесная термодинамическая система. Таким образом, энтропия – мера приближения термодинамической системы к равновесию. Термодинамическое равновесие означает полнейшую идентичность друг другу разных участков системы, т.е. ее полную «хаотизацию», следовательно, энтропия – мера «хаотизации». Больцман, используя статистический метод, получил формулу энтропии в виде:
S=к lnW (6.6.5)
к – постоянная Больцмана, W – термодинамическая вероятность состояния системы, она равна числу микросостояний, каким может быть получено данное макросостояние. Поясним смысл этих
понятий на примере газа. Макроскопическое состояние газа определяют его параметры состояния: давление, объем, температура. Микроскопическое состояние определяется состоянием каждой его конкретной молекулы, т.е. ее положением в пространстве и скоростью. При тепловом движении молекул их состояния меняются хаотически, а состояние газа остается неизменным. Для примера рассмотрим сосуд, в котором содержатся 2 молекулы, каждая из которых может находиться в одной из половинок сосуда, т.е. каждая молекула имеет 2 микросостояния. Пронумеруем молекулы и распределим их в сосуде согласно возможностям хаотического движения. На рис. 32 показан сосуд и молекулы в нем в разных микросостояниях. Общее число микросостояний W, соответствующих данному макросостоянию – в сосуде содержится две молекулы - равно 4, т.е. W=22=4. Заметим, что в равновесном состоянии системы, когда молекулы равномерно распределены по объему, W=2, а каждому неравновесному состоянию системы – обе молекулы собрались в правой или в левой половине сосуда – соответствует по одному микросостоянию. Добавляя по одной молекуле в сосуд и увеличивая их число до N, получим: W=2N, причем, равновесному макросостоянию всегда соответствует наибольшее число возможных микросостояний. Мы получили еще один результат: состоянию термодинамического равновесия, когда система, обладая энергией, не может совершать работу, соответствует наибольшая термодинамическая вероятность, а вместе с ней и наибольшая энтропия. В состоянии термодинамического равновесия энтропия максимальна, и максимально «обесценена» внутренняя энергия.