
- •Предмет физики
- •Структура физического познания.
- •Пространственно-временная область изучаемых физикой объектов
- •Физические теории
- •Раздел 1. Физические основы механики.
- •Глава 1. Кинематика.
- •§1.1. Система отсчета. Инерциальные системы отсчета. Принцип относительности.
- •§1.2. Кинематика материальной точки.
- •§1.3. Равномерное и равнопеременное движения.
- •§ 1.4. Кинематика вращательного движения.
- •§ 1.5. Краткие итоги главы 1.
- •Глава 2. Динамика материальной точки.
- •§ 2.1 .Задача динамики. Состояние материальной точки. Динамические характеристики движения.
- •§ 2.2. Законы Ньютона. Второй закон как уравнение движения.
- •§ 2.3. Силы в механике.
- •§ 2.4. Работа силы. Мощность.
- •§ 2.4. Механическая энергия.
- •§ 2.5. Краткие итоги главы 2
- •Глава 3.Законы сохранения в механике.
- •§ 3.1.Фундаментальный характер законов сохранения
- •§ 3.2. Закон сохранения импульса.
- •§ 3.3. Закон сохранения механической энергии
- •§ 3.4. Столкновения тел
- •Глава 4. Динамика вращательного движения.
- •§ 4.1. Кинетическая энергия вращающегося и катящегося тел
- •§ 4.2. Момент инерции
- •§ 4.3. Работа и мощность при вращательном движении. Момент силы относительно оси
- •§ 4.4. Уравнение динамики вращательного движения.
- •§ 4.5. Закон сохранения момента импульса
- •§ 4.6. Краткие итоги главы 4
- •Раздел 2. Молекулярная физика и термодинамика
- •Глава 5. Кинетическая теория
- •§ 5.1. Тепловое движение
- •§ 5.2. Основное уравнение кинетической теории газа
- •§ 5.3. Уравнение Клапейрона – Менделеева
- •§ 5.4. Молекулярно-кинетический смысл абсолютной температуры. Средняя энергия теплового движения молекулы
- •§ 5.5. Распределение Максвелла молекул газа по скоростям
- •§ 5.6. Барометрическая формула. Распределение Больцмана.
- •§ 5.7. Среднее число столкновений и средняя длина свободного пробега молекул.
- •§ 5.8. Выводы из главы 5.
- •Глава 6. Термодинамика.
- •§ 6.1. Тепловые процессы
- •§ 6.2. Первое начало термодинамики.
- •§ 6.3 Изопроцессы.
- •§ 6.4. Тепловая и холодильная машины
- •§ 6.5. Цикл Карно
- •§ 6.6. Энтропия.
- •§ 6.7. Второе начало термодинамики.
- •§ 6.8. Основные выводы главы 6.
- •Раздел 3. Электромагнетизм
- •Глава 7. Электростатика
- •§7.1.Электрический заряд. Закон Кулона.
- •§7.2. Электрическое поле. Напряженность.
- •§ 7.3. Теорема Гаусса.
- •§ 7.4. Потенциал и работа электростатического поля.
- •§ 7.5. Связь напряженности и потенциала электростатического поля.
- •§ 7.6.Электростатическое поле в веществе.
- •§ 7.7. Электроемкость. Конденсатор.
- •§ 7.8. Энергия электрического поля.
- •Глава 8. Постоянный электрический ток.
- •§ 8.1. Электрический ток: сила тока, плотность тока
- •§ 8.2. Механизм электропроводности
- •§ 8.3. Законы постоянного тока.
- •§ 8.4. Работа и мощность тока
- •Глава 9. Магнитное поле тока
- •§ 9.1 Магнитное взаимодействие. Магнитное поле
- •§ 9.2. Закон Био-Савара-Лапласа
- •9.3. Вихревой характер магнитного поля.
- •§ 9.4. Действие магнитного поля на токи и движущиеся электрические заряды
- •§ 9.5. Магнитное поле в веществе
- •Глава 10. Явление электромагнитной индукции
- •§ 10.1. Основной закон электромагнитной индукции
- •§ 10.2. Самоиндукция и взаимная индукция
- •§ 10.3. Энергия магнитного поля
- •§ 10.4. Вихревое электрическое поле. Уравнения Максвелла
§ 5.8. Выводы из главы 5.
В газе, находящемся в состоянии термодинамического равновесия, молекулы движутся хаотически, состояния отдельных молекул изменяются случайным образом. Однако эти случайности подчиняются определенным статистическим закономерностям, которые проявляются в характеристиках состояния всей системы. Давление и температура газа, наиболее вероятная скорость теплового движения молекул, их средняя длина свободного пробега есть интегральные характеристики всей термодинамической системы, а не отдельной частицы.
Глава 6. Термодинамика.
§ 6.1. Тепловые процессы
1. Состояние термодинамической системы (тела) изменяется при изменении внешних условий. Если после изменения внешних условий тело снова окажется термодинамически изолированным, то в нем установится новое состояние теплового равновесия. Каждому такому состоянию соответствуют свои макроскопические параметры состояния, задаваемые соответствующими особенностями теплового движения. Для идеального газа эти параметры p,V,T связаны уравнением состояния Менделеева – Клапейрона. Всякое изменение параметров состояния тела (или некоторых из них) называется термодинамическим или тепловым процессом. Законы тепловых процессов изучает термодинамика.
2. Различают равновесные и неравновесные тепловые процессы. Равновесный процесс предполагает, что при незначительном изменении внешних условий в теле успевает установиться равновесное состояние прежде, чем опять произойдет изменение внешних условий. Равновесный процесс состоит из последовательности равновесных состояний тела, т.е. в каждый момент времени состояние тела можно с требуемой точностью считать равновесным. На термодинамических диаграммах1 равновесное состояние газа изображается точкой, а равновесный процесс - линией. Точки этой линии соответствуют промежуточным состояниям тела. Важнейшим свойством равновесных процессов является их обратимость. Обратимым называется процесс, который можно провести в обратном направлении через те же промежуточные состояния, при этом после возвращения в исходное состояние ни в теле, ни в окружающих его телах никаких изменений не останется.
Если внешние условия изменяются так быстро, что тепловое движение в системе не успевает привести ее в равновесные промежуточные состояния, то процесс называется неравновесным. Такой процесс является необратимым и его нельзя изобразить графически.
Опыт показывает, что многие практически важные процессы, используемые технической термодинамикой в тепловых и холодильных машинах, можно с достаточной точностью считать равновесными. Далее мы рассмотрим законы равновесной термодинамики.
§ 6.2. Первое начало термодинамики.
1. Внутренняя энергия U
термодинамической системы (тела)
складывается из кинетической энергии
теплового движения его частиц,
потенциальной энергии их взаимодействия
друг с другом и собственной внутренней
энергии частиц, имеющих определенное
внутреннее строение. В модели идеального
газа потенциальная энергия взаимодействия
молекул пренебрежимо мала. Молекулы
рассматриваются как м.т. или как их
жесткие системы, так что собственная
внутренняя энергия молекул не изменяется,
и ее можно считать равной нулю. Внутренняя
энергия идеального газа равна сумме
кинетических энергий хаотического
движения его молекул. Учитывая, что
средняя энергия теплового движения
молекулы пропорциональна температуре
(формула 5.4.3), вычислим внутреннюю
энергию идеального газа, состоящего
из N частиц: U=N<E>=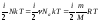 .
Итак, внутренняя энергия идеального
газа выражается формулой:
.
Итак, внутренняя энергия идеального
газа выражается формулой:
U=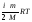 (6.2.1)
(6.2.1)
Отметим, это внутренняя энергия идеального газа определяется только температурой. В каждом состоянии она имеет определенное значение, не зависящее от того, каким путем и из какого предыдущего состояния газ перешел в данное состояние. Такие характеристики состояния в физике называют функциями состояния. Отметим, что функциями состояния являются кинетическая и потенциальная энергии, рассмотренные в механике. Для функции состояния характерно, что ее изменение не зависит от процесса перехода из начального состояния 1 в конечное состояние 2 и равно разности ее значений в конечном и начальном состояниях:
U=U2 –U1 (6.2.2)
2. При изменении состояния газа изменяются
его параметры состояния: p,V,T
(или некоторые из них). Объем газа
задается положением внешних тел (объемом
сосуда). На рис. 25 изображен сосуд с
газом, закрытый подвижным поршнем
площадью S. На поршень
действует сила давления F=pS,
под действием которой поршень перемещается
из положения 1 в положение 2 на малое
расстояние dl.
При этом объем газа увеличивается на
dV=Sdl
(на рисунке он заштрихован), а сила
давления совершает элементарную работу
dA=FdS=pdV.
Работа газа при изменении его объема
от V1 до
V2 равна:
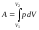 (6.2.3)
(6.2.3)
При увеличении объема работа газа положительная, при уменьшении – отрицательная. Напомним, что графически работа выражается площадью под графиком процесса на pV – диаграмме.
Для совершения работы всегда требуется источник энергии, в частности, для совершения работы газ может использовать свою внутреннюю энергию: dA= - dU.
3. Пусть газ нагревается без изменения объема, т.е. механическая работа не происходит. В этом случае внутренняя энергия газа увеличивается за счет сообщения ему от внешних более нагретых тел количества тепла Q. Напомним, что средняя кинетическая энергия теплового движения молекул пропорциональна температуре. Более «горячие» молекулы внешних тел, сталкиваясь снаружи со стенками сосуда, передают через стенки более «холодным» молекулам газа дополнительную кинетическую энергию, в результате увеличивается внутренняя энергия и температура газа в сосуде. С микроскопической точки зрения процесс передачи тепла представляет собой работу по ускорению «медленных» молекул при их столкновении с «быстрыми». Этот процесс является статистическим, усредненным по всей совокупности частиц системы. Количество тепла dQ, переданное газу при элементарном процессе, алгебраическая величина: dQ>0, если оно передано извне газу, dQ<0, если оно забрано у газа. Таким образом, dU= dQ.
4. В общем случае изменение внутренней энергии газа может происходить одновременно путем совершения работы и передачи ему тепла: dU=dQ-dA. Закон сохранения энергии, учитывающий особую форму ее передачи в виде тепла, называется первым началом (законом) термодинамики. Его формулу для бесконечно малого изменения состояния тела называют первым началом термодинамики в дифференциальной форме и записывают так:
dQ=dU+dA (6.2.4)
Первый закон термодинамики в интегральной форме имеет вид: количество тепла, переданное телу, идет на изменение его внутренней энергии и на совершение механической работы против внешних сил. Его формула:
Q=U+A (6.2.5)
Количество тепла, энергия, работа измеряются в одних и тех же единицах (в СИ это джоуль) и могут превращаться друг в друга. С точки зрения физической сути между ними существует принципиальное различие. Энергия является функцией состояния системы, тело обладает запасом энергии. Количество тепла и работа не есть функции состояния, они есть характеристики процесса. О количестве тепла и о работе можно говорить только при изменении состояния тела, применительно к ним понятие «запаса» лишено физического смысла. Количество тепла и работа есть формы изменения энергии тела. При переходе тела из одного состояния в другое его энергия изменяется одинаково при любых процессах, связывающих эти состояния, тогда как работа и количество тепла в разных процессах могут быть разными. Это отличие физического смысла отражается в формулах первого начала термодинамики: в его интегральной форме U означает изменение (приращение) внутренней энергии, в дифференциальной форме dU-дифференциал (приращение), dQ и dA-бесконечно малые величины, а не их приращения (дифференциалы). Чтобы подчеркнуть это смысловое различие с точки зрения математики, иногда пишут Q, A, но dU.
Первое начало термодинамики есть закон сохранения энергии, он является фундаментальным законом природы. Его областью применения являются все тепловые процессы, происходящие в газах, жидкостях, твердых телах. Действие этого закона сопровождает нас постоянно. Например, поставим чайник на плитку. Тепло идет на нагревание воды и окружающих тел, соответственно, на увеличение их внутренней энергии. Если своевременно не снять чайник, то при кипении пар поднимает крышку, и теперь тепло идет и на совершение механической работы.
