
- •Предмет физики
- •Структура физического познания.
- •Пространственно-временная область изучаемых физикой объектов
- •Физические теории
- •Раздел 1. Физические основы механики.
- •Глава 1. Кинематика.
- •§1.1. Система отсчета. Инерциальные системы отсчета. Принцип относительности.
- •§1.2. Кинематика материальной точки.
- •§1.3. Равномерное и равнопеременное движения.
- •§ 1.4. Кинематика вращательного движения.
- •§ 1.5. Краткие итоги главы 1.
- •Глава 2. Динамика материальной точки.
- •§ 2.1 .Задача динамики. Состояние материальной точки. Динамические характеристики движения.
- •§ 2.2. Законы Ньютона. Второй закон как уравнение движения.
- •§ 2.3. Силы в механике.
- •§ 2.4. Работа силы. Мощность.
- •§ 2.4. Механическая энергия.
- •§ 2.5. Краткие итоги главы 2
- •Глава 3.Законы сохранения в механике.
- •§ 3.1.Фундаментальный характер законов сохранения
- •§ 3.2. Закон сохранения импульса.
- •§ 3.3. Закон сохранения механической энергии
- •§ 3.4. Столкновения тел
- •Глава 4. Динамика вращательного движения.
- •§ 4.1. Кинетическая энергия вращающегося и катящегося тел
- •§ 4.2. Момент инерции
- •§ 4.3. Работа и мощность при вращательном движении. Момент силы относительно оси
- •§ 4.4. Уравнение динамики вращательного движения.
- •§ 4.5. Закон сохранения момента импульса
- •§ 4.6. Краткие итоги главы 4
- •Раздел 2. Молекулярная физика и термодинамика
- •Глава 5. Кинетическая теория
- •§ 5.1. Тепловое движение
- •§ 5.2. Основное уравнение кинетической теории газа
- •§ 5.3. Уравнение Клапейрона – Менделеева
- •§ 5.4. Молекулярно-кинетический смысл абсолютной температуры. Средняя энергия теплового движения молекулы
- •§ 5.5. Распределение Максвелла молекул газа по скоростям
- •§ 5.6. Барометрическая формула. Распределение Больцмана.
- •§ 5.7. Среднее число столкновений и средняя длина свободного пробега молекул.
- •§ 5.8. Выводы из главы 5.
- •Глава 6. Термодинамика.
- •§ 6.1. Тепловые процессы
- •§ 6.2. Первое начало термодинамики.
- •§ 6.3 Изопроцессы.
- •§ 6.4. Тепловая и холодильная машины
- •§ 6.5. Цикл Карно
- •§ 6.6. Энтропия.
- •§ 6.7. Второе начало термодинамики.
- •§ 6.8. Основные выводы главы 6.
- •Раздел 3. Электромагнетизм
- •Глава 7. Электростатика
- •§7.1.Электрический заряд. Закон Кулона.
- •§7.2. Электрическое поле. Напряженность.
- •§ 7.3. Теорема Гаусса.
- •§ 7.4. Потенциал и работа электростатического поля.
- •§ 7.5. Связь напряженности и потенциала электростатического поля.
- •§ 7.6.Электростатическое поле в веществе.
- •§ 7.7. Электроемкость. Конденсатор.
- •§ 7.8. Энергия электрического поля.
- •Глава 8. Постоянный электрический ток.
- •§ 8.1. Электрический ток: сила тока, плотность тока
- •§ 8.2. Механизм электропроводности
- •§ 8.3. Законы постоянного тока.
- •§ 8.4. Работа и мощность тока
- •Глава 9. Магнитное поле тока
- •§ 9.1 Магнитное взаимодействие. Магнитное поле
- •§ 9.2. Закон Био-Савара-Лапласа
- •9.3. Вихревой характер магнитного поля.
- •§ 9.4. Действие магнитного поля на токи и движущиеся электрические заряды
- •§ 9.5. Магнитное поле в веществе
- •Глава 10. Явление электромагнитной индукции
- •§ 10.1. Основной закон электромагнитной индукции
- •§ 10.2. Самоиндукция и взаимная индукция
- •§ 10.3. Энергия магнитного поля
- •§ 10.4. Вихревое электрическое поле. Уравнения Максвелла
§ 5.5. Распределение Максвелла молекул газа по скоростям
1. Тепловое движение молекул приводит к установлению равновесного состояния изолированной термодинамической системы, а это означает, что в хаосе есть определенная закономерность. Поясним это на следующем примере. Будем ежедневно в течение 40 минут наблюдать приход сотрудников и студентов к началу рабочего дня, считая, сколько человек приходят ежеминутно. Мы увидим, что по мере приближения звонка поток вначале нарастает, достигает максимума, и начинает снижаться в последние перед звонком минуты. Время прихода конкретных людей, особенно тех, кто вынужден пользоваться транспортом, день ото дня может изменяться случайным образом, тогда как общая закономерность зависимости потока людей от оставшегося до звонка времени сохраняется.
Обратимся к тепловому движению молекул
газа в равновесном состоянии. Предположим,
что в каждый момент времени мы знаем
величины скоростей всех N
молекул. Весь диапазон значений скоростей
разделим на равные промежутки шириной
υ,
посчитаем для каждого промежутка число
молекул N,
чья скорость попала в этот промежуток,
и найдем долю этих молекул:
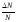 .
В следующий момент времени хаотическое
движение может переместить любую
конкретную молекулу в другой промежуток
скоростей, однако доля молекул в каждом
из рассматриваемых промежутков
практически не изменится: на место
ушедшей приходит другая. При тепловом
движении молекулы просто обмениваются
местами в ряду скоростей, а число мест
в каждом конкретном промежутке скоростей
сохраняется. Доля, или частота определенных
случайных событий, характеризует их
вероятность. По определению вероятность
есть
.
В следующий момент времени хаотическое
движение может переместить любую
конкретную молекулу в другой промежуток
скоростей, однако доля молекул в каждом
из рассматриваемых промежутков
практически не изменится: на место
ушедшей приходит другая. При тепловом
движении молекулы просто обмениваются
местами в ряду скоростей, а число мест
в каждом конкретном промежутке скоростей
сохраняется. Доля, или частота определенных
случайных событий, характеризует их
вероятность. По определению вероятность
есть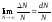 1.
Функция f(υ)=
1.
Функция f(υ)=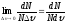 называется плотностью вероятности.
Она показывает вероятность того, что,
измерив в данный момент времени скорость
выбранной наугад молекулы газа, получим
значение υ. Наши рассуждения
свидетельствуют, что скорости молекул
изменяются хаотически, а вероятность
того, что в любой момент времени скорость
случайным образом выбранной молекулы
окажется равной конкретной величине
υ, имеет свое неизменное значение.
Действительно, в хаосе действует
определенная статистическая
закономерность. Эта теоретическая
закономерность была получена Максвеллом
и называется распределением молекул
газа по скоростям. Она выражается
формулой:
называется плотностью вероятности.
Она показывает вероятность того, что,
измерив в данный момент времени скорость
выбранной наугад молекулы газа, получим
значение υ. Наши рассуждения
свидетельствуют, что скорости молекул
изменяются хаотически, а вероятность
того, что в любой момент времени скорость
случайным образом выбранной молекулы
окажется равной конкретной величине
υ, имеет свое неизменное значение.
Действительно, в хаосе действует
определенная статистическая
закономерность. Эта теоретическая
закономерность была получена Максвеллом
и называется распределением молекул
газа по скоростям. Она выражается
формулой:
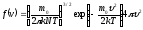 (5.5.1)
(5.5.1)
Формула (5.5.1) содержит два сомножителя, зависящих от величины скорости. Первый сомножитель – квадратичная функция (парабола) растет с увеличением скорости, второй – экспоненциальная с отрицательным показателем степени, наоборот, уменьшается. При υ=0 е0=1, и для очень малых скоростей величина второго сомножителя мало отличается от 1, так что f(υ)υ2. В итоге функция распределения вначале растет при возрастании скорости от нулевого значения. Для больших скоростей (υ , e-0) рост параболы не может противостоять резкому спаду экспоненты, и f(υ) 0. Следовательно, при некотором значении скорости функция распределения достигает максимума. Это значение скорости υвер называется наиболее вероятным, ему соответствует максимум вероятности. А это значит, что чаще всего нам будут попадаться молекулы, скорости которых близки к наиболее вероятной. Исследовав функцию распределения (5.5.1) на максимум, получим формулу:
υвер=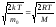 (5.5.2)
(5.5.2)
Это же
распределение позволяет вычислить
среднюю арифметическую <υ> и
среднюю квадратичную скорости молекул
υкв по формулам1:
<υ>=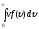 и υкв=
и υкв=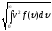 . В результате
. В результате
<υ>=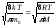 (5.5.3)
(5.5.3)
υкв=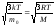
 (5.5.4)
(5.5.4)
Обратите внимание, что средняя квадратичная скорость, рассмотренная нами ранее в § 5.2, выражается формулой, совпадающей с (5.5.4)2. Напомним обозначения величин: m0-масса молекулы, M-молярная масса, k-постоянная Больцмана, R-универсальная газовая постоянная, T-абсолютная температура.
2. На рис. 22 представлено распределение
Максвелла молекул газа по скоростям
для двух разных значений температуры,
причем, Т1< Т2 .На
вертикальной оси отложена функция
распределения f(υ)=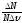 (вспомните ее физический смысл). Доля
заштрихованной площади под каждым
графиком на этом рисунке равна доле
числа молекул газа, скорости которых
в данный момент времени имеют значения
от υ
до υ+υ
при данной температуре Т
:
(вспомните ее физический смысл). Доля
заштрихованной площади под каждым
графиком на этом рисунке равна доле
числа молекул газа, скорости которых
в данный момент времени имеют значения
от υ
до υ+υ
при данной температуре Т
:
 (вспомните геометрический смысл
определенного интеграла). Физически
это означает, что при более высокой
температуре молекулы начинают двигаться
быстрее, и доля числа молекул в том же
самом промежутке скоростей уменьшается.
Общая площадь под кривой распределения
всегда равна 1: действительно,
(вспомните геометрический смысл
определенного интеграла). Физически
это означает, что при более высокой
температуре молекулы начинают двигаться
быстрее, и доля числа молекул в том же
самом промежутке скоростей уменьшается.
Общая площадь под кривой распределения
всегда равна 1: действительно,
 .
Характерные скорости теплового движения
υвер (на графике она
обозначена v0),
<υ>, υкв пропорциональны
.
Характерные скорости теплового движения
υвер (на графике она
обозначена v0),
<υ>, υкв пропорциональны
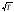 .
Эти закономерности отражены на графиках.
Площади под ними одинаковые, тогда как
график для более высокой температуры
ниже и шире, его максимум смещен вправо
по сравнению с графиком для температуры
пониже.
.
Эти закономерности отражены на графиках.
Площади под ними одинаковые, тогда как
график для более высокой температуры
ниже и шире, его максимум смещен вправо
по сравнению с графиком для температуры
пониже.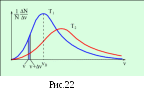
3. Еще раз отметим, что распределение Максвелла выполняется для равновесного состояния газа и есть отражение статистической закономерности в молекулярном хаосе, каким является тепловое движение. Каким бы ни было исходное распределение молекул газа по скоростям, при наступлении равновесия оно станет максвелловским. Например, будем заполнять сосуд газом, впуская туда через маленькое отверстие молекулы поодиночке. Пусть все молекулы влетают с одинаковыми по величине и по направлению скоростями. Заполним сосуд, закроем его и оставим при неизменных внешних условиях. Исходное неравновесное состояние будет «забыто» газом, наступит равновесие, молекулы будут двигаться хаотически, их скорости при столкновениях будут изменяться случайным образом, но в соответствии с распределением Максвелла.
