
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
Глава 4. Закономерности протекания химических реакций
§ 4.1. Задачи с решениями
Задача 47. При сгорании одного моля ацетилена в кислороде выделилось 1300 кДж теплоты. Определите теплоту образования ацетилена, если стандартные теплоты образования CO2(г) и H2O(ж) равны 393,5 кДж/моль и 286 кДж/моль.
Перед решением термохимических задач необходимо повторить материал по химической энергетике.
Напомним, что по признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические. Количество выделенной или поглощенной теплоты называют тепловым эффектом химической реакции.
Термохимические данные обычно выражают с помощью уравнения химической реакции, для которого приводят значения H — разности энтальпий продуктов реакции и исходных веществ.
Энтальпия H — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
Процессы, протекающие при постоянном давлении, встречаются в химии гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или, соответственно, увеличения) энтальпии реакции, H.
Таким образом, при экзотермических реакциях, когда тепло выделяется, H отрицательно. При эндотермических реакциях (тепло поглощается) H положительно.
Заметим, что наряду с энтальпией используют равную по абсолютной величине и противоположную по знаку величину, например:
H2 + Cl2 = 2HCl + Q ,
где Q — количество выделенной теплоты. Если использовать энтальпию (характеристику энергосодержания системы), то это уравнение следует записать иначе:
H2 + Cl2 = 2HCl , H < 0 (Q = – H)
В задаче требуется определить теплоты образования ацетилена. Напомним, что теплотой образования соединения называется количество теплоты, которое выделяется или поглощается при образовании одного моля химического соединения из простых веществ при стандартных условиях (p = 101,3 Па, T = 298 K). Она измеряется в кДж/моль.
Изменение энтальпии H зависит от давления и температуры. Поэтому для того, чтобы облегчить сравнение термохимических данных для различных реакций, были приняты определенные стандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газ обязательно обозначаются символами (тв), (ж) и (г), соответственно, поскольку изменение энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции. Стандартное состояние: для газа — состояние чистого газа при 101,3 Па; для жидкости — состояние чистой жидкости при 101,3 Па; для твердого вещества — наиболее устойчивое при давлении 101,3 Па кристаллическое состояние, например, графит у углерода, ромбическая сера у серы и т.п. Стандартное состояние всегда относится к 298 К.
Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов):
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Особенно удобно проводить такие расчеты, пользуясь следующим общим положением, непосредственно вытекающим из закона Гесса: тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т.е. стехиометрических коэффициентов в уравнении протекающей реакции):
![]() .
.
Здесь Qi и Qj — теплоты образования продуктов реакции и исходных веществ, соответственно; ni и nj — стехиометрические коэффициенты в правой и левой частях термохимического уравнения, соответственно.
Аналогичным образом можно записать:
![]() ,
,
где H — изменение энтальпии соответствующей реакции, Hi и Hj — энтальпии образования продуктов реакции и исходных веществ, соответственно.
Решение. Из условия задачи следует, что изменение энтальпии H в реакции сгорания ацетилена равно 1300 кДж/моль. Рассчитываем теплоту образования ацетилена по уравнению:
C2H2(г) + 5/2 O2(г) = 2CO2(г) + H2O(ж) + 1300 Кдж.
Отсюда можно записать:
H = –1300 кДж = 2Hобр(CO2) + Hобр(H2O) –
– Hобр(C2H2) – 5/2Hобр(O2).
Отсюда находим:
Hобр(C2H2) = 227 кДж/моль .
Ответ: теплота образования C2H2 равна –227 кДж/моль.
Задача 48. При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
Решение. Реакция сгорания моля черного фосфора имеет вид:
P(ч) + 5/4O2 = 1/2P2O5 + 722,1 кДж/моль.
Этот же процесс можно провести в две стадии: сначала превратить моль черного фосфора в моль белого:
P(ч) = P(б) + Q,
а затем — сжечь белый фосфор:
P(б) + 5/4O2 = 1/2P2O5 + 760,1 кДж/моль.
По закону Гесса,
722,1 = Q + 760,1,
откуда Q = –38 кДж/моль.
Ответ: –38 кДж/моль.
Задача 49. При сжигании этановой кислоты в кислороде выделилось 235,9 кДж теплоты, и осталось 10,0 л непрореагировавшего кислорода (измерено при давлении 104,1 кПа и температуре 40 C). Рассчитайте массовые доли компонентов в исходной смеси, если известно, что теплоты образования оксида углерода (IV), паров воды и этановой кислоты составляют 393,5 кДж/моль, 241,8 кДж/моль и 484,2 кДж/моль, соответственно.
Решение. Этановая (уксусная) кислота сгорает по уравнению
CH3COOH + 2O2 = 2CO2 + 2H2O + Q.
По закону Гесса,
Q = 2Qобр(CO2) + 2Qобр(H2O) Qобр(CH3COOH) = 2393,5 + +2241,8 484,2 = 786,4 кДж/моль.
При сгорании одного моля уксусной кислоты выделяется 786,4 кДж, а по условию выделилось 235,9 кДж, следовательно, в реакцию вступило 235,9/786,4 = 0,3 моль уксусной кислоты. Таким образом, 0,3 моль CH3COOH реагируют с 0,6 моль O2, и в избытке остается = PV / RT = 104,110,0 / (8,31313) = 0,4 моль O2. В исходной смеси содержалось 0,3 моль CH3COOH (массой 0,360=18 г) и 1 моль O2 (массой 32 г). Массовые доли веществ в исходной смеси равны:
(CH3COOH) = 18 / (18+32) = 0,36, или 36%,
(O2) = 32 / (18+32) = 0,64, или 64%.
Ответ: 36% CH3COOH, 64% O2.
Задача 50. Как изменится скорость элементарной реакции X2 + 2Y2 2XY2, протекающей в газовой фазе в закрытом сосуде, если увеличить давление в 6 раз?
Решение. По закону действующих масс, скорость элементарной гомогенной химической реакции пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Увеличивать концентрации реагирующих веществ можно за счет повышения давления в сосуде.
Обозначим начальные концентрации молекул X2 и Y2 через a и b, соответственно: [X2] = a, [Y2] = b. Скорость реакции равна:
v1 = k[X2][Y2]2 = kab2.
При увеличении давления в 6 раз концентрация каждого из веществ также увеличивается в 6 раз. В этом случае:
v2 = k(6a)(6b)2 = 216kab2 = 216v1 .
Ответ: Скорость реакции возрастет в 216 раз.
Задача 51. Растворение образца цинка в соляной кислоте при 20 C заканчивается через 27 минут, а при 40 C такой же образец металла растворяется за 3 минуты. За какое время данный образец цинка растворится при 55 C?
Решение. Растворение цинка в соляной кислоте описывается уравнением:
Zn + 2HCl = ZnCl2 + H2.
Поскольку во всех трех случаях растворяется одинаковое количество образца, то можно считать, что средняя скорость реакции обратно пропорциональна времени реакции. Следовательно, при нагревании от 20 C до 40 C скорость реакции увеличивается в 27/3 = 9 раз. Это означает, что коэффициент в уравнении Вант-Гоффа
![]() ,
,
который показывает, во сколько раз увеличивается скорость реакции V при увеличении температуры T на 10, равен = 3. Значит, при нагревании до 55 C скорость реакции увеличится в 3(55–40)/10 = 5,2 раза, а время реакции составит 3/5,2 = 0,577 мин, или 34,6 с.
Ответ. 34,6 с.
Задача 52. Энергия активации некоторой реакции в отсутствие катализатора равна 76 кДж/моль, а в присутствии катализатора энергия активации уменьшается до значения 50 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 27 С?
Решение.
Обозначим энергию активации реакции
без катализатора через ЕА,
а в присутствии катализатора — через
![]() .
Соответствующие константы скорости
реакции обозначим через k
и k’
и запишем соответствующие уравнения
Аррениуса:
.
Соответствующие константы скорости
реакции обозначим через k
и k’
и запишем соответствующие уравнения
Аррениуса:
![]()
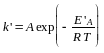 .
.
Поделим второе уравнение на первое:
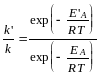 .
.
Логарифмируя, получаем:
![]()
отсюда
![]() =3,4104.
=3,4104.
Ответ: Добавление катализатора увеличило скорость реакции в 34 тысячи раз.
Задача 53. Как будет влиять увеличение температуры и давления на состояние равновесия в следующих реакциях: а) CO2 + C(тв) <==> 2CO – Q; б) H2 + I2 <==> 2HI – Q ?
Решение. а) Прямая реакция идет с поглощением тепла, поэтому нагревание способствует прямой реакции, и равновесие сместится в сторону продуктов. В ходе прямой реакции увеличивается число молекул в газовой фазе, поэтому давление способствует обратной реакции, и равновесие смещается в сторону исходных веществ.
б) При нагревании равновесие сместится в сторону продуктов. Давление не влияет на положение равновесия, т.к. в ходе реакции число молекул в газовой фазе не изменяется.
Задача 54. Обратимая реакция описывается уравнением: A + B <==> C + D. Смешали по одному молю всех веществ. После установления равновесия в смеси обнаружено 1,5 моль вещества C. Найдите константу равновесия.
Решение. В ходе реакции
A + B <==> C + D
образовалось 1,5 – 1 = 0,5 моль вещества C, следовательно в реакцию вступило по 0,5 моль A и B, и образовалось 0,5 моль D. Количества веществ в смеси после установления равновесия равны: (A) = 1–0,5 = 0,5, (B) = 1–0,5 = 0,5, (C) = 1,5, (D) = 1+0,5 = 1,5 моль.
Константа равновесия равна:
![]() .
.
Ответ. K = 9.
Задача 55. Один моль смеси пропена с водородом, имеющей плотность по водороду 15, нагрели в замкнутом сосуде с платиновым катализатором при 320 С, при этом давление в сосуде уменьшилось на 25%. Рассчитайте выход реакции в % от теоретического. На сколько процентов уменьшится давление в сосуде, если для проведения эксперимента в тех же условиях использовать 1 моль смеси тех же газов, имеющей плотность по водороду 16?
Решение. C3H6 + H2 <==> C3H8.
Пусть (C3H6) = x, (H2) = 1–x, тогда масса смеси равна
42x + 2(1–x) = 215 = 30, откуда x = 0,7, т.е. (C3H6) = 0,7, (H2) = 0,3.
Давление уменьшилось на 25% при неизменных температуре и объеме за счет уменьшения на 25% числа молей в результате реакции. Пусть y моль H2 вступило в реакцию, тогда после реакции осталось: (C3H6) = 0,7–y, (H2) = 0,3–y, (C3H8) = y, общ = 0.75 = (0,7–y) + (0,3–y) + y, откуда y = 0,25. Теоретически могло образоваться 0,3 моль C3H8 (H2 — в недостатке), поэтому выход равен 0,25 / 0,3 = 0,833 = 83,3%.
Константа равновесия при данных условиях равна:
![]() .
.
2) Пусть во втором случае (C3H6) = a, (H2) = 1–a, тогда масса смеси равна 42a + 2(1–a) = 216 = 32, откуда a = 0,75, т.е. (C3H6) = 0,75, (H2) = 0,25. Пусть в реакцию вступило b моль H2. Это число можно найти из условия неизменности константы равновесия:
![]() .
.
Из двух корней данного квадратного уравнения выбираем корень, удовлетворяющий условию: 0 < b < 0,25, т.е. b = 0,214.
Общее число молей после реакции равно общ = (0,75–0,214) + (0,25–0,214) + 0,214 = 0,786, т.е. оно уменьшилось на 21,4% по сравнению с исходным количеством (1 моль). Давление пропорционально числу молей, поэтому оно также уменьшилось на 21,4%.
Ответ. Выход C3H8 — 83,3%. Давление уменьшится на 21,4%.
Задача 56. Пары этаналя смешали с водородом в молярном отношении 1:2 при давлении 300 кПа и температуре 400 C в замкнутом реакторе, предназначенном для синтеза этанола. После окончания процесса давление газов в реакторе при неизменной температуре уменьшилось на 20%. Определите объемную долю паров этанола в реакционной смеси и процент превращения уксусного альдегида в этанол.
Решение. При гидрировании этаналя образуется этанол:
CH3CHO + H2 <==> C2H5OH.
Пусть в исходной смеси содержалось x моль этаналя, (CH3CHO) = x, тогда, по условию, (H2) = 2x. Общее число молей газов равно 1 = 3x.
Реакция этаналя с водородом обратима. Пусть в эту реакцию вступает y моль CH3CHO, тогда водорода расходуется также y моль, и образуется y моль C2H5OH. В конечной смеси содержатся: (CH3CHO) = x–y, (H2) = 2x–y, (C2H5OH) = y. Общее число молей газов равно 2 = (x–y)+(2x–y)+y = 3x–y.
По условию, давление в конечной смеси уменьшилось на 20% по сравнению с исходным. Поскольку температура в процессе реакции не изменяется, и объем реактора постоянен, то уменьшение давление вызвано только уменьшением числа молей газов. Таким образом, 2 = 0,81, или 3x–y = 0,83x, то есть y = 0,6x.
По закону Авогадро, объемная доля газа равна его мольной доле, поэтому объемная доля паров этанола равна: (C2H5OH) = y/(3xy) = 0,25, или 25%.
Процент превращения уксусного альдегида в этанол (т.е., практический выход этанола) равен y/x = 0,6, или 60%.
Ответ. 25% C2H5OH, процент превращения CH3CHO — 60%.
