
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
Для решения задач этого раздела необходимо знать основные вещества — окислители и восстановители, уметь использовать методы электронного или электронно-ионного балансов для подбора коэффициентов в уравнениях окислительно-восстановительных реакций. Нужно хорошо понимать ряд стандартных электродных потенциалов (ряд напряжений) и знать законы электролиза Фарадея.
§ 6.1. Задачи с решениями
Задача 69. Приведите определение окислительно-восстановительной реакции (ОВР), отметьте ее главные признаки.
Решение. Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Следовательно, главным признаком любой ОВР оказывается изменяющаяся степень окисления любого из элементов, входящего в состав реагирующих веществ.
Задача 70. Приведите определение степени окисления и сформулируйте основные правила, которыми руководствуются при вычислении степени окисления элементов в химическом соединении.
Решение. Степень окисления условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
Это означает, что более электроотрицательный атом, смещая к себе полностью одну электронную пару, приобретает заряд 1. Неполярная ковалентная связь между одинаковыми атомами не дает вклада в степень окисления.
При пользовании степенями окисления полезно придерживаться следующих правил:
1) сумма степеней окисления атомов в любой частице равна ее электрическому заряду. Следовательно, степень окисления элемента в его простом веществе равна нулю;
2) в соединениях фтор всегда проявляет степень окисления 1;
3) степень окисления кислорода в соединениях обычно равна 2 (кроме OF2, H2O2 и др.);
4) степень окисления водорода равна +1 в соединениях с неметаллами и 1 в соединениях с металлами (KH, CaH2).
Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Исключение составляют фтор, кислород, железо: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Понятие степени окисления введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому следует помнить, что в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.
Совсем формальным понятие степени окисления становится, когда оно используется при рассмотрении ковалентного соединения.
Различие между понятием степени окисления и валентности в ковалентных соединениях наглядно можно проиллюстрировать на хлорпроизводных метана: валентность углерода везде равна четырем, а степень окисления его (считая степени окисления водорода +1 и хлора 1 во всех соединениях) в каждом соединении разная:
–4 –2 0 +2 +4
CH4, CH3Cl, CH2Cl2, CHCl3, CCl4.
Таким образом, степень окисления условное, формальное понятие и чаще всего не характеризует реальное валентное состояние атома в молекуле. Однако это понятие чрезвычайно полезно при описании окислительно-восстановительных реакций.
Задача 71. Дайте определения следующим понятиям: окисление, восстановление, окислитель, восстановитель.
Решение. Окисление это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд, например:
Zn0 – 2e = Zn2+.
Если отрицательно заряженный ион (заряд –1), например Cl–, отдает один электрон, то он становится нейтральным атомом:
Cl– – 1e = Cl0.
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ – e = Fe3+,
S+4 – 2e = S+6,
Mn2+ – 4e = Mn+6.
Восстановление это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0 + 2e = S2–,
Br0 + e = Br–.
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например:
Mn+7 + 5e = Mn2+ ,
S+6 + 2e = S+4
или он может перейти в нейтральный атом:
H+ + e = H0,
Al3+ +3e = Al0 .
Окислителем является атом, молекула или ион, принимающий электроны.
Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, а восстановитель окисляется.
Задача 72. Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте схемы электронного и электронно-ионного баланса.
Решение. HNO3 — сильный окислитель, поэтому сера будет окисляться до максимальной степени окисления S+6, а железо — до Fe+3, при этом HNO3 может восстанавливаться до NO или NO2. Рассмотрим случай восстановления до NO2.
FeS2 + HNO3(конц) Fe(NO3)3 + H2SO4 + NO2 .
Где будет находиться H2O (в левой или правой части), пока неизвестно.
Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается схемой:
N+5 + e N+4.
В полуреакцию окисления вступают сразу два элемента — Fe и S. Железо в дисульфиде имеет степень окисления +2, а сера –1. Необходимо учесть, что на один атом Fe приходится два атома S:
Fe+2 – e Fe+3
2S– – 14e 2S+6.
Вместе железо и сера отдают 15 электронов. Полный баланс имеет вид:
 15 N+5
+ e
N+4
15 N+5
+ e
N+4
1 Fe+2 – e Fe+3
1 2S– – 14e 2S+6
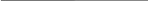
Fe+2 + 2S– + 15N+5 = Fe+3 + 2S+6 + 15N+4.
15 молекул HNO3 идут на окисление FeS2, и еще 3 молекулы HNO3 необходимы для образования Fe(NO3)3:
FeS2 + 18HNO3 Fe(NO3)3 + 2H2SO4 + 15NO2 .
Чтобы уравнять водород и кислород, в правую часть надо добавить 7 молекул H2O:
FeS2 + 18HNO3(конц) = Fe(NO3)3 + 2H2SO4 + 15NO2 + 7H2O.
Используем теперь метод электронно-ионного баланса. Рассмотрим полуреакцию окисления. Молекула FeS2 превращается в ион Fe3+ (Fe(NO3)3 полностью диссоциирует на ионы) и два иона SO42– (диссоциация H2SO4):
FeS2 Fe3+ + 2SO42–.
Для того, чтобы уравнять кислород, в левую часть добавим 8 молекул H2O, а в правую — 16 ионов H+ (среда кислая!):
FeS2 + 8H2O Fe3+ + 2SO42– + 16H+.
Заряд левой части равен 0, заряд правой +15, поэтому FeS2 должен отдать 15 электронов:
FeS2 + 8H2O – 15e Fe3+ + 2SO42– + 16H+.
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
NO3– NO2 .
Необходимо отнять у NO3– один атом O. Для этого к левой части добавим 2 иона H+ (кислая среда), а к правой — одну молекулу H2O:
NO3– + 2H+ NO2 + H2O.
Для уравнивания заряда к левой части (заряд +1) добавим один электрон:
NO3– + 2H+ + e NO2 + H2O.
Полный электронно-ионный баланс имеет вид:
 15 NO3–
+ 2H+
+ e
NO2
+ H2O
15 NO3–
+ 2H+
+ e
NO2
+ H2O
1 FeS2 + 8H2O – 15e Fe3+ + 2SO42– + 16H+
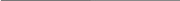
FeS2 + 8H2O + 15NO3– + 30H+ = Fe3+ + 2SO42– + + 16H+ + 15NO2 + 15H2O.
Сократив обе части на 16H+ и 8H2O, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
FeS2 + 15NO3– + 14H+ = Fe3+ + 2SO42– + 15NO2 + 7H2O.
Добавив в обе части уравнения соответствующее количество ионов по три иона NO3– и H+, находим молекулярное уравнение реакции:
FeS2 + 18HNO3(конц) = Fe(NO3)3 + 2H2SO4 + 15NO2 + 7H2O.
Задача 73. Используя метод электронного баланса, составьте уравнения следующих окислительно-восстановительных реакций:
1) FeCl3 + KI
2) H2O2 + KMnO4 + H2SO4
3) P + HNO3(конц) + H2O
4) FeS + O2
Решение. 1) Fe+3 – окислитель, восстанавливается до Fe+2; I– – восстановитель, окисляется до I2:
FeCl3 + KI FeCl2 + I2 + KCl.
 2 Fe+3
+ e
Fe+2
2 Fe+3
+ e
Fe+2
1 2I– – 2e I2
2Fe+3 + 2I– = 2Fe+2 + I2 .
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
2) Mn+7 – окислитель, восстанавливается в кислой среде до Mn+2; O– – восстановитель, окисляется до O2:
H2O2 + KMnO4 + H2SO4 O2 + K2SO4 + MnSO4 + H2O.
2 Mn+7 + 5e Mn+2
5 2O– – 2e O2
2Mn+7 + 10O– = 2Mn+2 + 5O2 .
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + K2SO4 + 2MnSO4 + 8H2O.
3) N+5 – окислитель, восстанавливается до N+2; P0 – восстановитель, окисляется до P+5:
P + HNO3 + H2O H3PO4 + NO.
5 N+5 + 3e N+2
3 P0 – 5e P+5
5N+5 + 3P0 = 5N+2 + 3P+5.
3P + 5HNO3(конц) + 2H2O = 3H3PO4 + 5NO.
4) O2 – окислитель, восстанавливается до O–2; Fe+2 и S–2 – восстановители, окисляются до Fe+3 и S+4:
FeS + O2 Fe2O3 + SO2.
7 O2 + 4e 2O–2
4 Fe+2 – e Fe+3
4 S–2 – 6e S+4
4Fe+2 + 4S–2 + 7O2 = 4Fe+3 + 4S+4 + 14O–2.
4FeS + 7O2 2Fe2O3 + 4SO2.
Задача 74. Используя метод электронно-ионного баланса, составьте полные уравнения следующих окислительно-восстановительных реакций:
1) FeSO4 + KMnO4 + H2SO4
2) KClO3 + HCl
3) Si + NaOH + H2O
4) KNO2 + KMnO4 + H2O
Решение. 1) MnO4– – окислитель, восстанавливается в кислой среде до Mn2+; Fe2+ – восстановитель, окисляется до Fe3+:
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + K2SO4 + MnSO4 + + H2O
 2 MnO4–
+ 8H+
+ 5e
Mn2+
+ 4H2O
2 MnO4–
+ 8H+
+ 5e
Mn2+
+ 4H2O
10 Fe2+ – e Fe3+
2MnO4– + 16H+ + 10Fe2+ 2Mn2+ + 8H2O + 10Fe3+
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + + 2MnSO4 + 8H2O.
2) ClO3– – окислитель, восстанавливается до Cl–; Cl– – восстановитель, окисляется до Cl2:
KClO3 + HCl KCl + Cl2 + H2O.
1 ClO3– + 6H+ + 6e Cl– + 3H2O
3 2Cl– – 2e Cl2
ClO3– + 6H+ + 6Cl– Cl– + 3H2O + 3Cl2
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O.
3) H2O – окислитель, восстанавливается до H2; Si – восстановитель, окисляется в щелочной среде до SiO32–:
Si + NaOH + H2O Na2SiO3 + H2 .
2 2H2O + 2e H2 + 2OH–
1 Si + 6OH– – 4e SiO32– + 3H2O
4H2O + Si + 6OH– 2H2 + 4OH– + SiO32– + 3H2O
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
4) MnO4– – окислитель, восстанавливается в нейтральной среде до MnO2; NO2– – восстановитель, окисляется до NO3–:
KNO2 + KMnO4 + H2O KNO3 + MnO2 + KOH.
2 MnO4– + 2H2O + 3e MnO2 + 4OH–
3 NO2– + 2OH– – 2e NO3– + H2O
2MnO4– + 4H2O + 3NO2– + 6OH– 2MnO2 + 8OH– + + 3NO3– + 3H2O
3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2 + 2KOH.
Задача 75. Напишите уравнения реакций, протекающих в водной среде:
а) Na2SO3 + KMnO4 + H2SO4 X + ...
б) X + KOH ...
Решение. а) Перманганат калия в кислой среде восстанавливается в соль марганца (II), а сульфит натрия окисляется до сульфата натрия:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + + 2MnSO4 + 3H2O.
б) Из продуктов реакции а) только сульфат марганца (II) (вещество X) реагирует со щелочью в водном растворе:
MnSO4 + 2KOH = Mn(OH)2 + K2SO4.
Задача 76. Даны четыре вещества: CaCO3, C (графит), HNO3 и Cu2O. Напишите три уравнения окислительно-восстановительных реакций, протекающих попарно между указанными веществами.
Решение. 1) Оксид меди (I) восстанавливается графитом при нагревании:
2Cu2O + C = 4Cu + CO2.
2) Карбонат кальция при прокаливании с избытком угля образует карбид кальция (промышленный способ):
CaCO3 + 4C = CaC2 + 3CO.
3) Оксид меди (I) окисляется азотной кислотой до нитрата меди (II):
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO + 7H2O.
Задача 77. Какие два вещества вступили в реакцию и при каких условиях, если в результате образовались следующие вещества (указаны все продукты реакции без коэффициентов):
1) CuSO4 + SO2 + H2O;
2) CuSO4 + NO2 + H2O;
3) I2 + KNO3 + NO + H2O.
Напишите полные уравнения реакций.
Решение. 1) Из наличия в правой части SO2 + H2O можно сделать вывод о том, что окислителем была концентрированная серная кислота. Восстановитель – медь:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
или оксид меди (I):
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O.
2) Выделение NO2 позволяет сделать вывод о том, что окислитель – концентрированная азотная кислота. Восстановитель – сульфид меди (II):
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O.
3) Выделение NO позволяет сделать вывод о том, что окислитель – разбавленная азотная кислота. Восстановитель – иодид калия:
6KI + 8HNO3 = 3I2 + 6KNO3 + 2NO + 4H2O.
Задача 78. При взаимодействии хлорида золота (III) с пероксидом водорода в щелочной среде образовалось 5,91 г золота. Вычислите объем выделившегося при этом газа (н.у.).
Решение. Хлорид золота (III) является сильным окислителем, следовательно пероксид водорода окисляется до кислорода. Найдем коэффициенты в уравнении реакции:
AuCl3 + H2O2 + KOH Au + O2 + KCl + H2O.
П оскольку реакция происходит в водном растворе, можно воспользоваться методом электронно-ионного баланса:
2 Au3+ + 3e Au
3 H2O2 + 2OH– – 2e O2 + 2H2O

2Au3+ + 3H2O2 + 6OH– = 2Au + 3O2 + 6H2O.
Отсюда легко получить молекулярное уравнение реакции:
2AuCl3 + 3H2O2 + 6KOH = 2Au + 3O2 + 6KCl + 6H2O.
Проведем расчет по этому уравнению реакции:
(Au) = 5,91/197 = 0,03 моль, (O2) = 3/2(Au) = 0,045 моль,
V(O2) = 0,04522,4 = 1,008 л.
Ответ. 1,008 л O2.
Задача 79. Обсудите, в каких пределах возможно использование таблицы стандартных электродных потенциалов для предсказания направления окислительно-восстановительных реакций.
Решение. Термодинамика предсказывает, что протекание одних реакций возможно (реакции осуществимы), а других — невозможно. Однако, даже если реакция осуществима, она вовсе не обязательно должна протекать самопроизвольно. В качестве примера можно указать реакции горения. Большинство реакций горения не протекают самопроизвольно, хотя они осуществимы с термодинамической точки зрения. Зачастую такие реакции могут начаться лишь после того, как будет преодолен энергетический барьер. При конкретных условиях какая-либо реакция может оказаться термодинамически возможной, но кинетически неосуществимой. Определение термодинамической возможности окислительно-восстановительных реакций довольно просто выполняется путем сравнения электродных потенциалов двух полуреакций. Если для этих целей используются значения стандартных электродных потенциалов, то ограничения связаны с теми условиями, при которых определяется стандартный потенциал.
Если металл погрузить в раствор, содержащий его ионы с концентрацией 1 моль/л при 25 С, то возникающий при этих стандартных условиях потенциал называют стандартным электродным потенциалом рассматриваемого металла и обозначают Е.
Количественным критерием оценки возможности протекания той или иной ОВР при стандартных условиях оказывается положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
Задача 80. Пользуясь данными табл. 1, покажите, какие из следующих веществ (или ионов) способны окислять бромид-ионы Br–: Cl2, H+, Fe2+, MnO4–. Реакции предполагается проводить при стандартных условиях.
Решение. Для окисления бромид-ионов пригодны окислители, у которых электродные потенциалы полуреакции E0 меньше, чем электродный потенциал полуреакции 2Br– Br2(ж) + 2e (т.е. меньше 1,06 В). Другими словами, для окисления Br– нужно выбрать электродную реакцию, в которой отдача электронов происходит с бóльшим трудом, чем в полуреакции 2Br– Br2(ж) + 2e. Среди перечисленных в табл.1 веществ этому условию отвечают только Cl2 и KMnO4. Действительно,
2Br– Br2(ж) + 2e E = –1,06 В
Mn2+ + 4H2O MnO4– + 8H+ + 5e E = –1,52 В
––––––––––––––––––––––––––––––––––––––––––––––––
E = –1,06 – (–1,52) = 0,46 В
2Br– Br2(ж) + 2e E = –1,06 В
2Cl– Cl2(г) + 2e E = –1,36 В
––––––––––––––––––––––––––––––––––––––––––––––––
E = –1,06 – (–1,36) = 0,30 В
Обратите внимание на то, что в табл. 1 приведены потенциалы полуреакций восстановления. Убедитесь самостоятельно, пользуясь данными табл.1, что ионы Fe2+ и H+ не способны окислить ионы Br–.
Задача 81. Сравните, какие продукты будут находиться в растворе в результате электролиза водного раствора нитрата меди (II) с инертными электродами в двух случаях: а) соль полностью подвергнута электролизу, и после этого электроды сразу вынуты из раствора; б) соль полностью подвергнута электролизу, после этого в течение некоторого времени электроды остаются в растворе.
Решение. При электролизе раствора нитрата меди (II) на катоде осаждается медь, а на аноде выделяется кислород:
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2.
а) Если после электролиза вынуть из раствора электроды, то в растворе останется только HNO3.
б) Если электроды оставить в растворе и отключить ток, то медь будет растворяться в разбавленной азотной кислоте:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 2H2O.
Из мольных соотношений меди и азотной кислоты в приведенных уравнениях следует, что во втором случае медь находится в избытке, поэтому азотная кислота реагирует полностью, и в растворе останется только Cu(NO3)2.
Задача 82. Электролиз 400 г 8,5%-ного раствора нитрата серебра продолжали до тех пор, пока масса раствора не уменьшилась на 25 г. Вычислите массовые доли соединений в растворе, полученном после окончания электролиза, и массы веществ, выделившихся на инертных электродах.
Решение. При электролизе водного раствора AgNO3 на катоде происходит восстановление ионов Ag+, а на аноде — окисление молекул воды:
Катод: Ag+ + e = Ag.
Анод: 2H2O – 4e = 4H+ + O2 .
Суммарное уравнение:
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2.
(AgNO3) = 400 0,085 / 170 = 0,2 моль. При полном электролитическом разложении данного количества соли выделяется 0,2 моль Ag массой 0,2108 = 21,6 г и 0,05 моль O2 массой 0,0532 = 1,6 г. Общее уменьшение массы раствора за счет серебра и кислорода составит 21,6+1,6 = 23,2 г.
При электролизе образовавшегося раствора азотной кислоты разлагается вода:
2H2O = 2H2 + O2.
Потеря массы раствора за счет электролиза воды составляет 25 – 23,2 = 1,8 г. Количество разложившейся воды равно: (H2O) = 1,8/18 = 0,1. На электродах выделилось 0,1 моль H2 массой 0,12 = 0,2 г и 0,1/2 = 0,05 моль O2 массой 0,0532 = 1,6 г. Общая масса кислорода, выделившегося на аноде в двух процессах, равна 1,6+1,6 = 3,2 г.
В оставшемся растворе содержится азотная кислота: (HNO3) = (AgNO3) = 0,2 моль, m(HNO3) = 0,263 = 12,6 г. Масса раствора после окончания электролиза равна 400–25 = 375 г. Массовая доля азотной кислоты: (HNO3) = 12,6/375 = 0,0336, или 3,36%.
Ответ. (HNO3) = 3,36%, на катоде выделилось 21,6 г Ag и 0,2 г H2, на аноде — 3,2 г O2.
Задача 83. При пропускании постоянного тока силой в 6,4 А в течение 30 мин через расплав хлорида неизвестного металла на катоде выделилось 1,07 г металла. Определите состав соли, которую подвергли электролизу.
Решение. Запишем схему электролиза:
2MeCl3
(–) Катод 2Me3+ + 6Cl– Анод (+)
2Me3+ + 6e = 2Me 6Cl– – 6e = 3Cl2
Определим количество электричества, пропущенное через раствор:
Q = I t = 6,4 A 1800 c = 11520 Кл.
Отметим, что расчеты по электродным уравнениям можно производить так же, как и по химическим уравнениям (как бы полагая, что электроны — это тоже химические вещества). 1 моль электронов имеет заряд 6,0210231,610–19 = 96500 Кл (число Фарадея, F), поэтому количество электронов, пропущенных через расплав, составляет
(e) = Q/F = 11520/96500 = 0,119 моль.
Согласно уравнению катодного процесса, количество выделившегося металла в 3 раза меньше количества электронов:
(Me) = (e)/3 = 0,0398 моль.
Теперь легко найти атомную массу металла:
A(Me) = 1,07 г / 0,0398 моль = 27 г/моль.
Искомый металл — алюминий.
Ответ: AlCl3.
Задача 84. При электролизе 1000 г 5%–ного раствора нитрата натрия на аноде выделилось 80 л кислорода, измеренного при температуре 25 С и давлении 1,24·105 Па. Рассчитайте массовую долю нитрата натрия в растворе после проведения электролиза.
Решение. Запишем схему электролиза:
NaNO3 <==> Na+ + NO3–
4H2O <==> 4H+ + 4OH–
(–) Катод Анод (+)
Na+ NO3–
4H+ + 4e = 2H2 4OH– – 4e = O2 + 2H2O
При электролизе водного раствора NaNO3 происходит электролитическое разложение воды, масса самой соли в растворе не изменяется, но уменьшается масса растворителя — воды, ионы которой разряжаются, и поэтому увеличивается концентрация растворенной соли. Решение задачи сводится к определению количества разложившейся воды и к пересчету концентрации раствора.
Из приведенной схемы электролиза следует уравнение электролитического разложения воды: 2H2O = 2H2 + O2
Теперь мы должны найти количество молей кислорода:
=
![]() =
=
![]() = 4 моль.
= 4 моль.
Следовательно, электролитическому разложению подвергли 8 моль H2O, т.е. 818=144 г H2O.
По определению массовой доли находим, что исходный раствор содержал 50 г NaNO3. После электролиза массовая доля соли составит:
(NaNO3)
=
![]() 100%
= 5,8%
100%
= 5,8%
Ответ: 5,8% NaNO3.
