
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
7.2.2. Классификация химических реакций
455. Приведите пример обменной реакции, в ходе которой из соли А получается соль Б. Молекула А состоит из 5 атомов, а молекула Б — из 2-х.
456. Приведите примеры реакций разложения, в ходе которых образуются три вещества, каждое из которых содержит кислород.
457. Приведите примеры реакций соединения между тремя веществами, каждое из которых содержит кислород.
458. Приведите примеры реакций соединения, разложения, обмена и замещения. Во всех приведенных уравнениях должно фигурировать (в правой или левой части) одно и то же, произвольно выбранное вами вещество.
459. Приведите пример реакции горения сложного неорганического вещества.
460. Приведите по два примера необратимых и обратимых химических реакций.
461. Напишите уравнение реакции разложения соли, при нагревании которой образуется одно простое вещество и два сложных.
462. Приведите примеры реакций разложения, в ходе которых образуются: а) два сложных вещества; б) два простых вещества; в) простое и сложное вещество.
463. Приведите примеры реакций разложения, в ходе которых образуются: а) два простых вещества и одно сложное; б) три сложных вещества; в) два простых вещества и одно сложное.
464. Приведите примеры реакций соединения и разложения, протекающих: а) без изменения степеней окисления всех элементов; б) окислительно-восстановительных.
465. Составьте уравнения в соответствии со схемой:
1 2 3
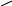
A
B
C 7
A
B
C 7
C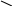 aCO3 +
CaSO4
aCO3 +
CaSO4
D E F
4 5 6
Реакция 1 — реакция разложения, реакции 2, 5 — соединения, остальные — реакции обмена.
466. Составьте уравнения в соответствии со схемой:
1 2 3 4
A B C H2O
Fe2O3
D E F H2O
5 6 7 8
Реакция 1 — реакция замещения, реакция 2 — соединения, реакции 3, 5, 6, 7 — обмена, реакции 4 и 8 — разложения.
467. Имеется смесь двух солей. Какие вещества будут вступать в реакции в водном растворе с обеими солями; с одной из них (любой)? Напишите уравнения реакций. Смеси:
а) сульфат натрия и карбонат натрия;
б) сульфид калия и хлорид калия;
в) хлорид бария и хлорид калия;
г) нитрат магния и нитрат бария;
д) сульфат калия и сульфат аммония;
е) нитрат аммония и хлорид аммония.
468. Из перечисленных ниже веществ укажите то, которое не будет вступать в обменные реакции в водном растворе с остальными. Из числа оставшихся выберите то, которое будет реагировать с двумя другими. Напишите уравнения реакций.
а) Нитрат калия, сульфат калия, сульфит калия, хлорид бария.
б) Гидроксид калия, хлорид калия, фосфат калия, нитрат магния.
в) Углекислый газ, соляная кислота, сульфат калия, гидроксид калия.
г) Серная кислота, хлорид калия, гидроксид калия, оксид серы (IV).
469. В пяти пробирках находятся водные растворы сульфата натрия, ацетата свинца (II), сульфида калия, хлорида алюминия, нитрата бария. Как, не используя никаких реактивов, распознать, где какой раствор находится?
7.2.3. Гидролиз солей
470. Известно, что водные растворы средних солей могут иметь щелочную, кислую или нейтральную среду. Дайте объяснение этим фактам и приведите по одному конкретному примеру.
471. В каких случаях процесс гидролиза является необратимым? Приведите примеры.
472. Раствор Na3PO4 имеет сильнощелочную реакцию, а раствор NaH2PO4 — слабокислую. Дайте объяснение этим фактам.
473. Как известно, цинк активно реагирует с раствором серной кислоты. Однако при добавлении к этому раствору ацетата натрия выделение пузырьков газа резко замедляется. Как можно объяснить это явление?
474. С помощью какого одного реактива можно различить растворы сульфата калия, сульфата цинка и сульфита калия? Напишите уравнения реакций.
475. В трех пробирках находятся растворы соды, сульфата алюминия и сульфат меди (II). Как распознать эти реактивы, не используя других реактивов?
476. К раствору хлорида алюминия добавили раствор сульфида натрия. Напишите уравнение реакции.
477. Напишите уравнение реакции взаимодействия между сульфатом железа (II) и метиламином в водной среде при нагревании.
478. Водные растворы каких из ниже перечисленных веществ будут вызывать изменения окраски индикатора: хлорид натрия, цианид натрия, нитрат бария, фосфат калия, перхлорат калия, дигидрофосфат натрия, хлорид железа (III), ацетат натрия, хлорид аммония, ацетат алюминия? Напишите сокращенные ионные уравнения процессов, протекающих при взаимодействии указанных солей с водой.
479. Запишите окончания уравнений следующих реакций гидролиза и расставьте коэффициенты:
1) Al2(SO4)3 + Na2CO3 + H2O
2) Cr2(SO4)3 + (NH4)2S + H2O
3) AlCl3 + (NH4)2S + H2O
4) AlCl3 + CH3COONa + H2O Al(OH)(CH3COO)2 + ...
5) CuSO4 + Na2CO3 + H2O [Cu(OH)]2CO3 + ...
6) Na2SiO3 + NH4Cl + H2O
7) Al4C3 + H2O
8) ZnSO4 + K2CO3 + H2O [Zn(OH)]2CO3 + ...
9) FeCl3 + (NH4)2CO3 + H2O
480. Рассчитайте степень гидролиза ацетата натрия в 0,01 М растворе и pH раствора (константа диссоциации уксусной кислоты равна 1,810–5).
481. Рассчитайте константу гидролиза Кг бромида аммония, определите степень гидролиза соли в 0,01 М растворе и pH раствора (константа диссоциации NH4OH равна 1,810–5).
482. Исходя из значений констант диссоциации соответствующих кислот и оснований, предскажите реакцию водных растворов NH4NO2 и NH4CN (Кд(NH4OH) = 1,810–5, Кд(HNO2) = 5,110–4, Кд(HCN) = 7,910–10).
