
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
Глава 2. Строение атома и периодический закон
§ 2.1. Задачи с решениями
Задача 26. Опишите электронные конфигурации элементов с порядковыми номерами 25 и 76.
Решение. В подавляющем большинстве атомов и ионов энергия орбиталей увеличивается в ряду: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p (особняком стоят атом водорода и ионы с одним электроном — He+, Li++ и др., у которых энергия орбиталей изменяется следующим образом: 1s < 2s = 2p < 3s = 3p = 3d < 4s = 4p = 4d = 4f < ...). Для запоминания этого довольно сложного ряда существует удобный метод, суть которого ясна из следующей таблицы:
|
|
|
1s |
|
|
|
2s |
|
|
2p |
3s |
|
|
3p |
4s |
|
3d |
4p |
5s |
|
4d |
5p |
6s |
4f |
5d |
6p |
7s |
5f |
6d |
7p |
8s |
Таблица читается по строчкам сверху вниз, каждая строчка читается слева направо.
Очень важной величиной является разница в энергии орбиталей. Общее правило здесь таково: чем больше главное квантовое число, тем меньше разница в энергии соседних орбиталей. Примерная энергетическая схема изображена на рис. 1. Из рисунка видно, что разница в энергии между 2s- и 1s-орбиталями в несколько раз больше разницы между 3s- и 2s-орбиталями, а последняя, в свою очередь, в несколько раз больше разницы между 4s- и 3s-орбиталями.
При заполнении орбиталей электронами используются три правила:
Правило 1. Принцип наименьшей энергии — для получения электронной конфигурации основного состояния атома или иона необходимо заполнять электронами свободные орбитали с наименьшей энергией.
Правило 2. Принцип запрета Паули. Согласно этому принципу, на любой орбитали могут находиться не более двух электронов. Таким образом, на s-оболочке (1 орбиталь) могут находиться 2 электрона, на p-оболочке (3 орбитали) — 6 электронов, на d-оболочке (5 орбиталей) — 10 электронов, на f-оболочке (7 орбиталей) — 14 электронов.
Правило 3. Правило Хунда — в основном состоянии (т.е., в состоянии с наименьшей энергией) атом (или ион) имеет максимально возможное число неспаренных электронов в пределах одной оболочки.
Применив эти правила к элементу с порядковым номером 25 (25 электронов), получим электронную конфигурацию: 1s2 2s2 2p6 3s2 3p6 4s2 3d5 , в которой все 3d-электроны —неспаренные (см. рис. 1).
По этим же правилам 76-й элемент имеет конфигурацию: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d6.

Рис. 1. Энергетическая диаграмма распределения электронов по орбиталям для 25-го элемента (25Mn)
Задача 27. Какой инертный газ и ионы каких элементов имеют одинаковую электронную конфигурацию с частицей, возникающей в результате удаления из атома кальция всех валентных электронов ?
Решение. Электронная оболочка атома кальция имеет структуру 1s2 2s2 2p6 3s2 3p6 4s2. При удалении двух валентных электронов образуется ион Ca2+ с конфигурацией 1s2 2s2 2p6 3s2 3p6. Такую же электронную конфигурацию имеют атом Ar и ионы S2, Cl, K+, Sc3+ и др.
Задача 28. Могут ли электроны иона Al3+ находиться на следующих орбиталях: а) 2p; б) 1p; в) 3d?
Решение. Электронная конфигурация атома алюминия: 1s2 2s2 2p6 3s2 3p1. Ион Al3+ образуется при удалении трех валентных электронов из атома алюминия и имеет электронную конфигурацию 1s2 2s2 2p6.
а) На 2p-орбитали электроны уже находятся;
б) в соответствии с ограничениями, накладываемыми на квантовое число l (l = 0, 1,...n–1), при n = 1 возможно только значение l = 0, следовательно, 1p-орбиталь не существует;
в) на 3d-орбитали электроны могут находиться, если ион — в возбужденном состоянии.
Задача 29. Напишите электронную конфигурацию атома неона в первом возбужденном состоянии.
Решение. Электронная конфигурация атома неона в основном состоянии – 1s2 2s2 2p6. Первое возбужденное состояние получается при переходе одного электрона с высшей занятой орбитали (2p) на низшую свободную орбиталь (3s). Электронная конфигурация атома неона в первом возбужденном состоянии – 1s2 2s2 2p5 3s1.
Задача 30. Какие общие свойства имеют элементы Mn и Cl, находящиеся в одной группе Периодической системы?
Решение. Марганец и хлор находятся в VII группе Периодической системы, но хлор — в главной, а марганец — в побочной подгруппе. Формально они могут проявлять максимальную валентность 7 и давать соединения с меньшими валентностями, причем марганец как элемент побочной подгруппы должен иметь мало сходства с хлором — элементом главной подгруппы
Рассмотрим электронную конфигурацию атома хлора — 1s2 2s2 2p6 3s2 3p5.
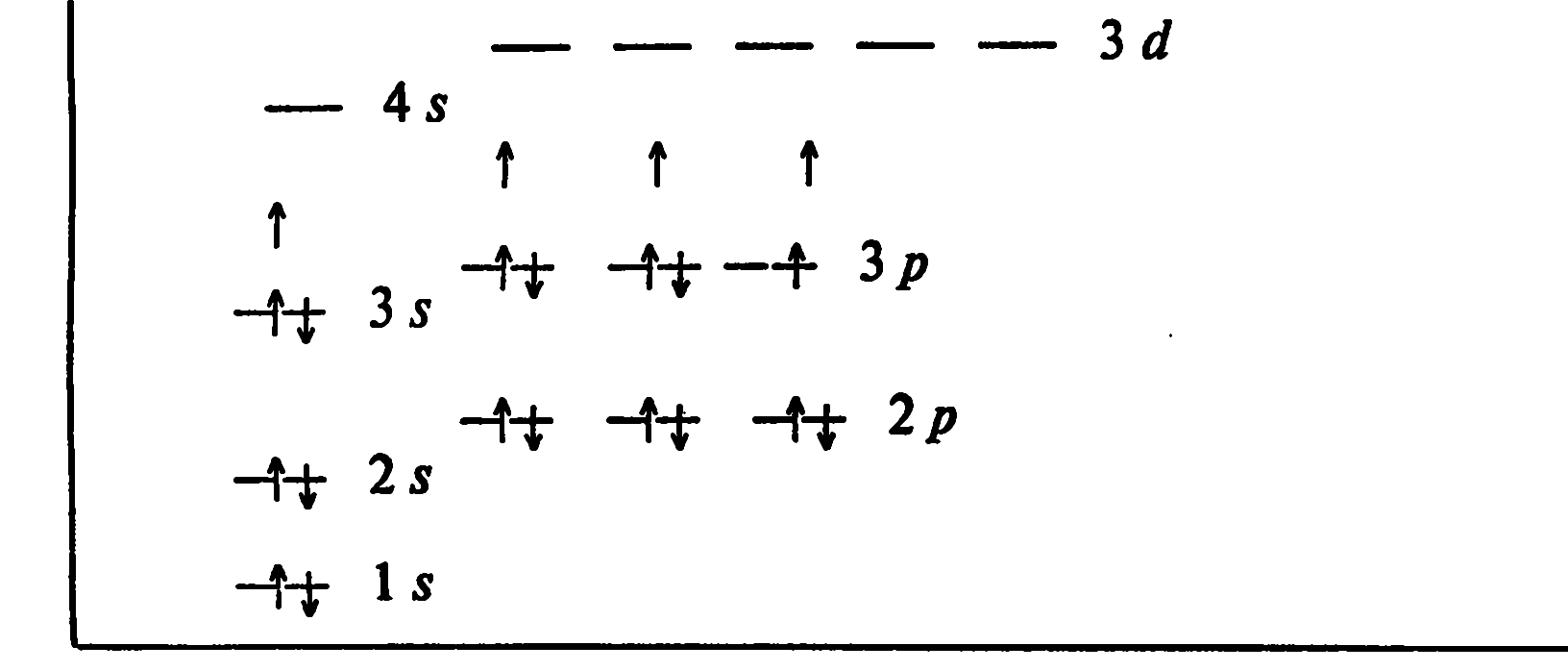
(На данной диаграмме не соблюдается масштаб по энергии). Вертикальными маленькими стрелочками изображены возможные способы распаривания электронов в возбужденных состояниях атома хлора. Такое распаривание возможно потому, что атом хлора имеет свободные 4s- и 3d-орбитали. При частичном или полном распаривании электронов хлор может проявлять переменную валентность 1, 3, 5, 7.
Электронная конфигурация атома марганца имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (см. задачу 26 и рис.1). Как видно из рисунка 1, у атома марганца не достроена 3d-орбиталь. Наличие двух 4s-электронов на внешнем уровне указывает прежде всего на металлические свойства марганца и обусловливает существование характерных свойств у соединений марганца. При возбуждении атома марганца один 4s-электрон переходит на 4p-орбиталь, и число неспаренных электронов, участвующих в образовании химической связи, доходит до 7. Сказанное поясним на примере оксидов и гидроксидов марганца и хлора.
Марганец с кислородом образует несколько оксидов, обладающих различными свойствами. Увеличение валентности марганца от двух до семи сопровождается усилением кислотных и ослаблением основных свойств оксидов. Оксид марганца (II) MnO — основной оксид, ему соответствует основание Mn(OH)2; оксид марганца (IV) — наиболее устойчивый при обычных условиях оксид марганца с амфотерными свойствами: ему формально соответствует гидроксид Mn(OH)4, дающий соли Mn(CH3COO)4 и CaMnO3 (CaO·MnO2). Оксид марганца (VI) MnO3 в свободном виде не получен, ему соответствует марганцовистая кислота H2MnO4 (ее соли носят название манганаты). Оксид марганца (VII) Mn2O7 также является кислотным оксидом, ему соответствует марганцовая кислота HMnO4 (соли — перманганаты).
Хлор с кислородом образует также ряд оксидов. Как и у соединений марганца, увеличение валентности хлора сопровождается усилением кислотных свойств этих соединений. Проявляется это в том, что все оксиды хлора являются кислотными, и сила соответствующих кислот возрастает с ростом валентности. Так, оксиду хлора (I) Cl2O соответствует очень слабая хлорноватистая кислота HClO (соли — гипохлориты); невыделенному оксиду хлора (III) Cl2O3 соответствует более сильная хлористая кислота HClO2 (соли — хлориты); существует и оксид хлора (IV) ClO2. Оксиду хлора (V) соответствует уже достаточно сильная хлорноватая кислота HClO3 (соли — хлораты); и, наконец, оксиду хлора (VII) Cl2O7 соответствует очень сильная хлорная кислота HClO4 (соли — перхлораты).
Таким образом, общим для марганца и хлора можно считать образование ряда подобных химических соединений, например оксидов и их гидроксидов, причем с возрастанием валентности этих элементов кислотные свойства их гидроксидов возрастают.
Особенно похожими свойствами обладают соединения этих элементов с высшей валентностью (7). Так, например, оксид марганца (VII) Mn2O7 (жидкость) очень неустойчив, при нагревании разлагается со взрывом. Оксид хлора (VII) Cl2O7 — маслянистая жидкость, взрывается при ударе. HMnO4 и HClO4 — очень сильные кислоты, в растворе диссоциируют почти нацело. Обе кислоты и их соли являются сильными окислителями.
Задача 31. Как изменяются свойства гидроксидов элементов в периодах Периодической системы при движении слева направо?
Решение. Все кислородсодержащие кислоты и основания можно рассматривать как продукты соединения соответствующих оксидов с водой и объединить их под общим названием гидроксиды. Принадлежность гидроксидов к классу кислот или классу оснований определяется тем, на какие ионы они диссоциируют в водном растворе. Если при диссоциации образуются ионы водорода H+, то гидроксид относится к классу кислот, если же диссоциация протекает с образованием ионов гидроксила OH–, то гидроксид относится к классу оснований. В связи с этим различают два типа диссоциации гидроксидов:
1) кислотный тип диссоциации:
Э–O–H <==> ЭO– + H+;
2) основной тип диссоциации:
Э–O–H <==> Э+ + OH–.
Кроме кислотных и основных гидроксидов, существуют еще так называемые амфотерные, которые в зависимости от среды ведут себя или как кислоты, или как основания, например (формально):
Al3+ + 3OH– <==> Al(OH)3 <==> H2O + HAlO2 <==> H+ + AlO2–.
Характер диссоциации, т.е. место разрыва связи Э–O–H, зависит от положения элемента в периодической системе, что и определяет относительную прочность связи между этим элементом и кислородом, с одной стороны, и между кислородом и водородом — с другой.
Изменение свойств гидроксидов в периоде слева направо. Силы притяжения между противоположно заряженными частицами тем значительнее, чем больше заряд каждой из них и меньше ее радиус. Рассмотрим изменение свойств гидроксидов по периоду на примере элементов третьего периода:
NaOH – Mg(OH)2 – Al(OH)3 – (HO)2SiO – (HO)3PO – (HO)2SO2 – HOClO3.
Благодаря своим малым размерам, ион водорода H+ в NaOH и Mg(OH)2 сильнее взаимодействует с кислородом, чем ион металла, несмотря даже на большой заряд у магния. Вследствие этого оба вещества диссоциируют как основания. В результате дальнейшего увеличения заряда и уменьшения радиуса атома при переходе к алюминию обе связи становятся близки по характеру, и Al(OH)3 является типичным амфотерным электролитом. Наконец, у последних четырех соединений вследствие еще большего увеличения заряда и уменьшения радиуса атомов заметно уменьшается прочность связи водорода с кислородом, и все они диссоциируют по кислотному типу.
Задача 32. Каков состав ядер изотопов 12C и 13C, 14N и 15N?
Решение. Число протонов в ядре равно порядковому номеру элемента и одинаково для всех изотопов данного элемента. Число нейтронов равно массовому числу (указываемому слева вверху от номера элемента) за вычетом числа протонов. Разные изотопы одного и того же элемента имеют разные числа нейтронов.
Состав указанных ядер:
12C: 6p+6n; 13C: 6p+7n; 14N: 7p+7n; 15N: 7p+8n.
Задача
33. а) Изотоп
какого элемента образуется при испускании
изотопом
![]() -частицы?
б) Изотоп какого элемента образуется
при испускании изотопом
-частицы?
б) Изотоп какого элемента образуется
при испускании изотопом
![]() -частицы?
Напишите уравнения ядерных превращений
для а) и б).
-частицы?
Напишите уравнения ядерных превращений
для а) и б).
Решение. а) Составим схему ядерной реакции:
![]()
![]()
+
Э
+
Э
Поскольку сумма верхних и нижних символов у элементов в обеих частях уравнения должна быть постоянной, то находим, что искомый элемент должен обладать порядковым номером 82 (следовательно, это Pb) с массовым числом 209. Следовательно:
![]() +
.
+
.
б) Составим схему ядерной реакции:
![]() +
Э
+
Э
Рассуждая аналогично (или используя правило Содди-Фаянса) записываем окончательно:
+
![]()
Таким образом, и в результате такого радиоактивного превращения образуются атомы .
Задача
34. При
облучении нейтронами изотопа
![]() образуются протоны и изотопы нового
элемента. Что это за элемент? Напишите
уравнение ядерного превращения.
образуются протоны и изотопы нового
элемента. Что это за элемент? Напишите
уравнение ядерного превращения.
Решение. Надо помнить, что в любых ядерных реакциях, как в случае естественного (см. задачу 33) , так и в случае искусственного превращения элементов сумма атомных масс (сумма индексов слева вверху) реагентов и продуктов всегда одинакова. То же самое относится и к зарядам ядер (индексы слева внизу). Следовательно:
+
![]()
![]() +
+
![]() .
.
Задача 35. Изотоп 210Po, излучающий -частицы, используется в смеси с бериллием в нейтронных источниках. Через какое время интенсивность таких источников уменьшится в 32 раза? Период полураспада 210Po равен 138 дням.
Решение. Период полураспада — это время, за которое самопроизвольно распадается половина атомов исходного вещества:
m1 = m0 / 2 ,
где m0 — исходная масса вещества, m1 — масса вещества через время . Используя данное определение, можно написать общую формулу для массы вещества mt через произвольное время t:
![]() .
.
По
условию,
![]() ,
,
откуда t = 5 = 5138 = 690 сут.
Задача может быть решена и при использовании так называемой постоянной распада, которая характеризует неустойчивость ядер радиоактивного изотопа. Постоянная распада рассчитывается по формуле:
![]() ,
(1)
,
(1)
где с1 — начальная активность изотопа; с2 — активность изотопа по истечении времени t.
![]()
По условиям задачи интенсивность источника должна уменьшиться в 32 раза, т.е. с1 = 32с2. В уравнение (1) подставим полученное значение константы, активности и определим время:
![]()
![]() суток.
суток.
Ответ. 690 суток.
