
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
Глава 3. Химическая связь
§ 3.1. Задачи с решениями
Задача 36. Сколько электронов и протонов содержат следующие молекулы и ионы: а) AlH4–; б) NF3?
Решение. а) Число протонов в атоме элемента равно порядковому номеру элемента, поэтому атом алюминия содержит 13 протонов, атом водорода — один протон. Всего в ионе AlH4– содержится 17 протонов. Заряд иона равен –1, поэтому число электронов на единицу превышает число протонов и равно 18.
б) Атом азота содержит 7 протонов, атом фтора — 9 протонов. Всего в молекуле NF3 содержится 7+39=34 протона. Заряд молекулы равен 0, поэтому число электронов равно числу протонов.
Ответ. а) 17 протонов, 18 электронов; б) 34 протона, 34 электрона.
Задача 37. Дайте определение валентности и степени окисления. Приведите структурные формулы 3-аминобензойной кислоты и гидроксобромида магния. Укажите валентности и степени окисления всех элементов.
Решение. Валентность и степень окисления — суть разные понятия, характеризующие способность элементов образовывать химические соединения.
Валентность — это число связей атома данного элемента с атомами других элементов в данном химическом соединении. Валентность всегда имеет положительное целочисленное значение.
Степень окисления — это формальный заряд, которым обладает атом в данном химическом соединении при условии, что все связи имеют ионный характер. Именно последнее требование обусловливает формальность этого понятия. Степень окисления может быть как положительной, так и отрицательной величиной, как дробной, так и целочисленной.
Структурные формулы показывают последовательность соединения атомов в молекуле с соблюдением валентности элементов.
1) 3-Аминобензойная кислота.
Все связи в молекуле 3-аминобензойной кислоты – ковалентные полярные, кроме связей CC в бензольном кольце, которые являются ковалентными неполярными:
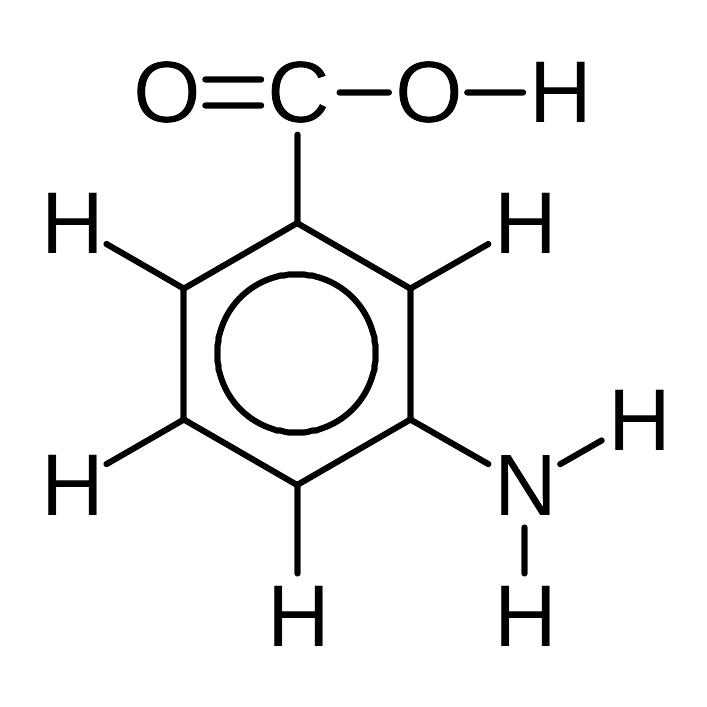
Валентности элементов равны: C – IV, O – II, H – I, N – III. Степени окисления: H+1, O–2, N–3. Степени окисления атомов углерода различны. Атомы C в бензольном кольце при связях CH имеют степень окисления –1 (т.к. углерод – более электроотрицательный элемент, чем водород), атом C при связи CN имеет степень окисления +1 (азот более электроотрицателен, чем углерод), атом C при связи CC — степень окисления 0 (связь между одинаковыми атомами). Наконец, атом C в группе COOH связан тремя связями с более электроотрицательными атомами O и имеет степень окисления +3.
Гидроксобромид магния Br–Mg–O–H
Элемент |
Степень окисления |
Валентность |
Br |
–1 |
1 |
Mg |
+2 |
2 |
O |
–2 |
2 |
H |
+1 |
1 |
Задача 38. Каковы валентность и степень окисления азота: а) в азотной кислоте; б) в хлориде аммония?
Решение. а) Структурную формулу азотной кислоты иногда изображают с пятивалентным азотом следующим образом:

В действительности, пятивалентный азот не существует, поскольку для этого атом азота должен иметь пять неспаренных электронов. Распаривание 2s-электронов азота требует очень большой затраты энергии и практически не происходит. Атом азота в азотной кислоте имеет валентность IV. Три ковалентные связи NO образованы за счет неспаренных электронов, и одна — за счет неподеленной пары электронов азота. Структурную формулу азотной кислоты можно писать так:

где стрелочка обозначает донорно-акцепторную связь.
Степень окисления водорода равна +1, кислорода –2, а сумма степеней окисления атомов в молекуле равна 0, поэтому на долю атома азота приходится условный заряд +5.
б) Валентность азота в ионе NH4+ равна IV. Три ковалентные связи NH образованы за счет неспаренных электронов азота, и одна — за счет неподеленной пары электронов.
Степень окисления водорода равна +1, а сумма степеней окисления атомов в ионе равна заряду иона (–1), поэтому на долю атома азота приходится условный заряд –3.
Ответ. а) Валентность IV, степень окисления +5. б) Валентность IV, степень окисления –3.
Задача 39. Определите степени окисления элементов в следующих соединениях: K2MnO4; Ba(ClO3)2; F2O; Ca(NO2)2; H2SiF6; H2O2; Cr2(SO4)3.
Решение. Используем следующие правила определения степеней окисления: 1) сумма степеней окисления атомов в молекуле равна 0; 2) степень окисления H равна +1 в соединениях с неметаллами; 3) степень окисления O равна –2, кроме соединений со фтором и перекисных соединений; 4) степень окисления F равна –1; 5) степень окисления металла равна заряду иона металла. Используя эти правила, находим:
1) K2MnO4: K+1, Mn+6, O–2; 2) Ba(ClO3)2: Ba+2, Cl+5, O–2; 3) F2O: F–1, O+2; 4) Ca(NO2)2: Ca+2, N+3, O–2; 5) H2SiF6: H+1, Si+4, F–1; 6) H2O2: H+1, O–1; 7) Cr2(SO4)3: Cr+3, S+6, O–2.
Задача 40. Опишите пространственную структуру следующих молекул: BF3, ZnCl2, NH3.
Решение. Фторид бора BF3. Пространственная структура этой молекулы определяется тем, что при образовании связей B–F происходит гибридизация одной s- и двух p-орбиталей атома B (sp2-гибридизация), при этом образуются три одинаковые sp2-гибридные орбитали, расположенные под углом 120 друг к другу. Таким образом, BF3 — плоская молекула с углом 120 между связями.
Хлорид цинка ZnCl2. При образовании молекул типа ZnX2, BeX2 (X — галоген или водород) происходит sp-гибридизация орбиталей центрального атома, и возникают химические связи, направленные под углом 180 друг к другу. Молекулы данного типа линейны.
Аммиак NH3. При образовании связей N–H происходит гибридизация одной s- и трех p-орбиталей атома азота; три sp3-гибридные орбитали участвуют в образовании трех связей N–H, а четвертая орбиталь занята неподеленной электронной парой. Молекула имеет форму треугольной пирамиды с атомом азота в вершине. Величина угла между связями N–H несколько отличается от характерного для sp3-гибридизации значения 10928' — она равна 107.
Разобранные примеры показывают, что гибридизация электронных орбиталей характерна не только для соединений углерода, но и для соединений любых элементов, когда химическая связь образуется электронами, принадлежащими к разным, но близким по энергии орбиталям.. Заметим, однако, что структуры молекул типа NH3 и H2O могут быть объяснены и без привлечения модели гибридизации орбиталей.
Задача 41. Для определения структуры молекул в газовой фазе иногда используют метод электронографии, который позволяет найти межъядерные расстояния в молекуле по интенсивности упругого рассеяния электронов. По данным одного из экспериментов межъядерные расстояния в молекуле NCl3 оказались равны: r(NCl) = 0,176 нм, r(ClCl) = 0,283 нм. Установите, какую геометрическую фигуру образуют ядра атомов в этой молекуле. Какой тип гибридизации центрального атома позволяет описать данное строение молекулы?
Решение. Все три связи N–Cl в молекуле NCl3 одинаковы. Молекула может иметь форму правильного треугольника, если атом азота находится в плоскости, образованной тремя атомами хлора:

Если атом азота лежит вне этой плоскости, то молекула имеет форму треугольной пирамиды:

В первом случае угол между связями равен Cl‑N‑Cl = 120, во втором случае ClNCl 120.
Для нахождения этого угла рассмотрим равнобедренный треугольник ClNCl.

По теореме косинусов
r(ClCl)2 = r(NCl)2 + r(NCl)2 – 2r(NCl)2 cosCl‑N‑Cl,
откуда cosCl‑N‑Cl = 1 – 0,2832 / (20,1762) = –0,293, Cl‑N‑Cl = 107. Это означает, что молекула представляет собой треугольную пирамиду. Центральный атом азота находится в состоянии sp3-гибридизации.
Ответ. Треугольная пирамида. sp3-гибридизация.
Задача 42. Рассчитайте объем и радиус атома хрома, исходя из предположения, что атомы имеют форму шара, а объем шаров составляет 68% от общего объема. Плотность хрома равна 7,19 г/см3.
Решение. Исходя из определения плотности вещества ( = m / V, где m — масса вещества, V —объем, занимаемый веществом), можно рассчитать объем одного моля хрома (“молярный объем”) VM:
VM
=
![]() см3
см3
По условию 6,021023 атомов хрома занимают объем, равный 7,2320,68 = 4,918 см3, следовательно, объем одного атома хрома составит
v = 4,918 см3 / 6,021023 = 8,1710–24 см3 = 8,17 Å3.
Радиус атома хрома (R) рассчитывается по формуле
v
=
![]()
Отсюда
R(Cr)
=
![]() = 1,25 Å.
= 1,25 Å.
Ответ. v(Cr) = 8,17 Å3; R(Cr) = 1,25 Å.
Задача 43. Как изменяется прочность связи H–Э в ряду H2O–H2S–H2Se–H2Te?
Решение. В указанном ряду размеры валентных электронных облаков элементов (O, S, Se, Te) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду O–S–Se–Te вследствие увеличения числа промежуточных электронных слоев. Таким образом, при переходе от кислорода к теллуру прочность связи H–Э уменьшается.
Задача 44. Сероводород при обычной температуре — газ , а вода — жидкость. Чем можно объяснить это различие в свойствах?
Решение. Кислород — более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода. Разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Задача 45. Ниже приведены температуры кипения (в К) благородных газов:
He |
Ne |
Ar |
Kr |
Xe |
Rn |
4,2 |
27,1 |
87,3 |
120,9 |
166,0 |
211,4 |
Чем объясняется повышение температуры кипения с возрастанием порядкового номера благородного газа?
Решение. С ростом порядкового номера благородных газов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы ван-дер-ваальсова взаимодействия между ними; отрыв атомов друг от друга, происходящий при переходе вещества из жидкого в газообразное состояние, требует все большей затраты энергии. Это и приводит к повышению температуры кипения.
Задача 46. Дипольный момент молекулы HCl равен 3,510–30 Клм (или 1,05 Дебая). Рассчитайте длину диполя молекулы хлороводорода.
Решение. Полярность связи количественно оценивается дипольным моментом , который является произведением длины диполя l — расстояния между двумя равными по величине и противоположными по знаку зарядами +q и –q — на абсолютную величину заряда: = lq.
Дипольные моменты молекул обычно выражают либо в Клм, либо в Дебаях.
Абсолютное значение заряда электрона q = 1,610–19 Кл, поэтому длина диполя молекулы HCl составляет
l
=
/ q
=![]() = 2,1910–11
м = 0,0219 нм.
= 2,1910–11
м = 0,0219 нм.
Ответ: l = 0,0219 нм.
