
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
Глава 10. Подгруппа азота и фосфора
Главную подгруппу V группы составляют азот, фосфор, мышьяк, сурьма и висмут. Каждый из элементов имеет электронную конфигурацию на внешнем уровне ns2np3 и может проявлять в своих соединениях степень окисления от –3 до +5. Азот и фосфор типичные неметаллы, мышьяк проявляет и металлические свойства, сурьма и висмут типичные металлы. В отличие от всех других, в V группе периодической системы очень резко изменяются свойства составляющих ее элементов. Поэтому не случайно и название настоящей главы: в современных учебниках (см., например, Мартыненко Л.И., Спицын В.И. Неорганическая химия. М.: Изд-во МГУ, 1994, с. 409) V группу разбивают на две подгруппы азота и фосфора, и подгруппу мышьяка.
§ 10.1. Задачи с решениями
Задача 112. В чем причина большой разницы в химической активности молекулярного азота и белого фосфора?
Решение. Азот как простое вещество существует в виде двухатомных молекул N2, в которых атомы связаны кратной тройной связью NN (две -связи и одна -связь). Именно по этой причине энергия диссоциации N2 чрезвычайно велика (945 кДж/моль); аналогичные величины для кислорода — 494 кДж/моль, водорода — 435 кДж/моль. Из всех галогенов наибольшая энергия диссоциации у хлора — 242 кДж/моль. Прочность молекулы N2 такова, что степень ее диссоциации даже при 3000 С достигает всего лишь 0,1%. Вследствие этого, для того, чтобы молекулярный азот вступил в химическую реакцию, необходима очень “жесткая” активация его молекул (сильным нагреванием, облучением или электрическим разрядом). Так, с кислородом азот взаимодействует только при очень высоких температурах (>1200 С) или в электрическом разряде, эндотермически и обратимо с малым выходом образуя оксид азота (II):
N2 + O2 <==> 2NO – Q.
По этой же причине азот применяют для создания инертной атмосферы в случае процессов, которые невозможно проводить в присутствии кислорода (например, для заполнения ламп накаливания).
Белый фосфор уникален по своей химической активности, разительно отличаясь от молекулярного азота. Так, уже при температуре 35 С белый фосфор самовоспламеняется в атмосфере кислорода, образуя ангидрид фосфорных кислот (точнее P4O10). Фосфор настолько активный элемент, что не только белый фосфор, но и более стабильные его аллотропы (красный и черный фосфор) в природе не встречаются. Твердый и жидкий белый фосфор, так же, как и его пары, состоят из молекул P4 (Тпл = 44 С, Ткип = 280 С — низкие значения этих величин, в свою очередь, свидетельствуют о слабых межмолекулярных связях). В молекуле P4 все четыре атома фосфора одинарными связями образуют тетраэдрическую структуру (рис. 5),
Рис.
5. Строение молекулы белого фосфора.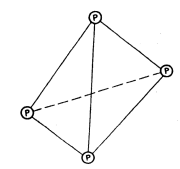
В заключение подчеркнем однако, что инертность молекулярного азота не следует отождествлять с инертностью таких благородных газов, как, например, аргон. Инертность аргона обусловлена свойствами индивидуальных атомов, принципиально не способных соединиться с другими атомами. Напротив, низкая реакционная способность азота есть свойство не его атомов, а молекул, и обусловливается наличием трех прочных связей в его молекуле. Как только эти связи разрываются, азот становится чрезвычайно реакционноспособным и, как мы знаем, образует многочисленные и разнообразные соединения.
Задача 113. Как можно разделить смесь газов, состоящую из O2 и NH3?
Решение. Аммиак — газ, имеющий основной характер; он легко реагирует с кислотами. Если смесь O2 и NH3 пропустить через раствор кислоты, то аммиак поглотится:
2NH3 + H2SO4 = (NH4)2SO4 ,
и улетучится чистый кислород. Аммиак можно выделить из образовавшегося раствора действием избытка щелочи при нагревании:
(NH4)2SO4 + 2KOH = 2NH3 + K2SO4 + 2H2O.
Задача 114. Докажите, что оксид азота (IV) является веществом с двойственной окислительно-восстановительной функцией.
Решение. Азот в NO2 находится в промежуточной степени окисления +4, и может как повышать степень окисления (быть восстановителем), так и понижать ее (быть окислителем).
Для NO2 наиболее характерны окислительные свойства, которые проявляются в газовой фазе при нагревании:
2NO2 + C = CO2 + 2NO
или в водном растворе:
SO2 + NO2 + H2O = H2SO4 + NO.
Восстановительные свойства SO2 проявляет в реакции с кислородом:
4NO2 + O2 + 2H2O = 4HNO3 .
Задача 115. В трех пробирках без этикеток находятся концентрированные растворы кислот: H2SO4, HNO3, HCl. Как с помощью одного реактива определить, в какой пробирке какая кислота находится?
Решение. Данный реактив – малоактивный металл, например, серебро. Концентрированная азотная кислота растворяет серебро с выделением бурого газа:
Ag + 2HNO3(конц) = AgNO3 + NO2 + H2O.
Концентрированная серная кислота растворяет серебро с выделением бесцветного газа:
2Ag + 2H2SO4(конц) = Ag2SO4 + SO2 + 2H2O.
Соляная кислота не реагирует с серебром, которое стоит в ряду напряжений правее водорода.
Задача 116. Напишите уравнения химических реакций, соответствующие следующей схеме:
t Pt, H2 Pt, O2 O2 NaOH t
(NH4)2Cr2O7 A Б B Г Д Е
(газ) t t (тв)
Решение. Дихромат аммония при нагревании разлагается:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O.
Газообразный азот (вещество А) в присутствии платины обратимо реагирует с водородом с образованием аммиака (вещество Б):
N2 + 3H2 = 2NH3 .
Окисление аммиака в присутствии платины приводит к оксиду азота (II) (вещество В):
4NH3 + 5O2 = 4NO + 6H2O.
При обычных температурах оксид азота (II) окисляется кислородом с образованием оксида азота (IV):
2NO + O2 = 2NO2 .
Оксид азота (IV) (вещество Г) реагирует с раствором щелочи с образованием солей азотистой и азотной кислот:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O.
Нитрат натрия (вещество Д) при нагревании разлагается на кислород и нитрит натрия (вещество Е):
2NaNO3 = 2NaNO2 + O2.
Задача 117. Известно, что 40 мл раствора, содержащего нитрат меди (II) и серную кислоту, могут прореагировать с 25,4 мл 16,0%-ного раствора гидроксида натрия (плотность раствора 1,18 г/мл), а прокаливание выпавшего при этом осадка дает 1,60 г твердого вещества. Вычислите концентрации (в моль/л) нитрата меди (II) и серной кислоты в исходном растворе, а также объем газа (при н.у.), который выделяется при внесении 2,5 г порошкообразной меди в 40 мл этого раствора.
Решение. Запишем уравнения реакций:
H2SO4 + 2NaOH = Na2SO4 + 2H2O,
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3,
t
Cu(OH)2 = CuO + H2O.
По этим уравнениям можно определить состав исходного раствора.
(CuO) = 1,6 / 80 = 0,02 моль,
(Cu(NO3)2) = (Cu(OH)2) = (CuO) = 0,02 моль,
(NaOH) = 25,41,180,160 / 40 = 0,12 моль.
На реакцию с Cu(NO3)2 расходуется 0,022 = 0,04 моль NaOH, оставшиеся 0,12–0,04 = 0,08 моль NaOH реагируют с H2SO4.
(H2SO4) = 0,08 / 2 = 0,04 моль.
C(Cu(NO3)2) = 0,02 / 0,04 = 0,5 моль/л,
C(H2SO4) = 0,04 / 0,04 = 1 моль/л.
Известно, что кислые растворы нитратов способны растворять металлы аналогично разбавленной азотной кислоте. В частности, медь растворяется в данном растворе с образованием NO. Для того, чтобы определить количество выделившегося газа, запишем уравнение реакции в сокращенной ионной форме:
3Cu + 8H+ + 2NO3– = 3Cu2+ + 2NO + 4H2O.
Избыток-недостаток определим по количеству молей реагентов:
(Cu) = 2,5 / 64 = 0,0391 моль,
(H+) = 2(H2SO4) = 0,08 моль,
(NO3–) = 2(Cu(NO3)2) = 0,04 моль.
С учетом коэффициентов ионной реакции оказывается, что в недостатке находятся ионы H+, поэтому:
(NO) = (H+) / 4 = 0,02 моль, V(NO) = 0,02 22,4 = 0,448 л.
Ответ. 0,5 M Cu(NO3)2, 1 M H2SO4; 0,448 л NO.
Задача 118. Массовая доля фосфора в одном из его оксидов равна 56,36%. Плотность паров этого вещества по воздуху равна 7,58. Установите молекулярную формулу оксида.
Решение. Пусть формула оксида PxOy. Возьмем 100 г оксида и найдем количества элементов: (P) = 56,36 / 31 = 1,818 моль, (O) = 43,64 / 16 = 2,728 моль.
(P) : (O) = x : y = 1,818 : 2,728 = 2 : 3.
Простейшая формула оксида P2O3.
Молярную массу оксида определяем по плотности паров. M(PxOy) = 297,58 = 220 г/моль. Простейшая формула P2O3 соответствует молярной массе 110 г/моль. Следовательно, молекулярная формула оксида в парах равна удвоенной простейшей формуле P4O6.
Ответ. P4O6.
Задача 119. Составьте уравнения химических реакций, позволяющих осуществить следующие превращения:
P P2O5 H3PO4 Ca3(PO4)2 H3PO4 .
Решение. При сжигании фосфора в избытке кислорода образуется оксид фосфора (V):
4P + 5O2 = 2P2O5 .
Оксид фосфора (V) с избытком воды образует фосфорную кислоту:
P2O5 + 3H2O = 2H3PO4 .
Фосфат кальция получается из фосфорной кислоты под действием избытка известковой воды:
2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2 + 6H2O.
Фосфорная кислота образуется из фосфата кальция под действием сильных кислот, например, серной:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 .
Задача 120. Напишите уравнения химических реакций, соответствующих следующей схеме:
SiO2+C Ca HCl O2 Ca3(PO4)2
Ca3(PO4)2 А Б В Г Д
1200 oC t
Решение. Первая реакция — промышленный способ получения фосфора (вещество А):
Ca3(PO4)2 + 3SiO2 + 5C = 2P + 5CO + 3CaSiO3.
Фосфор реагирует при нагревании с кальцием с образованием фосфида кальция Ca3P2 (вещество Б):
3Ca + 2P = Ca3P2.
Фосфид кальция разлагается водой и кислотами, образуя газ фосфин PH3 (вещество В):
Ca3P2 + 6HCl = 3CaCl2 + 2PH3.
При сгорании фосфина образуются P2O5 и H2O, которые сразу же реагируют между собой, давая фосфорную кислоту (вещество Г):
PH3 + 2O2 = H3PO4.
Фосфорная кислота растворяет фосфат кальция с образованием дигидрофосфата кальция Ca(H2PO4)2 (вещество Д):
4H3PO4 + Ca3(PO4)2 = 3Ca(H2PO4)2.
Задача 121. Для полной нейтрализации раствора, полученного при гидролизе 1,23 г некоторого галогенида фосфора, потребовалось 35 мл раствора гидроксида калия с концентрацией 2 моль/л. Определите формулу галогенида.
Решение. Галогениды фосфора могут иметь формулу PX3 или PX5 (X — атом галогена). При их гидролизе образуется галогеноводородная кислота и фосфористая или фосфорная кислота:
1 моль 1 моль 3 моль
PX3 + 3H2O = H3PO3 + 3HX
1 моль 1 моль 5 моль
PX5 + 4H2O = H3PO4 + 5HX
Для полной нейтрализации продуктов гидролиза 1 моля PX3 потребуется 5 моль KOH (H3PO3 — двухосновная кислота):
1 моль 2 моль
H3PO3 + 2KOH = K2HPO3 + 2H2O
3 моль 3 моль
HX + KOH = KX + H2O
Аналогично, для полной нейтрализации продуктов гидролиза 1 моля PX5 потребуется 8 моль KOH:
1 моль 3 моль
H3PO4 + 3KOH = K3PO4 + 3H2O
5 моль 5 моль
HX + KOH = KX + H2O
(KOH) = c V = 2 моль/л 0,035 л = 0,07 моль.
Рассмотрим сначала вариант галогенида фосфора (III):
(PX3) = (KOH) / 5 = 0,014 моль,
M(PX3) = m / = 1,23 г / 0,014 моль = 88 г/моль,
A(X) = (88 – 31) / 3 = 19 г/моль.
X — фтор, искомый галогенид — PF3.
В случае галогенида фосфора (V):
(PX5) = (KOH) / 8 = 0,00875 моль,
M(PX5) = m / = 1,23 г / 0,00875 моль = 140,6 г/моль,
A(X) = (140,6 – 31) / 5 = 21,9 г/моль — не подходит.
Ответ. PF3.
