
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •§ 1.1. Задачи с решениями
- •§ 1.2. Задачи для самостоятельного решения
- •1.2.1. Задачи на расчет числа молей
- •1.2.2. Задачи на определение формул веществ
- •1.2.3. Расчеты по химическим уравнениям
- •1.2.4. Задачи на смеси
- •1.2.5. Задачи на газовые законы
- •Глава 2. Строение атома и периодический закон
- •§ 2.1. Задачи с решениями
- •§ 2.2. Задачи для самостоятельного решения
- •2.2.1. Электронные конфигурации и Периодическая система
- •2.2.2. Изотопы и радиоактивные превращения
- •Глава 3. Химическая связь
- •§ 3.1. Задачи с решениями
- •§ 3.2. Задачи для самостоятельного решения
- •3.2.1. Типы химической связи и их характеристики
- •3.2.2. Валентность. Степени окисления элементов. Геометрическая структура молекул.
- •3.2.3. Строение и свойства вещества
- •Глава 4. Закономерности протекания химических реакций
- •§ 4.1. Задачи с решениями
- •§ 4.2. Задачи для самостоятельного решения
- •4.2.1. Энергетика химических превращений
- •4.2.2. Химическая кинетика и катализ
- •4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
- •Глава 5. Растворы электролитов и неэлектролитов
- •§ 5.1. Задачи с решениями
- •§ 5.2. Задачи для самостоятельного решения
- •5.2.1. Способы выражения концентрации растворов
- •5.2.2. Ионные реакции в растворах
- •Глава 6. Окислительно-восстановительные процессы. Ряд напряжений. Электролиз растворов и расплавов.
- •§ 6.1. Задачи с решениями
- •§ 6.2. Задачи для самостоятельного решения
- •6.2.1. Окислители и восстановители
- •6.2.2. Составление уравнений овр и подбор коэффициентов
- •6.2.3. Влияние pH среды на характер протекания овр
- •6.2.4. Электрохимический ряд напряжений
- •6.2.5. Электролиз растворов и расплавов
- •Часть II. Неорганическая химия
- •Глава 7. Номенклатура, классификация, свойства и способы получения неорганических веществ
- •§ 7.1. Задачи с решениями
- •§ 7.2. Задачи для самостоятельного решения
- •7.2.1. Важнейшие классы неорганических соединений
- •7.2.2. Классификация химических реакций
- •7.2.3. Гидролиз солей
- •Глава 8. Водород. Галогены.
- •§ 8.1. Задачи с решениями
- •§ 8.2. Задачи для самостоятельного решения
- •8.2.1. Водород
- •8.2.2. Галогены и их соединения
- •Глава 9. Элементы подгруппы кислорода
- •§ 9.1. Задачи с решениями
- •§ 9.2. Задачи для самостоятельного решения
- •9.2.1. Кислород и его соединения
- •9.2.2. Сера и ее соединения
- •Глава 10. Подгруппа азота и фосфора
- •§ 10.1. Задачи с решениями
- •§ 10.2. Задачи для самостоятельного решения
- •10.2.1. Азот и его соединения
- •10.2.2. Фосфор и его соединения
- •Глава 11. Подгруппа углерода и кремния
- •§ 11.1. Задачи с решениями
- •§ 11.2. Задачи для самостоятельного решения
- •11.2.1. Углерод и его соединения
- •11.2.2. Кремний и его соединения
- •Глава 12. Металлы главных подгрупп (щелочные, щелочноземельные, алюминий)
- •§ 12.1. Задачи с решениями
- •§ 12.2. Задачи для самостоятельного решения
- •12.2.1. Щелочные металлы
- •12.2.2. Щелочноземельные металлы
- •12.2.3. Алюминий и его соединения
- •Глава 13. Главные переходные металлы
- •§ 13.1. Задачи с решениями
- •§ 13.2. Задачи для самостоятельного решения
- •13.2.1. Железо и его соединения
- •13.2.2. Медь и ее соединения
- •13.2.3. Серебро и его соединения
- •13.2.4. Хром и его соединения
- •13.2.5. Марганец и его соединения
- •Часть III. Органическая химия
- •Глава 14. Общая характеристика органических соединений
- •§ 14.1. Задачи с решениями
- •§ 14.2. Задачи для самостоятельного решения
- •Глава 15. Предельные углеводороды
- •§ 15.1. Задачи с решениями
- •§ 15.2. Задачи для самостоятельного решения
- •15.2.1. Строение, номенклатура, изомерия
- •15.2.2. Получение
- •15.2.3. Химические свойства
- •Глава 16. Углеводороды с двойной связью
- •§ 16.1. Задачи с решениями
- •§ 16.2. Задачи для самостоятельного решения
- •16.2.1. Строение, номенклатура, изомерия
- •16.2.2. Получение
- •16.2.3. Химические свойства
- •Глава 17. Алкины
- •§ 17.1. Задачи с решениями
- •§ 17.2. Задачи для самостоятельного решения
- •17.2.1. Строение, номенклатура, изомерия
- •17.2.2. Получение
- •17.2.3. Химические свойства
- •Глава 18. Ароматические углеводороды (арены)
- •§ 18.1. Задачи с решениями
- •§ 18.2. Задачи для самостоятельного решения
- •18.2.1. Строение, номенклатура, изомерия
- •18.2.2. Получение
- •18.2.3. Химические свойства
- •Глава 19. Спирты. Фенолы
- •§ 19.1. Задачи с решениями
- •§ 19.2. Задачи для самостоятельного решения
- •19.2.1. Строение, номенклатура, изомерия
- •19.2.2. Получение
- •19.2.3. Химические свойства
- •Глава 20. Альдегиды. Кетоны
- •§ 20.1. Задачи с решениями
- •§ 20.2. Задачи для самостоятельного решения
- •20.2.1. Строение, номенклатура, изомерия
- •20.2.2. Получение
- •20.2.3. Химические свойства
- •Глава 21. Карбоновые кислоты и их производные
- •§ 21.1. Задачи с решениями
- •§ 21.2. Задачи для самостоятельного решения
- •21.2.1. Строение, номенклатура, изомерия карбоновых кислот
- •21.2.2. Получение карбоновых кислот
- •21.2.3. Химические свойства карбоновых кислот
- •21.2.4. Сложные эфиры
- •21.2.5. Жиры
- •Глава 22. Углеводы
- •§ 22.1. Задачи с решениями
- •§ 22.2. Задачи для самостоятельного решения
- •22.2.1. Моносахариды
- •Глава 23. Амины
- •§ 23.1. Задачи с решениями
- •§ 23.2. Задачи для самостоятельного решения
- •23.2.1. Строение, номенклатура, изомерия
- •23.2.2. Получение
- •23.2.3. Химические свойства
- •Глава 24. Аминокислоты и пептиды
- •§ 24.1. Задачи с решениями
- •§ 24.2. Задачи для самостоятельного решения
- •24.2.1. Строение и изомерия
- •24.2.2. Получение и химические свойства
- •Глава 25. Азотсодержащие гетероциклические соединения
- •§ 25.1. Задачи с решениями
- •§ 25.2. Задачи для самостоятельного решения
- •25.2.1. Гетероциклические основания
- •25.2.2. Нуклеиновые кислоты
- •Часть IV варианты вступительных экзаменов
- •Глава 26. Вступительные экзамены в Московском государственном университете
- •Глава 27. Вступительные экзамены в Московской медицинской академии
- •Глава 28. Решения избранных вариантов вступительных экзаменов
4.2.2. Химическая кинетика и катализ
229. От каких факторов зависит скорость а) гомогенной, б) гетерогенной химической реакции?
230. В результате некоторой реакции в единице объема в единицу времени образовалось 3,4 г аммиака, а в результате другой реакции в тех же условиях — 3,4 г фосфина. Одинаковы ли скорости этих реакций? Ответ поясните.
231. Определите среднюю скорость химической реакции CO2 + H2 = CO + H2O, если через 80 с после начала реакции молярная концентрация воды была равна 0,24 моль/л, а через 2 мин 07 с стала равна 0,28 моль/л.
232. Как изменится скорость образования оксида азота (IV) в соответствии с реакцией: 2NO + O2 <=> 2NO2, если давление в системе увеличить в 3 раза, а температуру оставить неизменной?
233. Скорость некоторой реакции увеличивается в 2,5 раза при повышении температуры на каждые 10 C в интервале от 0 до 60 C. Во сколько раз увеличится скорость при повышении температуры от 20 до 45 C?
234. Как действует катализатор на химическое равновесие?
235. Растворение образца железа в серной кислоте при 20 C заканчивается через 15 минут, а при 30 C такой же образец металла растворяется за 6 минут. За какое время данный образец железа растворится при 35 C?
236. При увеличении температуры от 0 C до 13 C скорость некоторой реакции возросла в 2,97 раза. Чему равна энергия активации этой реакции?
237. В каком из двух случаев скорость реакции увеличится в большее число раз: при нагревании от 0 C до 11 C или при нагревании от 11 C до 22 C? Ответ обоснуйте с помощью уравнения Аррениуса.
Рис.
3. Соотношение между энергией активации
и изменением теплового эффекта реакции.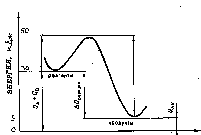
Рис.
4. Снижение энергии активации при
каталитической реакции.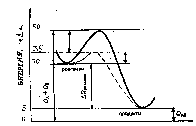
240. Энергия активации некоторой реакции в отсутствие катализатора равна 80 кДж/моль, а в присутствии катализатора энергия активации уменьшается до значения 53 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при 20 С?
241. Кинетические измерения показали, что скорость реакции 2NO + O2 = 2NO2 описывается уравнением:
v = kCNO2CO2.
Определите, в каком молярном отношении надо ввести NO и O2 в реакцию, чтобы скорость реакции была максимальной.
4.2.3. Обратимые и необратимые реакции. Состояние химического равновесия.
242. Как будет влиять увеличение температуры на состояние равновесия в следующих реакциях: а) H2 + Cl2 <==> 2HCl + Q; б) H2 + I2 <==> 2HI – Q?
243. Как будет влиять увеличение давления на состояние равновесия в следующих реакциях: а) H2 + Br2 <==> 2HBr; б) 2NO + O2 <==> 2NO2; в) N2O4 <==> 2NO2?
244. Какие факторы способствуют смещению равновесия в сторону образования продуктов в реакциях:
а) CO2(г) + C(тв) <==> 2CO – 72,6 кДж;
б) Fe2O3(тв) + 3H2(г) <==> 2Fe(тв) + 3H2O(г) – 89,6 кДж;
в) H2(г) + S(ж) <==> H2S(г) + 20,9 кДж?
245. Рассчитайте константу равновесия при некоторой заданной температуре для обратимой реакции CO + H2O <==> CO2 + H2, учитывая, что в состоянии равновесия концентрации участвующих в реакции веществ были равны: [CO] = 0,16 моль/л, [H2O] = 0,32 моль/л, [CO2] = 0,32 моль/л, [H2] = 0,32 моль/л.
246. Для каких из указанных реакций уменьшение объема сосуда приведет к смещению равновесия в том же направлении, что и понижение температуры:
а) N2 + O2 <==> 2NO – Q;
б) CO2 + C(тв) <==> 2CO – Q;
в) 2CO + O2 <==> 2CO2 + Q;
г) CO + H2O(г) <==> CO2 + H2 + Q?
247. Равновесие реакции N2 + 3H2 <==> 2NH3 устанавливается при следующих концентрациях участвующих в них веществ: [N2] = 0,01 моль/л, [H2] = 2,0 моль/л, [NH3] = 0,4 моль/л. Вычислите константу равновесия и исходные концентрации азота и водорода.
248. В 0,2 М растворе фосфористой кислоты H3PO3 концентрация ионов H+ равна 0,05 М. Вычислите константу диссоциации H3PO3, предполагая, что второй протон не отщепляется.
249. Обратимая реакция описывается уравнением: A + B <==> 2C. Смешали по одному молю всех веществ. После установления равновесия в смеси обнаружено 1,5 моль вещества C. Найти константу равновесия.
250. Дана схема превращений:
![]()
которая описывает образование тио- и изотиомочевины при нагревании роданида аммония. В начальный момент времени концентрации веществ равны: [A] = a моль/л, [B] = [C] = 0. Константа равновесия в последней реакции K > 1. На одном графике изобразите (качественно) зависимости концентраций всех веществ от времени.
251. Рассчитайте равновесные концентрации веществ, участвующих в реакции CO + H2O CO2 + H2, если исходные концентрации веществ равны: [CO] = 0,1 моль/л, [H2O] = 0,4 моль/л, а константа равновесия при данной температуре равна 1.
252. Концентрация аммиака в замкнутом сосуде при 0 C равна 1 моль/л. При нагревании сосуда до 546 C давление внутри увеличилось в 3,3 раза. Определите константу равновесия для реакции разложения аммиака при 546 C.
253. Как изменится массовая доля хлорида калия в насыщенном водном растворе, находящемся в равновесии с кристаллами соли, при а) повышении температуры, б) повышении давления, в) введении в раствор твердого нитрата калия, если при 10 C массовая доля соли в насыщенном растворе равна 23,8%, плотности насыщенного раствора, кристаллов соли и воды равны, соответственно, 1,16, 1,99 и 0,999 г/см3, а образование 100 мл насыщенного раствора из кристаллов и воды сопровождается поглощением 1,6 кДж теплоты?
254. При нагревании до некоторой температуры 36 г уксусной кислоты и 7,36 г 100%-ного этанола в присутствии серной кислоты получена равновесная смесь. Эта смесь при действии избытка раствора хлорида бария образует 4,66 г осадка, а при действии избытка раствора гидрокарбоната калия выделяет 12,1 л оксида углерода (IV) (при норм. усл.). Найдите количество сложного эфира (в молях) в равновесной смеси, которая образуется при нагревании до той же температуры 150 г уксусной кислоты и 200 мл 90%-ного этанола (плотность 0,82 г/мл) в присутствии серной кислоты в качестве катализатора.
255. Один моль смеси этилена с водородом, имеющей плотность по водороду 9, нагрели в замкнутом сосуде с платиновым катализатором при 350 С, при этом давление в сосуде уменьшилось на 20%. Рассчитайте выход реакции в % от теоретического. На сколько процентов уменьшится давление в сосуде, если для проведения эксперимента в тех же условиях использовать один моль смеси тех же газов, имеющей плотность по водороду 10?
256. Оксид углерода (II) смешали с водородом в молярном отношении 1:4 при давлении 10 МПа и температуре 327 C в замкнутом реакторе, предназначенном для синтеза метанола. После окончания процесса давление газов в реакторе при неизменной температуре уменьшилось на 10%. Определите объемную долю паров метанола в реакционной смеси и процент превращения оксида углерода (II) в метанол.
257. Плотность по пропану газовой смеси, состоящей из этилена и паров воды, до пропускания через контактный аппарат для синтеза этанола была равна 0,5, а после пропускания стала равна 0,6. Определите объемную долю паров этанола в реакционной смеси и процент превращения этилена в этанол.
258. Смесь формальдегида и водорода имеет плотность по гелию 2,6. После пропускания этой смеси над нагретым катализатором и охлаждения газовой смеси ее плотность по гелию составила 1,2. Рассчитайте выход продукта реакции.
259. Смесь аммиака и метиламина, в которой на 1 атом азота приходится 4 атома водорода, поместили в реактор с 9-кратным объемом кислорода. Герметически закрытый реактор нагрели, после полного завершения реакции горения реактор охладили до первоначальной температуры. Как изменилось давление в реакторе?
260. Смесь уксусного альдегида и водорода с относительной плотностью по воздуху 0,475 пропустили над нагретым никелевым катализатором. Реакция прошла с выходом 47,5%. Вычислите плотность по водороду газовой смеси на выходе из реактора.
