
- •Министерство образования и науки российской федерации
- •Госпитальная терапия
- •Удк 616. 1/.9
- •Отв. Редактор: д-р мед. Наук, профессор в.Н. Саперов
- •Предисловие
- •Введение
- •Глава 1 Дыхательная недостаточность. Легочная гипертензия. Легочное сердце. Хроническое легочное сердце
- •Дыхательная недостаточность
- •Лёгочная гипертензия
- •Диагностика компенсированного хронического лёгочного сердца. Диагностика компенсированного хлс – это выявление гипертрофии и дилатации правого желудочка, а также лг.
- •Глава 2 Эмфизема легких
- •Окончание табл. 1
- •Окончание табл. 4
- •Глава 3 Миокардиты
- •Глава 4 Симптоматические артериальные гипертонии
- •Классификация симптоматических гипертоний (г.Г. Арабидзе, 1982)
- •Гемодинамические гипертонии
- •Глава 5 Нарушение сердечного ритма и проводимости
- •Классификация нарушений сердечного ритма
- •Нарушения образования ритма:
- •II. Нарушение проводимости:
- •III. Комбинированные нарушения ритма:
- •Нарушения функции проводимости, или блокады сердца
- •Глава 6 Нейроциркуляторная дистония
- •Глава 7 Ревматоидный артрит
- •Окончание табл. 7
- •Окончание табл. 11
- •Продолжение табл. 12
- •Окончание табл. 12
- •Окончание табл. 13
- •Глава 8 Остеоартроз. Подагра
- •Окончание табл. 16
- •Окончание табл. 17
- •Окончание табл. 21
- •Глава 9 Системная красная волчанка. Дерматомиозит
- •Сосудистый тромбоз
- •Акушерская патология
- •Окончание табл. 27
- •Глава 10 Системная склеродермия
- •Окончание табл. 30
- •Окончание табл. 31
- •Глава 11
- •Системные васкулиты.
- •Классический узелковый полиартериит.
- •Микроскопический полиангиит. Синдром Чарга–Стросса
- •Васкулиты с преимущественным поражением сосудов мелкого калибра:
- •Смешанные состояния:
- •Глава 12 Язвенный колит. Болезнь Крона
- •Глава 13 Амилоидоз. Нефротический синдром
- •Окончание табл. 44
- •Глава 14 Хронический пиелонефрит
- •Глава 15 Железодефицитные и витамин в12-, фолиеводефицитные анемии
- •Глава 16 Гемолитические анемии
- •Глава 17 Миеломная болезнь
- •Заключение
- •Список рекомендуемой литературы
- •Список сокращений
- •Оглавление
Окончание табл. 21
|
Препарат |
Действующее вещество |
Дозы, схемы применения |
|
Румалон |
Сульфатированный гликозаминогликан-пептидный комплекс, ампулы по 1 и 2 мл |
Внутримышечно по 0,3-0,5 мл с интервалом в 2 дня, затем – по 1-2 мл 2-3 раза в неделю, на курс 25-30 мл |
|
Препараты гиалуроновой кислоты* |
Низкомолекулярные: гиалган (Mr** 0,5-0,7 млн Д), ферматрон (Mr1,1 млн Д), остенил (Mr1,2 млн Д). Высокомолекулярные: синвиск (Mr6 млн. Д) |
4 внутрисуставных инъекции по 2 мл с интервалом 7 дней
3 внутрисуставных инъекции по 2 мл с интервалом 7 дней |
|
Алфлутоп |
Экстракт из 4 видов мелких морских рыб, в его состав входят гликозаминогликаны, низкомолекулярные по-липептиды, свободные аминокислоты, микроэлементы, раствор для инъекций по 1 мл (10 мг) |
Глубоко внутримышечно по 1 мл ежедневно на протяжении 20 дней; внутрисуставно по 2 мл 1 раз в 3 дня (6 инъекций) с последующим внутримышечным введением (см. выше); паравертебрально по 1 мл с каждой стороны 1 раз в 2-3 дня (5 инъекций) с последующим внутримышечным введением (см. выше) |
|
Примечание: * – введение этих препаратов в полость пораженного сустава вызывает улучшение вязкоэластичных и защитных свойств синовиальной жидкости, уменьшение воспалительной реакции, снижение интенсивности болевого синдрома, улучшение подвижности сустава, восстановление гомеостаза в пораженном хряще, стимуляцию синтеза нативного гиалуроната; ** – молекулярный вес. | ||
Для улучшения внутрикостного крвообращения используют блокаторы кальциевых каналов, теоникол, венорутон, троксевазин, никошпан, а также препараты, улучшающие микроциркуляцию, – курантил, трентал. При болевом синдроме, связанном со спазмом мышц, используют миорелаксанты – баклофен, мидокалм, скутамил С, сирдалуд.
У больных гонартрозом при наличии суставного выпота проводятся внутрисуставные введения пролонгированных кортикостероидов (бетаметазон, триамцинолон, метилпреднизолона ацетат). Клинически, помимо боли, в этих случаях имеются утренняя скованность до 30-60 мин, умеренная припухлость окружающих сустав тканей. Наличие синовита может быть подтверждено при ультразвуковом исследовании суставов. Продолжительность эффекта от интраартикулярного введения ГКС при ОА невелика и варьирует от 1 до 3-4 недель (Е.Л. Насонов, Н.В. Чичасова, 1998). Основным механизмом, лежащим в основе биологической активности этих препаратов, является подавление транскрипции (считывания генной информации) генов: провоспалительных цитокинов, металлопротеаз и ЦОГ-2. В настоящее время считается, что число внутрисуставных введений в один сустав не должно превышать 3-4 на протяжении одного года (ввиду отрицательного влияния глюкокортикоидов на метаболизм артрозного хряща).
При неэффективности консервативной терапии рассматривается вопрос о хирургическом лечении ОА, которое включает в себя артроскопические операции, остеотомии и тотальное замещение суставов.
Эндопротезирование эффективно почти в 90 % случаев, и «выживаемость» искусственного сустава в течение 10 лет наблюдается у 90-95 % больных, что, безусловно, способствует улучшению качества жизни больных с тяжелым ОА суставов нижних конечностей, особенно тазобедренного. Кроме того, разрабатываются новые методы хирургического лечения (алло- и аутологичная трансплантация хряща и клеток), направленные скорее на предотвращение развития заболевания, особенно после травмы, чем на лечение поздних стадий болезни.
Подагра– системное тофусное заболевание, развивающееся в связи с воспалением в органах и системах в местах отложения кристаллов моноурата натрия у людей с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами (В.А. Насонова, В.Г. Барскова, 2003).
Подагра является наиболее распространенным и известным (еще с античного периода) заболеванием из группы микрокристаллических артритов, для которых характерны выпадение кристаллов в синовиальную жидкость, импрегнация ими суставных и околосуставных тканей, развитие синовитов.
Считается классическим утверждение, что подагрой болеют преимущественно мужчины в возрасте 40-50 лет, однако обращено внимание на возможность развития подагры у женщин в постменопаузальном периоде. При этом если еще 20 лет тому назад на 20 заболевших мужчин регистрировалась 1 женщина, обычно в возрасте 60-65 лет, то к концу XXстолетия в США было отмечено 7-кратное увеличение распространенности подагры не только у мужчин, но и у женщин. Реальными причинами этого могут служить: увеличение продолжительности жизни, значительное повышение ее уровня и связанное с этим нарушение питания, а ускорение ритма жизни и нарастание ее напряженности способствуют росту потребления алкоголя (В.А. Насонова, В.Г. Барскова, 2004).
Нормальный обмен мочевой кислоты. В организме человека мочевая кислота является конечным продуктом расщепления пуринов. Запасы мочевой кислоты в организме составляют в норме около 1000 мг при скорости их обновления в пределах 650 мг/сут, т.е. ежесуточно из запасов убывает 650 мг мочевой кислоты и столько же пополняется. Поскольку мочевая кислота выделяется из организма почками, важно знать ее клиренс – объем крови, который может очиститься в почках от избытка мочевой кислоты за минуту. В норме он составляет 9 мл/мин.
Источником образования мочевой кислоты в организме являются пуриновые основания, которые поступают с пищей, а также образующиеся в организме в процессе обмена нуклеотидов.
Синтез пуринов начинается в организме с того, что из молекулы фосфорибозилпирофосфата и глутамина под влиянием фермента аминотрансферазы образуется фосфорибозиламин. Из этого соединения после ряда реакций образуется первый пуриновый нуклеотид – инозиновая кислота, значительная часть которой превращается в пуриновые нуклеотиды нуклеиновых кислот – адениловую и гуаниловую кислоты, которые в основном идут на построение нуклеиновых кислот. Однако часть адениловой и гуаниловой кислот катаболизируется, превращаясь в простые пурины: гуанин, ксантин и другие, которые под влиянием фермента ксантиноксидазы превращаются в мочевую кислоту, большая же их часть при участии фермента гипоксантингуанинфосфорибозилтрансферазы (ГГФТ) вновь образует гуаниловую кислоту. Таким образом, непосредственными предшественниками мочевой кислоты являются пурины – гуанин и ксантин (цит. по В.А. Насоновой, М.Г. Астапенко, 1989).
Различают первичную и вторичную подагру. Вторичная подагра является лишь одним из синдромов другого заболевания, при котором по тем или иным причинам возникают нарушения метаболизма мочевой кислоты. При первичной подагре заболевания, служащего причинным фактором гиперурикемии, не обнаруживается.
Причины развития первичной и вторичной подагры разнообразны и могут быть сведены к трем механизмам: 1) обусловленные повышенным образованием мочевой кислоты; 2) вызванные замедлением выведения уратов почками и 3) комбинацией этих нарушений. Ниже приведены основные причины развития гиперурикемии (цит. по В.А. Насоновой, Н.В. Бунчуку, 1997), при этом звездочкой отмечены те заболевания, при которых преимущественно отмечается повышенное содержание мочевой кислоты в крови, а подагра не развивается или редка.
Причины повышенного образования мочевой кислоты:
Истинная полицитемия, вторичная полицитемия у больных с врожденными «синими» пороками сердца и с хроническими заболеваниями легких.
Острые и хронические лейкозы, миеломная болезнь, лимфомы, карцинома почек и другие злокачественные опухоли*.
Гиперпаратиреоз*.
Псориаз (гиперурикемия связана с площадью поражения кожи)*.
Гемоглобинопатия (серповидно-клеточная анемия, талассемия и др.), врожденная гемолитическая анемия, пернициозная анемия и другие мегалобластные анемии*.
Некоторые врожденные дефекты коагуляции (болезнь Виллебранда)*.
Болезнь Гоше*.
Инфекционный мононуклеоз (гиперурикемия обычна в первые 10 дней болезни)*.
Гликогеноз I,III,V,VIIтипа*.
Гипоксемия.
Значительная перегрузка скелетных мышц.
Избыточное употребление в пищу продуктов, богатых пуринами. Злоупотребление алкогольными напитками.
Причины замедления выведения мочевой кислоты почками:
Хроническая почечная недостаточность (ХПН)*.
Заболевания почек, не сопровождающиеся ХПН, характеризующиеся преимущественно интерстициальными (канальцевыми) изменениями (поликистоз почек, анальгетическая нефропатия, гидронефроз); кетоацидоз; ацидоз, обусловленный избытком молочной кислоты.
Прием диуретических средств.
Обезвоживание.
Бериллиоз.
Другие (не вполне выясненные) причины:
Свинцовая интоксикация (в том числе использование суррогатов алкогольных напитков, контакт с красителями, использование керамической посуды).
Гипопаратиреоз*.
Саркоидоз*.
Гипотиреоз*.
Прием салицилатов в небольших дозах, циклоспорина, пиразинамида, этамбутола*.
Артериальная гипертензия.
Первичная гиперурикемия – наиболее частая причина первичной подагры. Большинство авторов характеризуют ее как конституциональный диспуринизм, то есть как семейно-генетическую аномалию пуринового обмена, детерминированную, по-видимому, несколькими генами. Практически это подтверждается тем, что у 1/3 больных подагрой имеются родственники (чаще отец или брат), страдающие подагрой, а у 20 % членов семей больных обнаруживается гиперурикемия. Основную роль в патогенезе первичной гиперурикемии играют генетически обусловленные нарушения в системе ферментов, в первую очередь недостаточность фермента, принимающего участие в ресинтезе нуклеотидов из пуринов. Понижение активности этого фермента приводит к недостаточному использованию в организме пуринов и, таким образом, к повышенному образованию мочевой кислоты. Такой тип гиперурикемии характерен для синдрома Леша–Найхена. Повышенное образование пуринов может произойти под влиянием высокой активности фермента фосфорибозилпирофосфатазы, которая участвует в синтезе предшественника пуринов.
По мнению большинства авторов, механизмы, ответственные за усиленный синтез мочевой кислоты у больных первичной подагрой, многофакторны и до настоящего времени недостаточно изучены. То же самое можно сказать относительно второго главного механизма первичной гиперурикемии – нарушения выделения мочевой кислоты почками. Известно, что мочекислый натрий (ураты) полностью фильтруется в почечных клубочках и полностью реабсорбируется в проксимальном отделе канальцев, а затем почти половина его ресекретируется дистальными отделами и только 10 % экскретируется с мочой (канальцевая секреция уратов прогрессивно увеличивается по мере увеличения содержания мочевой кислоты в сыворотке крови). Но у некоторых больных подагрой гиперурикемия развивается в связи с неспособностью почек компенсировать уратную нагрузку увеличением канальцевой экскреции (почечный тип первичной гиперурикемии). Однако механизм, который вызывает изменение активной экскреции уратов почками, до сих пор не известен.
Основным механизмом развития подагры является длительная гиперурикемия, в ответ на которую в организме возникает ряд приспособительных реакций, направленных на снижение содержания мочевой кислоты в крови в виде повышения выделения мочевой кислоты почками и отложения уратов в тканях.
Классический патогенез подагрывключает ряд этапов:
увеличение синтеза и/или уменьшение выведения мочевой кислоты;
развитие гиперурикемии;
отложение уратов (преимущественно в аваскулярных тканях);
фагоцитоз уратов нейтрофилами;
разрушение нейтрофилов с выбросом лизосомальных ферментов и медиаторов воспаления;
развитие воспаления (артрита).
Схема патогенеза подагрического артрита представлена на рис. 15.
Причины, самоограничивающие течение острого подагрического артрита, до конца не ясны, но, вероятнее всего, связаны с синтезом «антивоспалительных» медиаторов (рецепторный антагонист ИЛ-1, трансформирующий фактор роста β и др.).
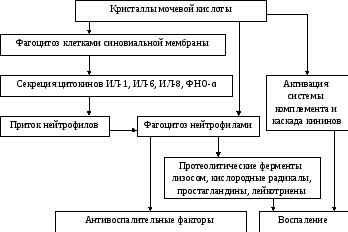
Рис. 15. Схема патогенеза подагрического артрита (цит. по В.И. Мазурову и соавт., 2001)
Гиперурикемия может длительное время протекать без каких-либо субъективных и объективных симптомов и лишь случайно диагностироваться при обследовании пациента (так называемая бессимптомная гиперурикемия). Однако она не столь безобидна, как это может показаться на первый взгляд, и нередко ассоциируется с нарушениями жирового и углеводного обменов, а также, что еще более серьезно, приводит к уратной нефропатии. Следует отметить условность дефиниции «асимптоматическая подагра». Для ее выявления необходимо повторно исследовать уровень мочевой кислоты, особенно у «подагрической личности», т.е. у мужчин молодого возраста с пристрастием к алкоголю, ожирением и артериальной гипертонией. Также следует иметь в виду, что гиперурикемии обычно предшествует гиперурикозурия, что требует исследования концентрации мочевой кислоты не только в сыворотке крови, но и в моче.
Классификация. Подагру классифицируют по этиопатогенетическому признаку, механизму накопления мочевой кислоты, клиническому течению заболевания и вариантам суставных проявлений. Кроме того, при формулировании диагноза отмечают степень активности воспалительного процесса, рентгенологическую стадию хронического подагрического артрита (если таковой имеется) и степень функциональной недостаточности суставов.
По этиопатогенетическому признаку:
– первичная (идиопатическая) подагра;
– вторичная подагра (вызванная другим заболеванием или медикаментами).
По механизму накопления мочевой кислоты:
– метаболического типа;
– гипоэкскреторного типа;
– смешанного типа.
По клиническому течению (рекомендации АРА):
– бессимптомная гиперурикемия;
– острый подагрический артрит;
– подагра с развитием тофусов;
– мочекаменный уролитиаз и другая, ассоциированная с подагрой патология почек (тубулоинтерстициальный нефрит).
По течению заболевания среди суставных вариантов:
– острый подагрический артрит;
– интермиттирующий артрит;
– хронический артрит с отложением параартикулярных тофусов.
Клиническая картинапри подагре складывается из поражений суставов и подагрических висцеропатий, при этом выделяют несколько ведущих синдромов: суставной, депозитный (отложение уратов в тканях), иммуновоспалительный, почечный.
В развитии подагры выделяют четыре стадии: 1) острый подагрический артрит; 2) межприступную («интервальную») подагру; 3) хронический подагрический артрит; 4) хроническую тофусную подагру (В.А. Насонова и соавт., 2003).
Острый подагрический артритобычно развивается через несколько лет бессимптомной гиперурикемии, преимущественно во второй половине ночи или ранние утренние часы. Может быть спровоцирован травмой, приемом алкоголя, погрешностями в диете, переохлаждением, нервно-психическим или физическим перенапряжением, хирургическими вмешательствами, приемом лекарственных препаратов, способствующих развитию гиперурикемии. Характеризуется быстрым нарастанием (в течение нескольких часов) чрезвычайно интенсивных болей, как правило, в одном суставе, сочетающихся с припухлостью сустава и гиперемией кожи. Болевой синдром настолько интенсивен, что часто не купируется приемом анальгетиков, боль усиливается даже от легкого прикосновения к воспаленной поверхности сустава; наступает ограничение подвижности в пораженном суставе. Длительность атаки варьирует от 1-2 (в легких случаях) до 7-10 дней.
У лиц пожилого возраста приступы протекают менее остро, чем у молодых, нередко по типу олигополиартрита. У мужчин преимущественно поражаются суставы стопы (плюсне-фаланговые и суставы плюсны), особенно большого пальца (в 50 % случаев), далее в убывающем порядке – голеностопный, коленный, лучезапястный, пальцев кисти и локтевые суставы. У женщин в начале заболевания чаще развивается олигополиартрит (вероятно, это связано с возрастными особенностями, поскольку у женщин подагра дебютирует в более пожилом возрасте), чаще поражаются суставы кистей.
Наряду с артритом у многих пациентов наблюдаются системные проявления (лихорадка, астенические проявления, лейкоцитоз), симулирующие развитие инфекционной патологии. Характерная особенность острого подагрического артрита – полное спонтанное выздоровление и отсутствие симптомов между приступами до следующей атаки или до развития хронического подагрического артрита. Наличие болей в суставах в этот период обычно связано с сопутствующей патологией – ОА. В отсутствие лечения наблюдается учащение атак, более затяжное течение, вовлечение в процесс новых суставов.
«Интервальная» (межприступная) подагра и рецидивирующий подагрический артрит. Временные промежутки между атаками острого подагрического артрита варьируют в широких пределах, в отсутствие лечения повторный приступ обычно развивается в течение первого года у 60 %, двух лет – у 78 % пациентов (В.А. Насонова и соавт., 2003).
В дальнейшем характерно сокращение продолжительности бессимптомного периода (так называемых «светлых» промежутков). Приступы становятся более тяжелыми, затрагивают «новые» суставы, иногда имеют полиартикулярный мигрирующий характер, часто сочетаются с более выраженными системными проявлениями. Отмечается воспаление периартикулярных тканей (связки, суставные сумки). Нередко наблюдается образование единичных тофусов в тканях, обычно безболезненных.
Хроническая тофусная подаграхарактеризуется развитием тофусов (часто множественных), хронического артрита, поражения почек, мочекаменной болезни.
При отсутствии специфического лечения тофусы развиваются у 50 % больных. Тофусы являются депозитами уратов, окруженными соединительной тканью с последующей кальцификацией (вследствие реакции интерстициальной ткани на чужеродный субстрат). Чаще они локализуются подкожно или внутрикожно в области пальцев кистей и стоп, коленных суставов, на локтях и в ушных раковинах, но могут образовываться практически на любых участках тела и во внутренних органах. Иногда наблюдается изъязвление кожи над тофусами со спонтанным выделением содержимого в виде пастообразной белой массы. Раннее появление тофусов наблюдается при некоторых формах ювенильной подагры; у женщин пожилого возраста, принимающих диуретики; при миелопролиферативных заболеваниях; некоторых болезнях почек, приводящих к ярко выраженной гиперурикемии.
Мочекаменная болезнь и хроническая уратная (подагрическая) нефропатия – частые проявления хронической подагры. У 20-40 % пациентов наблюдаются протеинурия и «мягкая» артериальная гипертензия, реже нефросклероз, тяжелая артериальная гипертензия, нарушение функции почек.
Массивная экскреция мочевой кислоты приводит к поражению тубулярного аппарата почек и вторично – интерстиция почек, развивается тубулоинтерстициальный нефрит. В процессе прогрессирования заболевания по мере формирования иммунных нарушений происходит повреждение клубочков с развитием иммунокомплексного гломерулонефрита (В.И. Мазуров и соавт., 2001).
Частота мочекаменной болезни коррелирует с концентрацией мочевой кислоты в сыворотке крови и моче. Камни обычно рентгеноконтрастны и состоят не только из уратов, но и оксалатов и фосфата кальция.
У больных подагрой увеличивается частота сопутствующих заболеваний: артериальной гипертензии, сахарного диабета, атеросклеротического поражения сосудов, гипертриглицеридемии.
Диагнозподагры основывается на клинических, лабораторных и рентгеновских методах исследования. В 1963 г. в Риме на Международном симпозиуме были разработаны критерии диагностики подагры (для постановки диагноза необходимо наличие, по крайней мере, двух из четырех нижеприведенных критериев):
1. Повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
2. Наличие подагрических узлов (тофусов).
3. Выявление при микроскопическом или химическом исследовании кристаллов натрия урата в синовиальной жидкости или в тканях.
4. Острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1-2 недель.
К сожалению, не все из перечисленных признаков патогномоничны для первичной подагры, вследствие чего «римские» критерии критикуются ведущими ревматологами. Во-первых, гиперурикемия может быть у людей, не страдающих подагрой, а возникнуть, например, под влиянием различных лекарств, принимаемых больными для лечения артрита. Во-вторых, тофусы, весьма характерный признак для подагры, могут отсутствовать в первые 5 лет болезни. В-третьих, наличие микрокристаллов урата натрия в синовиальной жидкости или в тканях – важный диагностический признак подагры, и может оказать известную помощь лишь в том случае, если пункция сустава, биопсия ткани и микроскопирование являются доступными методами исследования в данном лечебном учреждении. В-четвертых, острые приступы артрита с быстрой обратимостью суставных проявлений могут возникать при аллергии, пирофосфатной артропатии, в ранней стадии РА и т.д. (В.А. Насонова, М.Г. Астапенко, 1989).
По мнению отечественных ревматологов, улучшению диагностики подагры должны способствовать получающие все бόльшую распространенность в практике интерниста классификационные критерии подагры (S.Wallaceetal., 1972), которые в 2000 г. были рекомендованы ВОЗ для широкого применения (В.А. Насонова, В.Г. Барскова, 2004). Классификационные критерии состоят как бы из двух частей – достоверных критериев подагры как болезни и клинико-лабораторно-рентгенологических признаков, способствующих раскрытию подагрического характера артрита.
Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
Максимальное воспаление сустава в 1-й день.
Наличие более чем одной атаки артрита.
Моноартрит.
Покраснение суставов.
Боль и воспаление плюсне-фалангового сустава первого пальца.
Асимметричное воспаление плюсне-фалангового сустава.
Одностороннее поражение тарзальных суставов.
Подозрение на тофусы.
Гиперурикемия.
Асимметричное воспаление суставов.
Субкортикальные кисты без эрозий при рентгенологическом исследовании.
Отсутствие микроорганизмов в культуре синовиальной жидкости.
Сочетание признаков 1, 3, 4-6, 12 позволяет верифицировать острый подагрический артрит, сочетание признаков 2, 6, 8, 11 и 12 – хронический подагрический артрит.
Наибольшее значение из инструментальных методов диагностики имеет рентгенологическое исследование. Необходимо подчеркнуть, что при остром артрите специфических изменений на рентгенограммах не обнаруживается. Достоверные рентгенологические признаки при хронической подагре появляются обычно не ранее чем через 5 лет от начала заболевания, при этом можно одновременно наблюдать признаки деструкции, дегенерации и регенерации (см. гл. 7, рис. 12).
На фоне умеренного остеопороза в эпифизах костей могут выявляться вакуолеобразные дефекты костной ткани с ободком склероза (симптом «пробойника»), с течением времени наблюдается выраженная деструкция не только субхондрального участка кости, но и всего эпифиза и даже части диафиза (внутрисуставной остеолиз). Обнаруживаются утолщения и расширение мягких тканей, что обусловлено отложением в них уратов. При длительном течении болезни появляются рентгенологические признаки вторичного артроза.
Выделяют три рентгенологические стадии хронического подагрического артрита (Кавеноки–Минц, 1987):
Крупные кисты в субхондральной зоне кости или в более глубоких ее слоях, иногда уплотнение мягких тканей.
Крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами.
Большие эрозии, но менее чем на 1/3 суставной поверхности; остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Лечение. Противоподагрическая терапия должна складываться из двух направлений – купирования острого подагрического артрита и систематического лечения нарушений пуринового обмена, а по сути – проведения вторичной профилактики обострений, учитывая интермиттирующий характер болезни, при котором каждый приступ подагры значительно утяжеляет ее течение.
Диете при подагре придают наибольшее значение, по сравнению с другими ревматическими болезнями. Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела. Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров. Жиры снижают экскрецию мочевой кислоты почками. Запрещаются потроха (печень, почки, мозги, легкие), мясные бульоны, рыбная уха, мясо молодых животных (баранина, телятина, поросятина), цыплята, бобовые (зеленый горошек, фасоль), копчености, шашлыки, колбасные изделия, мясные и рыбные консервы, острые сыры, специи. Следует резко ограничить употребление продуктов, богатых щавелевой кислотой: щавель, шпинат, салат, ревень, баклажаны, брюква, редис, цветная капуста, сельдерей и др. Исключаются из пищи или резко ограничиваются продукты, возбуждающие нервную систему и аппетит (крепкий чай, кофе, какао, шоколад, острые закуски, пряности). Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино, так как алкоголь значительно снижает выведение мочевой кислоты почками.
Для купирования острого приступа подагры используются лекарственные средства трех классов: НПВП, ГКС (локально или системно) и колхицин. Необходимо отметить, что эффективность терапии тем выше, чем раньше начато лечение. До недавнего времени полагали, что лучшим препаратом для купирования приступа острого артрита при подагре является колхицин. Ярко выраженный и быстрый (в течение 48 ч) эффект колхицина рассматривался как один из диагностических признаков этого заболевания. Его лечебное действие обусловлено угнетением фагоцитарной активности нейтрофилов. При остром приступе подагры мононатриевые соли уратов, фагоцитированные нейтрофилами, приводят вследствие мембранолитического их действия к гибели этих клеток и высвобождению лизосомальных ферментов, которые отвечают за развитие острого воспаления.
Используются следующие схемы назначения колхицина:
внутрь 0,5-0,6 мг каждый час до купирования артрита (или появления побочных эффектов) или до достижения максимально допустимой дозы (6 мг), или более безопасная схема:
первый день – колхицин внутрь по 1 мг 3 раза в сутки после еды, второй день – внутрь по 1 мг утром и вечером, затем внутрь по 1 мг/сут (В.А. Насонова и соавт., 2003).
Однако нельзя не отметить достаточно выраженное токсическое влияние колхицина на печень, почки, центральную нервную систему, костный мозг, а также побочные действия препарата в виде различных диспепсических явлений.
Значительно меньше токсичность и частота побочных явлений у НПВП, которые также используются для лечения подагрических атак. Необходимо отметить, что препараты этой группы для купирования острого подагрического артрита применяются в больших терапевтических дозах, но даже при этом они переносятся лучше, чем колхицин. Широкое применение в клинической практике нашли производные индолуксусной (индометацин 200 мг/сут), арилуксусной (диклофенак 200-300 мг/сут), арилпропионовой (ибупрофен 3200 мг/сут, кетопрофен 300 мг/сут, напроксен 1000 мг/сут) кислот. В последние годы появились рекомендации по использованию нимесулида (в суточной дозе 400-200 мг) как в качестве монотерапии для купирования острого подагрического артрита, так и по включению его в комбинированную терапию для лечения хронического подагрического артрита, что, вероятно, обусловлено способностью препарата уменьшать уровень мочевой кислоты в сыворотке крови (В.А. Насонова и соавт., 2002).
Для НПВП существует своя схема применения, аналогичная таковой для колхицина, при этом в первые часы приступа рекомендуется применять бόльшую часть суточной дозы. Рассмотрим терапию на примере типичных представителей этой группы – индометацина и вольтарена. В первый день суточная доза (для индометацина – 200 мг/сут, для вольтарена – 300 мг/сут) делится на 4 части, три части принимаются в первой половине дня (по 0,05 г каждые 2 часа до купирования боли), одна часть – во второй половине дня в 2-3 приема. Во второй день суточная доза составляет половину той дозы, которая была эффективна в первый день, но не менее 100 мг/сут. В последующие 3-4 дня суточная доза снижается до 0,075 г в день, затем препарат отменяют.
Противоподагрическая терапия (базисная, модифицирующая болезнь) направлена на профилактику рецидивов острого артрита, снижение содержания мочевой кислоты в крови, предупреждение дальнейшего формирования тофусов и их обратное развитие. Все противоподагрические препараты делятся на две большие группы: урикодепрессорные (урикостатические) и урикозурические. Урикодепрессоры тормозят синтез мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего гипоксантин в ксантин, а ксантин в мочевую кислоту. Урикозурические средства повышают экскрецию мочевой кислоты, подавляя обратную реабсорбцию уратов почечными канальцами.
К препаратам первой группы относится аллопуринол, занимающий лидирующее положение среди других базисных противоподагрических средств. На фоне лечения аллопуринолом сывороточный уровень мочевой кислоты начинает снижаться уже в течение первых 2 дней, стабильный максимальный эффект развивается через 2 недели. Показаниями к назначению этого препарата являются метаболическая подагра, высокая гиперурикемия (более 0,48 ммоль/л), частые острые атаки артрита, мочекислая болезнь, генетически обусловленный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы. Применение аллопуринола возможно и у больных с подагрической нефропатией с начальными проявлениями ХПН и небольшой азотемии.
Для того чтобы избежать резкого снижения уровня мочевой кислоты, которое может спровоцировать острый приступ подагры, лечение следует начинать с небольшой дозы: аллопуринол внутрь по 50-100 мг/сут с титрованием до нормализации уровня уратов в сыворотке (менее 0,36 ммоль/л). Обычная доза препарата составляет 200-300 мг/сут, при необходимости – 600 мг/сут и более. Пожилым пациентам со сниженной клубочковой фильтрацией (менее 50 мл/мин), с очень частыми атаками артрита следует назначать аллопуринол в дозе не более 100 мг/сут. Лечение аллопуринолом может приводить к развитию побочных эффектов, иногда тяжелых (встречаются примерно у 5 % пациентов). К ним относятся диспепсия, головные боли, диарея, сыпь, лихорадка, крапивница, острая почечная недостаточность, агранулоцитоз, синдром Стивена–Джонса; поэтому лечение аллопуринолом должно проводиться под строгим врачебным контролем.
Урикозурические препараты, представляющие собой слабые органические кислоты, имеют меньшее значение в терапии подагры, чем урикостатики. Их не следует назначать при высоком содержании мочевой кислоты в крови, а также при нефропатии даже с начальными проявлениями почечной недостаточности. Из урикозурических препаратов особенно широко используются сульфинпиразон и пробенецид. Сульфинпиразон (антуран) назначают по 200-400 мг/сут в два приема. Его, как и другие урикозурические средства, принимают с большим количеством жидкости, которую для профилактики нефролитиаза следует ощелачивать. Побочные реакции встречаются относительно часто и проявляются желудочной и кишечной диспепсией, лейкопенией, аллергическими реакциями. Противопоказанием к назначению этого препарата является язвенная болезнь желудка и, прежде всего, подагрическая нефропатия.
Выраженное нормализующее влияние на нарушенный пуриновый обмен оказывает алломарон (содержит 20 мг бензбромарона и 100 мг аллопуринола), обладающий одновременно и урикозурическим, и урикодепрессивным эффектами. При этом уже на второй неделе лечения баланс мочевой кислоты приближается к норме, что обеспечивает профилактику повторных атак подагрического артрита.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и растворы, способные снизить риск развития нефропатии и, в частности, мочекаменной болезни. К этим препаратам относятся магурлит, блемарен и уралит. Их применение должно регулярно контролироваться показателем рHмочи. Из физиотерапевтических процедур в межприступный период назначают парафино-озокеритовые и грязевые аппликации на пораженные суставы, диадинамические токи, ультразвук, фонофорез с гидрокортизоном, массаж, лечебную физкультуру.
В целом при подагрическом артрите прогноз благоприятный. Однако в 20-50 % случаев развивается уролитиаз, а причиной смерти в 18-25 % больных подагрой является почечная недостаточность.
