
- •Оглавление
- •Предисловие
- •Глава 1. Исторический очерк
- •Глава 2. Возбудитель туберкулеза
- •Глава 3. Патогенез и патологическая анатомия туберкулеза
- •3.2 Клинически выраженный туберкулез
- •3.3 Морфология локальных изменений
- •Глава 4. Эпидемиология туберкулеза
- •Глава 5. Анатомо-физиологические сведения об органах дыхания
- •5.1 Гортань
- •5.2 Грудная стенка
- •5.3 Плевра
- •5.4 Легкие и бронхи
- •5.5 Легочные и бронхиальные артерии
- •5.6 Лимфатическая система легких
- •Глава 6. Методы обследования больных туберкулезом
- •6.1 основные симптомы
- •6.2 Расспрос, физикальные методы
- •6.3 Туберкулинодиагностика
- •6.4 Микробиологические исследования
- •6.5 Методы лучевой диагностики
- •6.6 Эндоскопия
- •6.8 Биопсия плевры, легких и лимфатических узлов
- •6.9 Исследование крови и мочи
- •6.10 Оценка функций дыхания и кровообращения
- •Глава 7. Классификация туберкулеза
- •Глава 8. Первичный туберкулез
- •Глава 9. Диссеминированный туберкулез легких
- •Глава 10. Очаговый туберкулез легких
- •Глава 11. Инфильтративный туберкулез легких
- •Глава 12. Казеозная пневмония
- •Глава 13. Туберкулема легких
- •Глава 14. Кавернозный и фиброзно-кавернозный туберкулез легких
- •Глава 15. Цирротический туберкулез легких
- •Глава 16. Туберкулезный плеврит
- •Глава 17. Туберкулез гортани, трахеи и бронхов
- •Глава 18. Туберкулез легких в сочетании с другими заболеваниями
- •18.1 Туберкулез у ВИЧ-инфицированных и больных синдромом приобретенного иммунодефицита
- •18.2 Туберкулез легких и пневмокониозы
- •18.3 Туберкулез и хронические неспецифические болезни органов дыхания
- •18.4 Туберкулез и сахарный диабет
- •18.6 Туберкулез и алкоголизм
- •18.7 Туберкулез и психические заболевания
- •18.8 Туберкулез и рак
- •Глава 19. Туберкулез и материнство
- •20.1 Туберкулез центральной нервной системы
- •20.3 Туберкулез почек и мочевыводящих путей
- •20.4 Туберкулез мужских половых органов
- •20.5 Туберкулез женских половых органов
- •20.6 Туберкулез периферических лимфатических узлов
- •20.7 Туберкулез брыжеечных лимфатических узлов
- •20.9 Туберкулез кишечника
- •20.10 Туберкулез глаз
- •20.11 Туберкулез кожи
- •Глава 21. Профилактика туберкулеза
- •21.1 Социальная профилактика
- •21.2 Санитарная профилактика
- •21.3 Специфическая профилактика туберкулеза
- •Глава 22. Выявление больных туберкулезом и верификация диагноза
- •22.1 Раннее, своевременное и позднее выявление больных туберкулезом
- •22.2 Организация выявления больных туберкулезом
- •22.3 Обследование на туберкулез и верификация диагноза
- •Глава 23. Лечение больных туберкулезом
- •23.1 Химиотерапия
- •23.1.1 Противотуберкулезные химиопрепараты
- •23.1.3 Профилактика и устранение побочных реакций
- •23.2 Хирургическое лечение туберкулеза легких
- •23.3 Искусственный пневмоторакс и пневмоперитонеум
- •23.4 Патогенетическая и симптоматическая терапия
- •Глава 24. Неотложные состояния при туберкулезе легких
- •24.1 Легочное кровотечение
- •24.2 Спонтанный пневмоторакс
- •24.3 Острое легочное сердце
- •Глава 25. Организация противотуберкулезной работы в России
- •25.1 Роль общей лечебно-профилактической сети
- •25.2 Специализированная противотуберкулезная служба
- •25.3 Государственный санитарно-эпидемиологический надзор
- •25.4 Международное сотрудничество
- •Декларация VII российского съезда фтизиатров 5 июня 2003 г., Москва
в период обострения, аллергические состояния являются про тивопоказаниями к пробе Манту при массовой туберкулинодиагностике. Пробу не делают в течение 1 мес после любой профилактической прививки или биологической диагностиче ской пробы, а также при карантине по детским инфекциям.
Массовую туберкулинодиагностику проводят лечебно-про филактические учреждения общей лечебной сети. Методиче ское руководство массовой туберкулинодиагностикой осуще ствляют противотуберкулезные диспансеры. При правильной организации ежегодно туберкулинодиагностика должна при меняться у 90—95 % детского и подросткового населения.
В организованных детских коллективах массовую туберку линодиагностику выполняет специально обученный медицин ский персонал, другим детям раннего и дошкольного возраста пробу Манту проводят в детской поликлинике. В сельской местности туберкулинодиагностику осуществляют районные и участковые поликлиники, а в ряде случаев — фельдшерскоакушерские пункты.
Индивидуальную туберкулинодиагностику посредством пробы Манту с 2 ТЕ применяют для дифференциальной диаг ностики инфекционной и поствакцинальной аллергии к тубер кулину, для контроля за состоянием лиц из групп повышенно го риска заболевания туберкулезом. Другими показаниями яв ляются диагностические проблемы в случаях многих заболева ний, которые следует дифференцировать с туберкулезом.
В противотуберкулезных учреждениях туберкулинодиагно стику используют для определения активности туберкулезного процесса, оценки эффективности лечения и диагностики ло кального туберкулеза. Показания к таким пробам определяют на основании клинических данных независимо от давности предшествующей пробы. Пробу Манту проводят не только с 2 ТЕ, но и с другими дозами туберкулина. Используют также градуированную пробу Пирке и пробу Коха. Иногда опреде ляют туберкулиновый титр, производят эозинофильно-тубер- кулиновую или гемобелково-туберкулиновую пробу. При этих пробах оценивают реакцию организма на туберкулин по соот ветствующим сдвигам в анализах крови.
Противопоказаний к проведению туберкулинодиагностики, кроме индивидуальной непереносимости туберкулина, нет.
6.4. Микробиологические исследования
Микробиологические и, в частности, бактериологические исследования необходимы для:
• выявления наиболее опасных в эпидемическом плане больных туберкулезом;
98

•верификации диагноза туберкулеза;
•определения лечебной тактики (организационная форма, план лечения);
•оценки эффективности лечения и прогноза;
•для эпидемического контроля за туберкулезом. Объектами бактериологического исследования являются
различные жидкости и ткани, получаемые при обследовании органов дыхания. Наиболее часто исследуют мокроту. Други ми материалами являются отделяемое дыхательных путей по сле аэрозольных ингаляций, бронхоальвеолярные смывы, плевральная жидкость, промывные воды желудка (преимуще ственно у детей, которые мокроту не откашливают, а заглаты вают). Во время и после хирургических операций забирают материал для исследования из резектатов легких, плевры, лимфатических узлов.
У больных внелегочным туберкулезом или при подозрении на таковой исследуют различные жидкости — цереброспи нальную, перикардиальную, синовиальную, асцитическую, а также менструальную кровь, гной, пунктаты костного мозга, грануляции, соскобы синовиальных оболочек, лимфатические узлы и их пунктаты, резектаты органов.
Классическими методами бактериологического исследова ния являются микроскопия мазка диагностического мате риала и культуральное исследование (посев) с идентифика цией вида микроорганизмов.
При выявлении МБТ необходимо определение их чувстви тельности к химиопрепаратам.
Микроскопия мазка диагностического материала — обяза тельный метод исследования в лечебно-профилактических уч реждениях общей лечебной сети. Цель исследования — выяв ление кислотоустойчивых микобактерий. Методика заключа ется в прямой световой микроскопии мазков, окрашенных по Цилю—Нельсену, или в люминесцентной микроскопии с ок раской флюорохромными красителями. При туберкулезе лег ких такое первичное, ориентировочное исследование позволя ет выявить тех больных, которые наиболее опасны в эпидеми ческом отношении.
При обнаружении кислотоустойчивых бактерий или со мнительном результате первичного микроскопического ис следования больного направляют в противотуберкулезное учреждение для верификации диагноза.
В бактериологических лабораториях противотуберкулезной службы мокроту при отрицательном результате исследуют не один раз, а в течение 3 дней подряд или более. Для исследова ния собирают утреннюю порцию мокроты. Предварительно пациент должен почистить зубы и прополоскать рот. В герме-
99

тичный флакон необходимо собрать 3—5 мл мокроты, но допустимо и меньшее количе ство. При отсутствии мокро ты возможно применение аэ розольных раздражающих ин галяций с 5—15 % раствором натрия хлорида в 1 % раство ре натрия бикарбоната. Мате
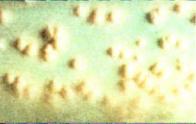
риалом для исследования в Рис. 6.2. Световая микроскопия. таких случаях могут служить Кислотоустойчивые микобакте также промывные воды брон рии красного цвета. Окраска по хов или желудка.
Цилю—Нельсену.
Сбор мокроты для преду преждения воздушно-капель ного распространения инфекции производят в специально
выделенном помещении.
При окраске по Цилю—Нельсену кислотоустойчивые ми кобактерии окрашиваются в красный, а окружающий фон и некислотоустойчивые микроорганизмы в синий цвет (рис. 6.2). Разрешающая способность микроскопического метода выяв ления кислотоустойчивых микобактерий значительно увели чивается при люминесцентной микроскопии с окраской пре парата флюорохромами — аурамином или аурамином с рода мином. При освещении ультрафиолетом микобактерии све тятся ярко-желтым цветом на темно-зеленом фоне (рис. 6.3).
Однако микроскопический метод имеет свои пределы. Прямая (простая) микроскопия с окраской по Цилю—Нельсе ну позволяет обнаружить микобактерии при их содержании более 5000—10 000 микробных тел в 1 мл материала. Такое количество микобактерий содержится в мокроте больных с прогрессирующим туберкуле зом. При люминесцентной микроскопии МБТ удается выявить при их содержании около 1000 в 1 мл.
В ранней стадии заболева ния количество микобакте рий ниже возможностей об наружения микроскопиче ским исследованием. Кроме этого, микроскопия не по зволяет дифференцировать
Mycobacterium tuberculosis с
другими микобактериями (возбудителями микобактериозов) и, следовательно, не достаточна для достоверного
Рис. 6.3. Люминесцентная мик роскопия с окраской препарата аурамином. Микобактерии яркожелтого цвета на темно-зеленом фоне.
100
определения этиологии забо левания.
Недостатки микроскопиче |
|
||
ского |
метода восполняет |
|
|
культуральный метод, или ме |
|
||
тод посева материала на пита |
|
||
тельные |
среды. Для |
получе |
|
ния культуры МБТ этим ме |
|
||
тодом достаточно от 20 до 100 |
|
||
микробных клеток в 1 мл |
Рис. 6.4. Рост колоний МБТ на |
||
жидкого |
материала. |
Стан |
|
дартной |
питательной |
средой |
твердой яичной среде Левен- |
для выращивания МБТ явля |
штейна—Йенсена. |
||
ется твердая яичная среда Ле- венштейна—Йенсена, на которой рост первых колоний отме
чают через 4—8 нед (рис. 6.4). Существуют также полужидкие и жидкие питательные среды. Некоторые методы с использо ванием высокоселективных сред позволяют вырастить культу ру микобактерий в более короткие сроки, но для идентифика ции микроорганизма требуется дополнительное время.
Получение чистой культуры микобактерий позволяет по средством биохимических методик отличить М. tuberculosis от других нетуберкулезных микобактерий, определить их жизне способность, вирулентность и чувствительность к лекарствен ным препаратам. Можно также количественно оценить бактериовыделение: скудное — до 10 колоний на среде, умерен ное — от 10 до 50 и обильное — более 50 колоний.
Недостатком культурального исследования является его длительность — около 2 мес. Однако этот метод необходимо применять у всех больных с подозрением на туберкулез, осо бенно при повторных отрицательных результатах микроско пического исследования.
С целью ускорения культурального исследования были соз даны аппараты для радиометрического определения роста ми кобактерий. В аппаратах такого типа жидкая питательная сре да содержит меченную 14С пальмитиновую кислоту. Специ альный сенсор улавливает признак роста микобактерий по выделению 14С уже через 10—12 дней или раньше. Другой принцип основан на поглощении кислорода в процессе роста микробной популяции. Уменьшение концентрации кислорода в закрытой камере активирует флюоресцентный индикатор, который начинает светиться в ультрафиолетовых лучах. С по мощью таких аппаратов возможны как идентификация мико бактерий, так и определение их чувствительности к лекарст венным препаратам (рис. 6.5). Разрабатываются и совершен ствуются также другие автоматические аппараты.
Культуральное исследование позволяет определить чувст вительность МБТ к лекарственным препаратам и выявить ус-
101

тойчивые к ним штаммы. Чувствительными считают микобактерии, которые пре кращают расти и размножать ся при добавлении в пита
|
|
тельную |
среду |
препарата |
в |
|||
|
|
низкой, |
т. е. |
критической, |
||||
|
|
концентрации. |
На |
устойчи |
||||
|
|
вые микобактерии препарат в |
||||||
|
|
этой концентрации не дейст |
||||||
|
|
вует. |
|
|
|
|
|
|
|
|
Быстрым способом |
выяв |
|||||
|
|
ления |
устойчивости |
МБТ |
к |
|||
|
|
лекарственным |
препаратам |
|||||
|
|
можно считать использование |
||||||
|
|
биологических |
микрочипов. |
|||||
|
|
Их применяют для оценки ге |
||||||
|
|
нетического |
полиморфизма |
|||||
|
|
ДНК. Миниатюрность, |
спе |
|||||
|
|
цифичность и высокая чувст |
||||||
|
|
вительность |
биологических |
|||||
Рис. 6.5. |
Автоматизированный |
микрочипов позволяют |
при |
|||||
комплекс |
ВАСТЕС MGIT 960 |
менять их одновременно для |
||||||
для регистрации роста микобак |
идентификации возбудителя |
|||||||
терий и определения их чувстви |
и определения его устойчиво |
|||||||
тельности к химиопрепаратам на |
сти к нескольким лекарствен |
|||||||
основе флюоресценции. |
ным |
препаратам. |
Результат |
|||||
|
|
такого |
|
исследования |
пока |
|||
обычно контролируют последующим традиционным культуральным методом.
Лабораторное определение спектра и степени устойчивости микобактерий к противотуберкулезным препаратам имеет важное значение для выбора химиотерапии, контроля за эф фективностью лечения и проведения эпидемиологического мониторинга.
Бактериологическое исследование при недостаточной ин формативности может быть дополнено биологическим мето дом. Он состоит в заражении животного полученным от боль ного биологическим материалом, в котором предположитель но содержатся МБТ. Обычно используют морских свинок. Эти животные высокочувствительны к МБТ. Примерно через месяц после заражения у свинки развивается генерализован ный туберкулез. Биологический метод является высокочувст вительным, так как туберкулез у морской свинки возникает при введении материала, содержащего менее 5 микробных тел в 1 мл. Однако он сложен в организационном плане и требует достаточно высоких затрат.
В сложных диагностических случаях прибегают к молеку-
102
