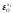- •Раздел 1. Введение. Лекция 1. Требования, предъявляемые к современным металлургическим процессам.
- •Вопрос 1. Комплекснгость использования сырья (кис)
- •Вопрос 2. Экологическая безопасность технологий.
- •Вопрос 3. Удельная производительность оборудования
- •Вопрос 1. Способы получения порошков.
- •Вопрос 2. Механическое изельчение
- •Вопрос 3. Распыление расплава
- •Вопрос 1. Твердофазное восстановление
- •Вопрос 2. Электролиз.
- •Вопрос 3. Цементация
- •Вопрос 4. Карбонильный метод
- •Вопрос 5. Термолиз
- •Вопрос 6. Автоклавный способ
- •Вопрос 7. Специальные способы
- •Вопрос 1. Химические свойства
- •Вопрос 2. Физические свойства
- •Вопрос 3. Технологические свойства
- •Вопрос 4. Производство изделий из порошков
- •Раздел 3. Автогенные процессы в металлургии меди. Лекция 5. Некоторые теоретические аспекты автогенных процессов
- •Вопрос 1. . Физико-химические принципы автогенности, методы достижения.
- •Вопрос 2.Особенногсти тепловых балансов.
- •Вопрос 3. Влияние различных факторов на тб ап в общем случае автогенный режим автогенных процессов зависит от следующих факторов:
- •Вопрос 4. Оксисульфидные системы.
- •Лекция 3. Практика автогенных процессов (ап)
- •Вопрос 1. Классификация ап и преимущества ап
- •Совмещенная плавка-конвертирование (спк)
- •Технологические преимущества автогенных процессов.
- •Вопрос 2. Кислородно-факельная плавка, аппаратурное оформление
- •Технологическая схема приведена на рис. 1. Вопрос 2. Особенности ф-х процессов технологии
- •Вопрос 3. Технологическая схема производства с использованием кфп следующая
- •Вопрос 3. Т-э показатели процессса, преимущества, недостатки, перспективы.
- •Недостатки:
- •Лекция 7. Плавка во взвешенном состоянии.
- •Вопрос 2. Практика процесса.
- •Недостатки ап первой группы (классификация):
- •Лекция 8. Плавка в печах Ванюкова.
- •Вопрос 2. Конструкция печи. Печь представляет собой шахту, кессонированную в средней части и футерованную ниже оси фурм.
- •Вопрос 7. Показатели и перспективы процесса пв:
- •Вопрос 1. Спк на уральских предприятиях(оао «ммск»)
- •Вопрос 2. Практика спк на оао «Святогор». Технологическая схема спк на оао «Святогор» включает (рис.2.) плавку концент-
- •Вопрос 3. Технология «Эльтениенте» (Чили).
- •Вопрос 2. Технология «Мицубиси»
- •Вопрос 3. Практика работы завода «Гресик» Индонезия
- •Лекция 11. Ап с погружной фурмой. Аусмелт
- •Вопрос 1. Классификация процессов.
- •Особенность фурмы аусмелт
- •Вертикальная фурма многоцелевого назначения.
- •Вопрос 2. Оосбенности технологии « кивцэт»
- •Вопрос 3. Схема кифцэт:
- •Показатели
- •Вопрос 3. Факельно-барботажная плавка фбп.
- •Технико-экономические показатели факельно-барбатажной плавки:
- •Раздел 4. Современное состояние и пути модернизации существующих процессов.
- •Вопрос 2. Характеристика шахтной плавки.
- •Вопрос 1. Характеристика современного состояния
- •Вопрос 2. Пути совершенствования оп и ее перспективы
- •Лекция 14. Современное состояние процесса конвертирования медных штейнов и перспективы развития производства.
- •Вопрос 1. Теория конвертирования
- •Вопрос 1. Распределение основных спутников меди
- •Лекция 16 Современная практика конвертирования и направление совершенствования процесса.
- •Вопрос 1. Характеристика конвертеров и технологии
- •Вопрос 2. Прогресс в области конвертирования:
- •Вопрос 3. Повышение качества флюса.
- •Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
- •Вопрос 1. Термодинамика реакций окисления меди и примесей
- •Вопрос 2. Анализ системы Cu-п-о
- •Вопрос 5. Термодинамика дегазации и раскисления
- •Вопрос 1. Типы печей.
- •Стационарная отражательная печь
- •Технические характеристики пламенных печей
- •Наклоняющиеся печи, по сравнению с отражательными печами, имеют преимущества:
- •Вопрос 2. Характеристика печи «Мерц»
- •Вопрос 3. Оборудование для разливки анодов
- •Вопрос 4. Разливочная машина.
- •Технические характеристики
- •Лекция 20. Технология рафинирования. Режимные параметры операций
- •Вопрос 1. Основные операции рафинрвания
- •Вопрос 3. Виды восстановителя
- •Вопрос 4.Особенности восстановления в печи Мерц
- •Вопрос 5. Реагентное рафинирование.
- •Вопрос 2. Поведение примесей на аноде и катоде
- •Вопрос 4. Образование медеэлектролитного шлама
- •Вопрос 5. Пассивация анода
- •Вопрос 6. Структура катодных осадков
- •Вопрос 7. Добавки в электролит
- •Вопрос 8. Влияние температуры электролита
- •Вопрос 3. Принцип работы автоматической линии для сборки и расстановки стартерных катодов
- •Вопрос 4. Работа «Стрипп-машины».
- •Вопрос 5. Конструкции электролизных ванн
- •Вопрос 6. Системы включения электродов
Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
Лекция 18. Термодинамика реакций окислительного огневого рафинирования
Вопрос 1. Термодинамика реакций окисления меди и примесей
Пирометаллургическое рафинирование
основано на частичном окислении расплава
меди свободным кислородом газовой фазы
и образовании ограничено растворимых
в жидкой меди оксидов примесей (ПхОу),
которые за счет более низкой плотности
формируют на поверхности расплава слой
шлака. Реакции окисления меди и ее
компонентов протекают в системе,
состоящей из жидкой фазы раствора
примесей, конденсированных фаз оксидов
и газа летучих соединений.
Поскольку основным компонентом чернового металла является медь [Cu], то согласно закону действующих масс при продувке расплава газообразным окислителем она преимущественно вступает во взаимодействие с кислородом дутья {O2}
4[Cu]+{O2}=2Cu2O. (2.1)
По мере образования и растворения Cu2O, в объеме расплава происходит окисление примесей (П) меди
хП +уСu2O=ПхОу+2уCu. (2.2)
Согласно теории А.Н. Вольского взаимодействие 2.2. протекает, когда
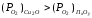
упругость диссоциации
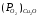 становится выше упругости диссоциации
оксида-примеси
становится выше упругости диссоциации
оксида-примеси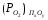 .
Возможность диссоциации оксидов Сu2Oи ПхОу, протекающих
по реакциям с образованием 1 моля
кислорода
.
Возможность диссоциации оксидов Сu2Oи ПхОу, протекающих
по реакциям с образованием 1 моля
кислорода
2Cu2O=4Cu+О2(2.3)
2/yПхОу=2х/yП+О2(2.4)
зависит от прочности закиси меди и оксидов примесей. Термодинамическую прочность любых оксидов металлов можно определить на основе обобщенного уравнения для кислородного потенциала МеО
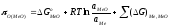 ,
(2.5)
,
(2.5)
 -
окислительный потенциалМеО;
-
окислительный потенциалМеО;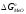 -стандартное
изменение энергии Гиббса для реакции
образования оксида МеО;
-стандартное
изменение энергии Гиббса для реакции
образования оксида МеО;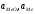 - активность оксидов и металла в случае
образования растворов;
- активность оксидов и металла в случае
образования растворов;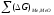 -дополнительное
изменение энергии Гиббса за счет фазовых
превращений металла и оксида.
-дополнительное
изменение энергии Гиббса за счет фазовых
превращений металла и оксида.
Соответствующие уравнения для расчета кислородных потенциалов образования Cu2Oи ПхОуимеют вид
πo(Сu2O)=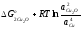 +
+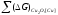 (2.6)
(2.6)
πo
(ПхОу)
=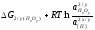 +
+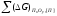 .
(2.7)
.
(2.7)
Термодинамическую возможность окислительного рафинирования черновой меди можно рассматривать на основе сравнительного анализа кислородных потенциалов закиси меди πo(Сu2O)и оксидов примесейπo(ПхОy ) в системе «Медный расплав-шлак».Диаграмма стандартных потенциалов образования некоторых оксидов при отсутствии взаимных растворов и с учетом фазовых превращений приведена на рис.2.1. Из представленных данных видно, что кислородный потенциал оксидов уменьшается в ряду: πо(Сu2O)>πо(Вi2O3)>πо(РbО)>πо(As2O3)>πо(NiO)>πо(СоО)>πо(SnO2)>πо(FeО)>
>πо(ZnО). При этом
наиболее высокую
термодинамическую вероятность окисления
имеют примесис максимальной
разностью πо(Сu2O)
- πо(ПхОy).
Поэтому сравнительно легко удаляются
железо, цинк, олово и пр. примеси, имеющие
высокое сродство к кислороду и
соответственно наибольшую разность
кислородных потенциалов. Увеличение
температуры приводит к росту подвижности
кислорода а, следовательно, к уменьшению
устойчивости оксидов и повышению
значения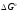 .
.
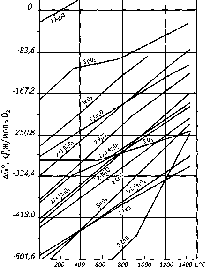
Рис.2.1. Зависимость стандартного изменения энергии Гиббса
реакций образования оксидов от температуры
При рафинировании кислородный потенциал окислителя в условиях
постоянной продувки ванны воздухом и насыщения расплава меди Сu2Oподдерживается постоянным. Кислородный потенциал окисляющихся примесей является величиной переменной, поскольку изменяются активности компонентов, как в расплаве меди, так и среди оксидов примесей.
Таким образом, величины кислородных потенциалов ро (Сu2O),
πо(ПхОy) зависят не только от активности кислорода в металле, но и наличия в расплаве других компонентов, поскольку они в свою очередь также оказывают влияние на активность кислорода и примесей. Поэтому для оценки степени их удаления необходимо располагать данными о величинах активности всех компонентов системыCu-П-О.
Для расчета активностей используют
метод параметров взаимодействия (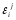 ),
который учитывает взаимное влияниеj-ого элемента
многокомпонентного расплава на
коэффициент активностиi-ого.
Предполагается, что в первом приближении
коэффициент активности (ln
γi) линейно
зависит от мольных долей растворенных
компонентов и параметров взаимодействия
),
который учитывает взаимное влияниеj-ого элемента
многокомпонентного расплава на
коэффициент активностиi-ого.
Предполагается, что в первом приближении
коэффициент активности (ln
γi) линейно
зависит от мольных долей растворенных
компонентов и параметров взаимодействия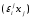 по
уравнению
по
уравнению
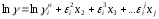 . (2.8)
. (2.8)
В технологических расчетах удобнее
выражать состав в массовых %, тогда
параметры называются массовыми
 и
коэффициент активности (f) в разбавленном многокомпонентном
растворе равен
и
коэффициент активности (f) в разбавленном многокомпонентном
растворе равен
 ,
(2.9)
,
(2.9)
Преобразование параметров взаимодействия компонента i с компонентомjпри переходе от одной размерности состава (мольная доля) к другой (%, по массе) производят по уравнениям
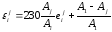
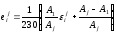 .
(2.10)
.
(2.10)
В таблице 2.1. представлены данные о
величинах коэффициентов активностей
γi некоторых
примесей (хi)
черновой меди и параметры их взаимодействия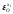 в системеCu-xi-O.
в системеCu-xi-O.
Проанализируем некоторые физико-химические характеристики бинарной системы Cu-O. При сравнительно низких концентрациях кислорода здесь характерно наличие двух конгруэнтно (с разложением) плавящихся оксидов (Сu2Oи СuО), а также имеется широкая область расслаивания (рис.1.9) жидких расплавов кислорода в меди и жидкого оксида Сu2O. Растворимость кислорода в чистой меди составляет 1,5 % (по массе) при 1473 К. Максимальная растворимость кислорода при заданной температуре рассчитывается по уравнениям
lg[%O]max= -9260 /Т +6,55, при 1138-1489 К(2.11)
lg[%O]max= -6500 /Т +4.47 при 1356-1506 К(2.12)
Таблица 2.1
Значения γiи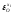 примесейхiв системеCu-xi-O
примесейхiв системеCu-xi-O
в интервале температур 1100-1200оС
|
хi |
γi |
Зависимость
от температуры |
|
О S Ag As Bi Co Fe Ni Pb Sb Sn Zn |
0,175 0,093 3,23 0,06 1,97 1,50 26,0 2,5 5,7 0,25 0,42 0,15 |
-7,71) - -0,22) +3,33) -8,1+4∙10-3t -191+11,5∙10-2t -3740,5+2,46t -23,75+12,5∙10-3t -15,87+6,5∙10-3t -16,48+10,6∙10-3t -9,6+5,6∙10-3t -7,52+3,49∙10-3t |
1),2),3)Средние значения величин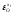
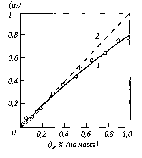
На окислительной стадии рафинирования содержание кислорода обычно составляет 0,4-0,9%, что обеспечивает перенос Cu2Oв объем жидкой меди и соответственно протекание реакции 2.2. Для этой области концентраций наблюдается заметное отклонение от закона Генри (рис.2.2). Коэффициент активности кислорода γО обычно уменьшается с ростом концентрации и уменьшением температуры расплава.
Для расчета коэффициента активности кислорода при бесконечном разбавлении раствора и температуре 1350-1800 К может быть использовано уравнение
lnaO= -8913/Т+ 4,52(2.13)
В черновой меди, содержащей другие металлы активность кислорода отли-
чается от величин aOв чистой меди. На рис. 2.3 показано влияние некоторых
элементов на изменение активности кислорода. Видно, что снижают актив-
ность примеси, имеющие более высокое сродство к кислороду. Их поведение
lg
aO
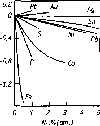
Рис.2.3. Влияние примесных элементов на активность
кислорода в меди при 1423 К
объясняется соотношением межатомных сил взаимодействия компонентов системе Сu-[О]Сu-П, когда примеси образуют более прочные связи с кислородом, чем с медью. Концентрация этих элементов вблизи аниона кислорода выше, чем в остальном расплаве, поэтому с ростом содержания примесного элемента, прочность связи кислорода с металлом увеличивается, а активность кислорода снижается.