
- •Раздел 1. Введение. Лекция 1. Требования, предъявляемые к современным металлургическим процессам.
- •Вопрос 1. Комплекснгость использования сырья (кис)
- •Вопрос 2. Экологическая безопасность технологий.
- •Вопрос 3. Удельная производительность оборудования
- •Вопрос 1. Способы получения порошков.
- •Вопрос 2. Механическое изельчение
- •Вопрос 3. Распыление расплава
- •Вопрос 1. Твердофазное восстановление
- •Вопрос 2. Электролиз.
- •Вопрос 3. Цементация
- •Вопрос 4. Карбонильный метод
- •Вопрос 5. Термолиз
- •Вопрос 6. Автоклавный способ
- •Вопрос 7. Специальные способы
- •Вопрос 1. Химические свойства
- •Вопрос 2. Физические свойства
- •Вопрос 3. Технологические свойства
- •Вопрос 4. Производство изделий из порошков
- •Раздел 3. Автогенные процессы в металлургии меди. Лекция 5. Некоторые теоретические аспекты автогенных процессов
- •Вопрос 1. . Физико-химические принципы автогенности, методы достижения.
- •Вопрос 2.Особенногсти тепловых балансов.
- •Вопрос 3. Влияние различных факторов на тб ап в общем случае автогенный режим автогенных процессов зависит от следующих факторов:
- •Вопрос 4. Оксисульфидные системы.
- •Лекция 3. Практика автогенных процессов (ап)
- •Вопрос 1. Классификация ап и преимущества ап
- •Совмещенная плавка-конвертирование (спк)
- •Технологические преимущества автогенных процессов.
- •Вопрос 2. Кислородно-факельная плавка, аппаратурное оформление
- •Технологическая схема приведена на рис. 1. Вопрос 2. Особенности ф-х процессов технологии
- •Вопрос 3. Технологическая схема производства с использованием кфп следующая
- •Вопрос 3. Т-э показатели процессса, преимущества, недостатки, перспективы.
- •Недостатки:
- •Лекция 7. Плавка во взвешенном состоянии.
- •Вопрос 2. Практика процесса.
- •Недостатки ап первой группы (классификация):
- •Лекция 8. Плавка в печах Ванюкова.
- •Вопрос 2. Конструкция печи. Печь представляет собой шахту, кессонированную в средней части и футерованную ниже оси фурм.
- •Вопрос 7. Показатели и перспективы процесса пв:
- •Вопрос 1. Спк на уральских предприятиях(оао «ммск»)
- •Вопрос 2. Практика спк на оао «Святогор». Технологическая схема спк на оао «Святогор» включает (рис.2.) плавку концент-
- •Вопрос 3. Технология «Эльтениенте» (Чили).
- •Вопрос 2. Технология «Мицубиси»
- •Вопрос 3. Практика работы завода «Гресик» Индонезия
- •Лекция 11. Ап с погружной фурмой. Аусмелт
- •Вопрос 1. Классификация процессов.
- •Особенность фурмы аусмелт
- •Вертикальная фурма многоцелевого назначения.
- •Вопрос 2. Оосбенности технологии « кивцэт»
- •Вопрос 3. Схема кифцэт:
- •Показатели
- •Вопрос 3. Факельно-барботажная плавка фбп.
- •Технико-экономические показатели факельно-барбатажной плавки:
- •Раздел 4. Современное состояние и пути модернизации существующих процессов.
- •Вопрос 2. Характеристика шахтной плавки.
- •Вопрос 1. Характеристика современного состояния
- •Вопрос 2. Пути совершенствования оп и ее перспективы
- •Лекция 14. Современное состояние процесса конвертирования медных штейнов и перспективы развития производства.
- •Вопрос 1. Теория конвертирования
- •Вопрос 1. Распределение основных спутников меди
- •Лекция 16 Современная практика конвертирования и направление совершенствования процесса.
- •Вопрос 1. Характеристика конвертеров и технологии
- •Вопрос 2. Прогресс в области конвертирования:
- •Вопрос 3. Повышение качества флюса.
- •Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
- •Вопрос 1. Термодинамика реакций окисления меди и примесей
- •Вопрос 2. Анализ системы Cu-п-о
- •Вопрос 5. Термодинамика дегазации и раскисления
- •Вопрос 1. Типы печей.
- •Стационарная отражательная печь
- •Технические характеристики пламенных печей
- •Наклоняющиеся печи, по сравнению с отражательными печами, имеют преимущества:
- •Вопрос 2. Характеристика печи «Мерц»
- •Вопрос 3. Оборудование для разливки анодов
- •Вопрос 4. Разливочная машина.
- •Технические характеристики
- •Лекция 20. Технология рафинирования. Режимные параметры операций
- •Вопрос 1. Основные операции рафинрвания
- •Вопрос 3. Виды восстановителя
- •Вопрос 4.Особенности восстановления в печи Мерц
- •Вопрос 5. Реагентное рафинирование.
- •Вопрос 2. Поведение примесей на аноде и катоде
- •Вопрос 4. Образование медеэлектролитного шлама
- •Вопрос 5. Пассивация анода
- •Вопрос 6. Структура катодных осадков
- •Вопрос 7. Добавки в электролит
- •Вопрос 8. Влияние температуры электролита
- •Вопрос 3. Принцип работы автоматической линии для сборки и расстановки стартерных катодов
- •Вопрос 4. Работа «Стрипп-машины».
- •Вопрос 5. Конструкции электролизных ванн
- •Вопрос 6. Системы включения электродов
Вопрос 5. Термодинамика дегазации и раскисления
Раскисление меди («дразнение на ковкость») осуществляют с целью удаления, находящегося в расплаве меди после окислительной стадии рафинирования кислорода. Концентрация кислорода в расплаве меди перед ее восстановлением обычно в среднем составляет 0,4 % (по массе). Удаление кислорода осуществляют до его остаточной концентрации 0,10-0,15 %, что ниже эвтектического состава сплава системы Cu-O,содержащего 0,39 % [O]. Наличие эвтектики нежелательно, т.к. ее распад сопровождается образованием дисперсной меди, которая при электролизе переходит в шлам, а также ухудшает качество катодного осадка..
Наиболее распространенными раскислителями являются древесина, мазут, дизельное топливо, природный газ, пропан, бутан, а также продукты неполного сжигания топлива. Применяют сырой (нереформированный) газ или осуществляют его высокотемпературную конверсию, тогда восстановителями кислорода являются углеводороды (СН4, СnНm) или продукты пиролиза (СО, Н2, С).
Термодинамические условия для восстановления оксида меди (1) газообразными восстановителями
Cu2O+H2(CO)=2Cu+H2O(CO2), (2.35) определяются соотношением кислородных потенциалов газовой фазы и Сu2Oпри условии
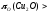
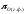 .
(2.36)
.
(2.36)
Поскольку система "Cu-O-г.ф."
стремится к выравниванию потенциалов,
кислород переходит из оксидной фазы в
газовую. При участии в процессе
восстановления закиси меди водорода
образуется смесь Н2-Н2О, а
монооксида углерода СО-СО2. Величина
кислородного потенциала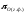 этих
смесей (кДж/моль О2) рассчитывается
по уравнениям, включающих зависимость
этих
смесей (кДж/моль О2) рассчитывается
по уравнениям, включающих зависимость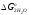 ,
,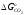 образования
2Н2О и СО2 от температуры:
образования
2Н2О и СО2 от температуры:
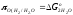 +2RTln(%H2/%H2O)=-492230+Т∙[108,24-38,24
∙lg(%H2/%H2O)]
(2.37)
+2RTln(%H2/%H2O)=-492230+Т∙[108,24-38,24
∙lg(%H2/%H2O)]
(2.37)
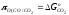 +RT
ln (% CO/% CO2)=-393260-T
[2.29-19,12lg (% CO/% CO2)]
(2.38)
+RT
ln (% CO/% CO2)=-393260-T
[2.29-19,12lg (% CO/% CO2)]
(2.38)
Зависимость πо(Сu2О)от температуры описывается уравнением
πо(Сu2О)=-293210+100.82Т(2.39)
При температуре 1423 К равенство кислородных потенциалов
 =
= (2.40)
(2.40)
 =
=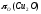 (2.41)
(2.41)
наступает при отношениях (% Н2/ % Н2О) =3,5∙10-4и (% СО/ % СО2)=8,9∙10-4.
Решая уравнения: % Н2/(100 - % Н2) =3,5∙10-4;% СО/(100 - % СО)=8,9∙10-4относительно % Н2 и % СО, получим величину минимальной концентрации водорода для восстановления закиси меди 0,035 %, а монооксида углерода 0,089 % , об. Таким образом, в рассматриваемой системе имеются благоприятные термодинамические предпосылки для раскисления меди водородом и монооксидом углерода.
В качестве восстановителей также применяются природный газ и аммиак (NH3). В этом случае протекают реакции
СН4+4[O]=CO2+2H2O (2.42)
NH3+3/2[O]=1/2N2+3/2H2O (2.43)
Для удаления кислорода могут использоваться любые элементы, имеющие высокое сродство к кислороду. Твердые раскислители (фосфор, бор, литий, углерод) нашли применение в практике плавки литейных и деформируемых медных сплавов. В процессе огневого рафинирования на различных предприятиях использовались алюминий, кремний, бериллий, цинк, олово, лигатуры Cu-Si,Fe-Si-Al,Fe-Si-Ca, СаС2, СаВ6.
Процесс восстановления с участием таких раскислителей (R) в общем виде записывается следующим образом
Сu2О +R=RО + 2Cu(2.41)
Термодинамическим условием протекания реакции 2.41 является
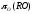 <
<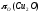 , (2.42)
, (2.42)
т.е. кислородный потенциал оксида раскислителя должен быть меньше, чем у закиси меди. Практически любые металлы, имеющие более высокое сродство к кислороду, чем у меди, могут являться потенциальными раскислителями.Вместе с тем, к ним предъявляются особые требования. Реагент не должен снижать эксплуатационные характеристики меди (электропроводность, пластические свойства), а продукт раскисления (RО) - растворяться в металле. Кроме того,ROдолжен хорошо удаляться из меди.
В процессе огневого рафинирования на стадиях плавления и окисления черновой меди расплав абсорбирует газы из атмосферы печи и газообразные продукты реакций взаимодействий кислорода с примесями. Источниками газов могут быть также шихтовые материалы и футеровка. Растворенные в меди газы выделяются при последующем охлаждении расплава и его затвердевании, что приводит к образованию пор, внутренних дефектов, снижающих качество анодов и показатели электролиза. Дегазацию меди или «дразнение на плотность» протекает одновременно с ее восстановлением древесиной. Обычно после обработки расплава мазутом или смесью мазута с водяным паром в ванну печи вводят одну или несколько «дразнилок» для окончательного удаления растворенных газов.
Поскольку остаточный кислород находится в форме закиси меди и не может являться источником пор, то на стадии дегазации преимущественно удаляют водород и SO2.
Процесс растворения водорода в меди протекает по реакции
Н2(г) = 2 [Н]Сu(2.43)
и соответствует закону Сивертса:
S=(-13.94+0.01841∙t)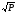 ,(2.44)
,(2.44)
где: S — растворимость, см3/100 г; Р — давление, МПа; t— температура, °С.
Расплав меди в процессе рафинирования
контактирует с атмосферой печи,
компонентами которой являются водород
и водяной пар. Парциальное давление
паров воды в зависимости от условий
сжигания топлива может изменяться в
широких пределах. Обычно медерафинировочные
печи отапливаются природным газом с
применением воздуха, коэффициент
расхода которого α, варьируют от 0.6
(стадия восстановления) до 1.3
(окисление). Расчетные значения без
учета подсосов воздуха парциальных
давлений водяного пара (МПа) в атмосфере
печи составляют: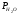 =0.012
(α= 0.6),
=0.012
(α= 0.6),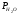 =0.018 (α= =1.05),
=0.018 (α= =1.05),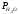 = 0.0165 МПа (α = 1.15),
= 0.0165 МПа (α = 1.15),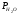 =0.0143
(α = 1.3). При использовании воздуха,
обогащенного кислородом 35%, величина
=0.0143
(α = 1.3). При использовании воздуха,
обогащенного кислородом 35%, величина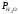 =
0.026 МПа (α= =1.15), а на технологическом
кислороде возрастает до
=
0.026 МПа (α= =1.15), а на технологическом
кислороде возрастает до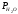 =0.040 МПа.
=0.040 МПа.
Пары воды при контакте с расплавом металла разлагаются с образованием водорода и кислорода, ассимилируемых жидкой медью
Н2О(г) =2 [Н] + [О](2.45)
Брутто-реакция 2.45 состоит в свою очередь из частных реакций
Н2О(г)=H2 (г)+1/2О2 (г) (2.46)
1/2Н2= [Н] (2.47)
1/2 О2=[О](2.48)
Учитывая взаимодействие меди с кислородом газовой фазы в поверхностном слое, общее равновесие в системе определяется реакцией
Н2(г)+ [О]Сu= Н2O(г)(2.49)
Константа равновесия реакции 2.49
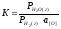 (2.50)
(2.50)
Допустим, что в начальной газовой фазе
парциальное давление водяного пара
составляет
 ,
а после взаимодействия с медью объем
газов согласно (2.49), остается постоянным,
т.е.
,
а после взаимодействия с медью объем
газов согласно (2.49), остается постоянным,
т.е.
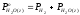 ,
(2.51)
,
(2.51)
где: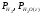 -равновесные парциальные давления газов
для реакции 2.46.
-равновесные парциальные давления газов
для реакции 2.46.
Комбинируя выражения для констант равновесия реакций 2.43, 2.50 и с учетом уравнения 2.51, получаем
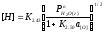 (2.52)
(2.52)
Сопоставление уравнений 2.52 и 2.44 показывает, что пары воды оказывают аналогичной влияние на поглощение водорода расплавом меди, как и чистый водород.
Температурная зависимость изменения свободной энергии Гиббса реакции 2.45, записанной обратном направлении выражается уравнением
ΔG°=-246115+54,12Т.(2.53)
С учетом зависимости изменения свободной энергии Гиббса от температуры для растворения атомарного водорода в жидкой меди
ΔG°=- 177851+5,54Т (2.54)
переходим к уравнению для константы равновесия
lg Кр= 22171/Т - 3,12(2.55)
С другой стороны,
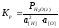 ,(2.56)
,(2.56)
откуда с учетом уравнения 2.55 получим
lg
a[H]=1/2
lg
 -1/2lg
a[O]-
22171/Т-3,12.
(2.57)
-1/2lg
a[O]-
22171/Т-3,12.
(2.57)
Растворимость водорода, находящегося в равновесии с газовой фазой, содержащей водяной пар в зависимости от его парциального давления и температуры определяется уравнением 2.57.
Рассчитаем по уравнению 2.57 предельную концентрацию водорода в меди для различных рассмотренных выше условий сжигания природного газа при 1423 К и концентрации кислорода 0.2 % (по массе). Коэффициент активности водорода принимаем γ[H]=1 (для бесконечно разбавленного раствора), кислорода, согласно данным таблицы 2.1. равной γ[О]=0,175, тогда
a[O] = γ[О ∙ N[O]=0,0014. (2.58)
Влиянием других компонентов раствора на величину активности кислорода и водорода пренебрегаем.
Расчетные значения концентрации водорода ( %, по массе) изменяются от 2,7∙10-6(α=0.6) до 3,4∙10-6(α =1.05) при использовании воздушного окислителя. Применение воздуха, обогащенного кислородом 35 % О2 (α=1.15) концентрация водорода в анодной меди может достигать 4,0∙10-6, а с использованием технологического кислорода 4,9∙10-6% .
Фактическая концентрация водорода в меди обычно больше равновесной и составляет величину порядка ~ 10-4%. Высокие литейные свойства меди при разливке анодов (отсутствие «водородных раковин, пор ») обеспечиваются при содержании водорода менее 0,5 г/т или 5∙10-6% (по массе) [H]. Поэтому необходимо обращать внимание на степень насыщения кислородом меди, поддержание оптимального соотношение коэффициента избытка окислителя (α) при сжигании топлива на горелках в печи, обеспечивающее минимальную концентрацию в атмосфере агрегата паров воды.
Источником газовых включений диоксида серы в металле является сера черновой меди, получаемой из сульфидного сырья и атмосфера печи. Зависимость изменения свободной энергии Гиббса от температуры для реакции
[S]+ 2 [О] =SO2(2.57)
выражается уравнением
ΔG°= -178567+36.26∙Т, (2.58)
с учетом зависимости ΔG o от температуры реакции растворения атомарного кислорода в меди
ΔG°= -159000+20∙Т, (2.59)
переходим к уравнению
lg Kp=17653-2,94. (2.60)
Равновесная концентрация серы в зависимости от парциального давления диоксида серы, кислорода и температуры в этом случае описывается уравнением
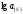 =
=
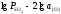 - 17653/Т
+1.89 (2.61)
- 17653/Т
+1.89 (2.61)
При сжигании природного газа парциальное
давление SO2в
атмосфере печи составляет 0.0003 МПа. Для
этих условий, а также при [О]=0.2 (% массе),
активности кислорода
a[O]=
0,0014,
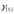 =1
и температуре 1423 К, равновесная
концентрация серы в меди составляет
2,7∙ 10-6 % ( по массе).
=1
и температуре 1423 К, равновесная
концентрация серы в меди составляет
2,7∙ 10-6 % ( по массе).
Результаты выполненных расчетов свидетельствуют о возможности достижения требуемых остаточных концентраций серы в меди ( < 0,005 %) за счет выделения из расплава пузырьков SO2 . В этом момент наблюдается характерное «кипение ванны». Однако для более полного протекания процесса десульфурации металла необходимо поддерживать соответствующую степень окисленности меди ( 0,1-0,2 % [O]) и температуру (1415-1435 К).
В условиях барботажа расплава газообразными восстановителями одновременно протекает и десорбция жидкой меди. Дегазирующее действие основано на разнице парциальных давлений газов в меди и в пузырях, вследствие чего последние поглощают растворенные газообразные продукты реакций и выносят их на поверхность ванны. Использование в качестве восстановителя аммиака способствует десорбции газов, т.к. его взаимодействие с кислородом меди сопровождается образованием азота, являющимся дегазатором металла.
Эффективность дегазации может быть
повышена вакуумированием меди или с
использованием опыта предприятий черной
металлургии продувкой расплава инертными
газами. Рассчитаем, например, потребное
количество аргона для удаления 50% серы
из анодной меди с
исходной равновесной концентрацией
2,7∙10-6
% , содержащей 0.2 % (по массе) кислорода
при 1423 К.
Масса удаляемой серы в виде SO2, с одним бесконечно малым объемомdVпузырьком аргона составит
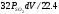 ,(2.61)
,(2.61)
где:
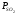 -
равновесное парциальное давлениеSO2в пузырьке аргона вмомент
его отделения от металла; dV
— объем пузырька аргона, содержащий
равновесное количествоSO2.
-
равновесное парциальное давлениеSO2в пузырьке аргона вмомент
его отделения от металла; dV
— объем пузырька аргона, содержащий
равновесное количествоSO2.
Переход серы из меди в пузырек аргона в виде SO2, приводит к изменению количества растворенной серы в 1 т меди на величину
(1000/100) d[S](2.62)
Подставляя в
выражение 2.61 величину
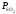 =Кp
[S]∙[О]2,
приравнивая 2.61 к 2.62 и интегрируя
полученное уравнение относительноdV
=Кp
[S]∙[О]2,
приравнивая 2.61 к 2.62 и интегрируя
полученное уравнение относительноdV

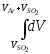 =
=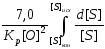 (2.63)
(2.63)
Получим
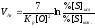 (2.64)
(2.64)
Допуская, что пузырек аргона, выходя из металла, имеет парциальное давление SO2, соответствующее равновесному состоянию c величиной Кp, рассчитанной по уравнению 2.59 и равной 45808 (1423 К). После подстановки численных значенийКр, концентрацийкислорода (0.008 мол.), серы [S]псх = =5,3∙10-8 мол, [S]кон =2,65∙10-8 мол. в уравнение 2.64, окончательно получим
V=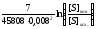 =13,2
дм3/т..
(2.64)
=13,2
дм3/т..
(2.64)
Лекция 19. Практика рафинирования.
