
- •Раздел 1. Введение. Лекция 1. Требования, предъявляемые к современным металлургическим процессам.
- •Вопрос 1. Комплекснгость использования сырья (кис)
- •Вопрос 2. Экологическая безопасность технологий.
- •Вопрос 3. Удельная производительность оборудования
- •Вопрос 1. Способы получения порошков.
- •Вопрос 2. Механическое изельчение
- •Вопрос 3. Распыление расплава
- •Вопрос 1. Твердофазное восстановление
- •Вопрос 2. Электролиз.
- •Вопрос 3. Цементация
- •Вопрос 4. Карбонильный метод
- •Вопрос 5. Термолиз
- •Вопрос 6. Автоклавный способ
- •Вопрос 7. Специальные способы
- •Вопрос 1. Химические свойства
- •Вопрос 2. Физические свойства
- •Вопрос 3. Технологические свойства
- •Вопрос 4. Производство изделий из порошков
- •Раздел 3. Автогенные процессы в металлургии меди. Лекция 5. Некоторые теоретические аспекты автогенных процессов
- •Вопрос 1. . Физико-химические принципы автогенности, методы достижения.
- •Вопрос 2.Особенногсти тепловых балансов.
- •Вопрос 3. Влияние различных факторов на тб ап в общем случае автогенный режим автогенных процессов зависит от следующих факторов:
- •Вопрос 4. Оксисульфидные системы.
- •Лекция 3. Практика автогенных процессов (ап)
- •Вопрос 1. Классификация ап и преимущества ап
- •Совмещенная плавка-конвертирование (спк)
- •Технологические преимущества автогенных процессов.
- •Вопрос 2. Кислородно-факельная плавка, аппаратурное оформление
- •Технологическая схема приведена на рис. 1. Вопрос 2. Особенности ф-х процессов технологии
- •Вопрос 3. Технологическая схема производства с использованием кфп следующая
- •Вопрос 3. Т-э показатели процессса, преимущества, недостатки, перспективы.
- •Недостатки:
- •Лекция 7. Плавка во взвешенном состоянии.
- •Вопрос 2. Практика процесса.
- •Недостатки ап первой группы (классификация):
- •Лекция 8. Плавка в печах Ванюкова.
- •Вопрос 2. Конструкция печи. Печь представляет собой шахту, кессонированную в средней части и футерованную ниже оси фурм.
- •Вопрос 7. Показатели и перспективы процесса пв:
- •Вопрос 1. Спк на уральских предприятиях(оао «ммск»)
- •Вопрос 2. Практика спк на оао «Святогор». Технологическая схема спк на оао «Святогор» включает (рис.2.) плавку концент-
- •Вопрос 3. Технология «Эльтениенте» (Чили).
- •Вопрос 2. Технология «Мицубиси»
- •Вопрос 3. Практика работы завода «Гресик» Индонезия
- •Лекция 11. Ап с погружной фурмой. Аусмелт
- •Вопрос 1. Классификация процессов.
- •Особенность фурмы аусмелт
- •Вертикальная фурма многоцелевого назначения.
- •Вопрос 2. Оосбенности технологии « кивцэт»
- •Вопрос 3. Схема кифцэт:
- •Показатели
- •Вопрос 3. Факельно-барботажная плавка фбп.
- •Технико-экономические показатели факельно-барбатажной плавки:
- •Раздел 4. Современное состояние и пути модернизации существующих процессов.
- •Вопрос 2. Характеристика шахтной плавки.
- •Вопрос 1. Характеристика современного состояния
- •Вопрос 2. Пути совершенствования оп и ее перспективы
- •Лекция 14. Современное состояние процесса конвертирования медных штейнов и перспективы развития производства.
- •Вопрос 1. Теория конвертирования
- •Вопрос 1. Распределение основных спутников меди
- •Лекция 16 Современная практика конвертирования и направление совершенствования процесса.
- •Вопрос 1. Характеристика конвертеров и технологии
- •Вопрос 2. Прогресс в области конвертирования:
- •Вопрос 3. Повышение качества флюса.
- •Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
- •Вопрос 1. Термодинамика реакций окисления меди и примесей
- •Вопрос 2. Анализ системы Cu-п-о
- •Вопрос 5. Термодинамика дегазации и раскисления
- •Вопрос 1. Типы печей.
- •Стационарная отражательная печь
- •Технические характеристики пламенных печей
- •Наклоняющиеся печи, по сравнению с отражательными печами, имеют преимущества:
- •Вопрос 2. Характеристика печи «Мерц»
- •Вопрос 3. Оборудование для разливки анодов
- •Вопрос 4. Разливочная машина.
- •Технические характеристики
- •Лекция 20. Технология рафинирования. Режимные параметры операций
- •Вопрос 1. Основные операции рафинрвания
- •Вопрос 3. Виды восстановителя
- •Вопрос 4.Особенности восстановления в печи Мерц
- •Вопрос 5. Реагентное рафинирование.
- •Вопрос 2. Поведение примесей на аноде и катоде
- •Вопрос 4. Образование медеэлектролитного шлама
- •Вопрос 5. Пассивация анода
- •Вопрос 6. Структура катодных осадков
- •Вопрос 7. Добавки в электролит
- •Вопрос 8. Влияние температуры электролита
- •Вопрос 3. Принцип работы автоматической линии для сборки и расстановки стартерных катодов
- •Вопрос 4. Работа «Стрипп-машины».
- •Вопрос 5. Конструкции электролизных ванн
- •Вопрос 6. Системы включения электродов
Вопрос 2. Поведение примесей на аноде и катоде
По величине стандартного потенциала и характеру поведения примеси, содержащиеся в аноде, обычно делят на четыре основные группы (табл. 5.1):
-никель, железо, цинк, марганец, свинец,
олово, кобальт и другие металлы, у
которых стандартный потенциал более
отрицателен, чем
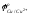 ;
;
мышьяк, сурьма, висмут - металлы, потенциал которых близок к
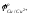 ;
;золото, серебро, платиноиды, селен, теллур, у которых потенциал положительнее, чем ;
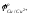 ;
;химические и интерметаллические соединения меди, серебра и ряда других металлов (Сu2O, СuS, Сu2Sе, Сu2Те, Аs2Sе, Аs2Те, МеO∙Cu2Oи им подобные), переходящие в основном в шлам.
В соответствии с общепринятыми представлениями о механизме электрохимического растворения анода в раствор в первую очередь переходят металлы, потенциал растворения которых более отрицателен, чем потенциал меди. Эти примеси накапливаются в электролите. Если по каким-либо причинам (например, неравномерное растворение анода) они и попадают в шлам, то затем химически растворяются в электролите с образованием сернокислых соединений. Так как электроотрицательных примесей весьма немного, первый слой анода быстро обедняется ими и на поверхности останутся в основном медь, электроположительные металлы и нерастворимые примеси. Затем растворяется медь, будучи наиболее отрицательным из оставшихся элементов. Таким образом, обнажается следующий слой анода, благодаря чему происходит непрерывное растворение как меди, так и электроотрицательных примесей. При этом электроположительные примеси и электрохимически малоактивные вещества формируют отдельные нерастворенные островки, которые время от времени, теряя сцепление с основой, осыпаются.
Однако необходимо отметить, что такой механизм растворения медных анодов иногда не согласуется с результатами анализа их вещественного состава, в соответствии с которым большинство примесей присутствует в нем в виде твердых растворов в меди, и самостоятельной фазы, как правило, не образуют.
Железо при растворении медного анода переходит в раствор в виде ионов Fе2+, которые в процессе электролиза частично окисляются доFе3+в результате взаимодействия с кислородом воздуха, присутствующим в электролите
2FеSО4+0.5О2+Н2SО4 = Fе2(SO4)3+Н2O, (5.44)
что способствует растворению металлической меди как на аноде, так и на катоде и тем самым снижает катодный выход по току:
Сu + Fе2(SO4)3 = СuSO4 + 2FeSO4 (5.45)
На катоде возможна также реакция
Fе3+ - е = Fе2+,(5.46)
дополнительно снижающая выход меди по току.
Расчетные значения коэффициентов диффузии ионов Fе3+ и Сu2+, установленные применительно к условиям рафинировочного процесса с использованием метода вращающегося электрода, достаточно близки (соответственно 0,53∙10-9и 1,4∙10-9м2/с и поэтому концентрация ионовFе3+ в электролите в значительной степени оказывает влияние на выход меди по току. Например, в электролите (состав, г/дм3: Н2SO4150, Сu50) выход по току уменьшаетсяна 1,0-1,5% при увеличении концентрации железа на 1 г/дм3; при электролизе разбавленных медьсодержащих растворов аналогичные потери тока составляют около 0,3 % на каждый 1 мг/ дм3 железа. Поэтому железо является крайне нежелательной примесью.
Совместный разряд ионов меди и железа в обычных условиях электролиза и концентрациях последнего невозможен. Частичный переход железа в катодный осадок обусловлен механическим включением его сернокислых солей и малорастворимых соединений. Известно, что у поверхности катода электролит подщелачивается и железо здесь находится в виде коллоидной взвеси гидроксида, которая иногда, действуя подобно поверхностно-активной добавке, способствует образованию плотных мелкокристаллических осадков меди. Осадки меди, полученные из растворов, содержащих ионы группы железа, отличаются эластичностью и высокодисперсной плотной структурой.
Никель из анода переходит в раствор и осложняет ведение процесса. Электрохимически он не осаждается на катоде, однако повышение концентрации никеля сверх 20 г/дм3ухудшает качество катодного осадка, снижает технико-экономические показатели процесса. Высокая концентрация в растворе сульфата никеля уменьшает растворимость в нем сульфата меди, приводит к солевой пассивации анодов, повышает электросопротивление электролита и увеличивает его вязкость, что способствует образованию на катоде шишек и дендритов и вызывает ряд других отрицательных явлений. В особо чистом электролите (0.25 М СuSO4и 0.1 М Н2SO4) уже при концентрациисульфата никеля 10-10 М увеличивается перенапряжение осаждения меди, а на кристаллах осадка появляются ямки травления. Влияние никеля на внешний вид медных катодов сводится к тому, что в присутствии его небольших количеств (менее 14 г/дм3) выравнивается рельеф осадка и развивается его тонкая структура. При введении в электролит никеля в количествах более 30 г/дм3снижается качество катодной поверхности: увеличивается амплитуда крупных неровностей и уменьшается шаг их следования.
При электролитическом рафинировании рядовых анодов в шлам переходит не более 10% никеля. Накапливание его в электролите не только усложняет технологию рафинирования, увеличивая расход электроэнергии всреднем на 20% на каждые 10 г/дм3 никеля, но и увеличивает концентрацию сурьмы в электролите за счет образования комплексных соединений. Примесь никеля в электролите снижает качество катодной меди, поскольку уменьшает долю миграции ионов меди к катоду в суммарной величине массопереноса, уменьшает предельный ток разряда ионов меди и смещает зону образования переходных осадков в область более низких плотностей тока с соответствующим уменьшением зоны компактных осадков.
При исследовании влияния состава электролита и анода на растворение меди найдено, что в шламе не пассивирующихся образцов, наряду с медной основой, имеется металлическое серебро и отсутствует Cu2O. В шламе пассивирующихся анодов, кроме этого, обнаружены соединения NiO, NiS, Сu2S, Си2O, Sb2O3, АsСuSе, СuС12∙2Н2O, АgС1, а также СuSO4 и NiSO4 с различной степенью гидратации. При этом максимальный ток в предпассивном состоянии при установившейся скорости растворения уменьшается с увеличением концентрации примесей, влияние которых убывает в ряду: Аs→ Ni→ РЬ.
С повышением концентрации кислорода в анодах большая часть никеля переходит в шлам, где он присутствует в виде «слюдки» ЗСu2O∙4NiO∙Sb2O5, медно-никелевого арсенатаNiO∙СuО ∙Аs2O3, а также NiO,NiSO4и некоторых других соединений. При исследовании рафинирования кислородсодержащей анодной меди с концентрацией никеля 0,1-3,0% показано, что выход шлама и концентрация в нем меди увеличиваются при увеличении концентрации никеля. При растворении таких анодов на их поверхности образуются труднорастворимые пленки, обогащенные благородными металлами. Удерживаясь на поверхности анодов, они вызывают неравномерное растворение или пассивацию последних; отслаиваясь и сползая с анодов, они могут быть причиной коротких замыканий.

Рис. 5.4. Зоны образования компактных осадков меди (заштрихованы)
в никельсодержащем электролите (концентрация Ni: 1-0.0; 2- 0.34)
В кислородсодержащей меди никель при концентрации 0.25-0.30% присутствует в виде твердого раствора. При медленном охлаждении анодов по границам зерен фазы Сu+Сu2Oвыделяется эвтектоидная фаза с концентрациейникеля 0,1% и кислорода 0,1%. В результате термообработки таких анодов в аргоне (отжиг при 1273 К и 10-часовая выдержка при 733 К) фаза Си2Oисчезает, а растворимость анодов увеличивалась до такой степени, что запассивировать их в обычных условиях электролиза не представляется возможным. При повышенной концентрации кис- лорода и никеля (более 0.3% и 0.6%, соответственно) увеличивается количество эвтектоидной фазы и появляется отдельная фаза N10, нерастворимая в электролите и полностью переходящая в шлам. При дальнейшем увеличении концентрации кислорода никель в сплаве присутствует в основном в виде оксида, а электролиз сплава сопровождается значительным увеличением количества шлама. В этом случае никелевой слюдки в аноде не обнаруживается. Анализом электрохимических реакций анодного растворения сплава Сu-Ni-Oи исследованием кинетики анодных процессов, выполненных на промышленных образцах никельсодержащей меди, установлено, что с увеличением концентрации кислорода в анодной меди, содержащей никель как основную примесь, увеличивается степень перехода никеля в шлам, которая может составить 30% и более.
Таким образом, склонность медного анода к пассивации и количество шлама на его поверхности увеличиваются с увеличением концентрации в нем и никеля, и кислорода.
На основании этих данных предложен механизм перехода никеля из анода в шлам за счет интеркристаллической коррозии зерен меди на межфазной границе и выкрашивания частиц с повышенным содержанием никеля. Количество никеля в шламе прямо зависит от концентрации никеля и кислорода в аноде. Поэтому глубина раскисления меди при огневом рафинировании оказывает значительное влияние на технико-экономические показатели электрохимического рафинирования меди, что, прежде всего, связано с отрицательным влиянием примеси кислорода в анодном металле, особенно в присутствии никеля, мышьяка и сурьмы.
Олово переходит в раствор в виде ионов Sn2+, а затем окисляется доSn4+, что также приводит к дополнительному расходу электрического тока. Образующийся сульфатSnSO4легко гидролизуется с образованием основных малорастворимых солей, переходящих в состав шлама.
Свинец, переходя в раствор, образует малорастворимую соль РbSO4, выпадающую в осадок. При изучении поведения свинца в условиях растворения медного анода в зависимости от концентрации примесей и кислорода в аноде и серной кислоты в электролите установлено, что он образует на аноде гранулы при его концентрациях в аноде < 0,5%. При более высоких концентрациях возникает ячеистая сетевидная структура медной матрицы. Зависимости потенциала анода от времени имеют прерывистый, ступенчатый характер, определяющийся периодическим самопроизвольным отделением шлама от поверхности анода в течение электролиза. Образуется слипающийся шлам, которыйимеет темно-коричневый цвет и состоит в основном из сульфата свинца и медного порошка; соотношение этих компонентов в шламе возрастает в пределах 50-80% с увеличением содержания свинца в аноде. Характерно, что РbSO4отлагается вокруг нерастворенного металлического свинца. При электролизе анода, содержащего Аs, Рbи О, образуется шлам, в основном состоящий из РbSO4и Си3Аsсо следами Аs2O3, РbО и нерастворенного свинца.
Накопление примесей первой группы в электролите, особенно при плотностях тока выше 220 А/м2 и недостаточной циркуляции электролита, создает условия для совместного их разряда с медью и загрязнения катодного осадка этими металлами. Увеличение концентрации примесей (Fе2+, Fе3+, Мn2+, Ni2+, Со2+ в форме соответствующих сульфатов) в сульфатном электролите (Сu2+ 40 г/дм3, Н2SO4150 г/дм3) повышает плотность и вязкость электролита и понижает его электропроводность, а следовательноувеличивает энергозатраты, понижает величину предельно допустимого тока и коэффициент массопереноса. Примеси влияют также на электрокристаллизацию меди на катоде: методом дифракции рентгеновских лучей и сканирующей электронной микроскопии показано, что наличие примесей стимулирует развитие пирамидальной и планарной структуры катодного осадка.
Цинк, даже при высоких концентрациях в электролите, не оказывает заметного влияния на электроосаждение меди, поскольку имеет, по сравнению с последней, значительно более отрицательный потенциал и из растворов простых солей совместно с медью разряжаться не может.
Увеличение концентрации сульфатов никеля, железа и цинка в электролите уменьшает его электропроводность. Кроме того, эти сульфаты, участвуя в переносе тока, создают неблагоприятные условия для разряда ионов меди: ионы примесей накапливаются в прикатодном слое, чем уменьшают ее концентрацию у катода и затрудняют доставку в него ионов меди. Загрязнение катодного осадка примесями первой группы, сульфаты которых растворимы в электролите (цинк, железо, никель), связано с окклюзией - захватом электролита растущим осадком, что подтверждается взаимосвязью концентраций этих примесей в катодах и в растворе.Действенным приемом очистки катодов от таких примесей является промывка катодов, наиболее эффективная при использовании ультразвука, обеспечивающего удаление примесей из микропор, по размеру сопоставимых с длиной волны ультразвука.
При выявлении причин загрязнения катодного осадка меди даже малорастворимыми в электролите примесями следует учитывать отмеченное выше различие состава раствора в диффузионном слое у поверхности катода (расчетная толщина слоя - около 0,15 мм) и в объеме электролита; диффузия катионов в этот слой приводит к превышению в нем предела растворимости солей с последующей кристаллизацией: сульфатов (свинца), арсенатов и антимонатов (цинка) и др.
Наибольшую опасность загрязнения катодного металла вызывают примеси мышьяка, сурьмы и висмута, потенциал разряда которых близок к стандартному равновесному потенциалу меди. Накопление этих примесей в электролите увеличивает вероятность попадания их в катодный осадок. Даже небольшое содержание этих металлов в катодном осадке существенно снижает его электропроводность. Присутствие же висмута резко ухудшает механические свойства меди.
Для уменьшения вероятности совместного разряда с медью этих примесей применяют следующие приемы:
-регенерацию электролита, в процессе которой растворы подвергают очистке и часть растворов выводят из технологического цикла, во избежание превышения допустимой концентрации примесей;
-увеличение концентрации серной кислоты в электролите, вызывающее заметное понижение концентрации в нем ионовSb3+и Вi+;
-добавление в состав электролита ионов хлора, уменьшающих концентрацию ионов Аs3+;
-увеличение скорости циркуляции электролита, предотвращающее уменьшение концентрации ионов меди в прикатодном слое.
В наиболее распространенных промышленных условиях электролитического рафинирования меди (35 г/дм3Сu,180 г/дм3 Н2SO4, 333 К и 230 А/м2 ) как металлический, так и окисленный мышьяк, содержащийся в аноде, растворяется в электролите в форме Аs3+ и далее окисляется кислородом воздуха до Аs5+. При высоком содержании мышьяка в аноде происходит обогащение электролита медью и обеднение кислотой. Благодаря большому сродству мышьяка ккислороду, находящемуся в аноде, происходит усиленное зашламление последнего. Сурьма обладает меньшим, чеммышьяк, сродством к кислороду, поэтому в меньшей степени влияет на зашламление анода и почти полностью переходит в раствор.
Влияние висмута и кислорода на растворение медного анода и образование шлама было изучено в лабораторных условиях. Анод был выплавлен из электролитической меди с добавками металлического висмута и Си2Oв качестве примесей (концентрация, %: Вi 0.4-4.2; О 0,0145-0,282). В аноде висмут находился в виде отдельных включений по границам зерен меди или в самих зернах. Электролиз (состав электролита, г/дм3: Сu 40, Н2SO4 180, клей 1) проводили при температуре 323 К. Шлам, образующийся в процессе электролиза, в основном концентрировался на дне ячейки (порошкообразная медь, упавшая с анода), хотя небольшое количество его обнаружено и на аноде (порошкообразные медь и В12(SO4)3, содержащие Вi2O3). Растворенный в электролите висмут осаждался из насыщенного раствора в виде сульфата за счет взаимодействия ионовВi3+ и SO42-. Увеличение плотности тока, концентрации кислорода и ионов Вi3+в электролите ускоряло процесс образования Вi2(SO4)3и соответственно приводило к пассивации анода. Сопутствующие висмуту примеси -Sbи Аs- образовали соединения Сu3Аs,Sb2O3, ВiАs04иSbАsO4.
Мышьяк, сурьма и висмут при растворении анода частично переходят в раствор, а частично - в шлам. Распределение между раствором и шламом чаще всего составляет: мышьяка 7:3, сурьмы - 4:6, висмута - 2:8. Таким образом, эти три элемента существуют как в форме твердых частиц, так и в виде растворенных соединений. Твердые частицы оксидов и основных солей, получающихся при гидролизе, могут образовать хорошо сформированные кристаллы,оседающие на дно ванны. Иногда они присутствуют в виде мелкодисперсных частиц, размеры которых близки к коллоидным; в растворе они находятся в форме взвесей и создают плавучие шламы. Время пребывания частиц шлама во взвешенном состоянии зависит от размера и природы частиц, от плотности электролита, скорости его циркуляции и ряда других факторов.
Вопрос 3. Плавучие шламы. Плавучие шламы, являющиеся продуктом вторичных процессов (образования малорастворимых соединений), значительно ухудшают качество катодного осадка, поскольку они легко ассимилируются растущим осадком и обычно являются центрами образования дендритов и шишек. Присутствие металлической меди в плавучем шламе связано с образованием гидрофобных микрочастиц металлической меди в результате диспропорционированиясоединений меди (I). Процесс включения частиц шлама в катодный осадок состоит из следующих стадий: подхода частиц к катодной поверхности, закрепления частицы на этой поверхности, зарастания частицы. Электрорафинирование меди в присутствии плавучего шлама сопровождается увеличением безвозвратных потерь благородных металлов. Частицы шлама проводят электрический ток и поэтому, при попадании их на поверхность катода, медь нарастает и по их поверхности, а это увеличивает шероховатость осадка. Такой осадок всегда богаче благородными металлами и примесями, чем ровный осадок; например, концентрация золота в шишках более чем в 300 раз превышает таковую в рядовом катоде.
Формирование плавучих шламов связывают не только с труднорастворимыми соединениями сурьмы и мышьяка, но и с пассивацией анодов; с увеличением вязкости электролита при его охлаждении или повышении в нем концентрации сульфатной группы; с повышением содержания тиомочевины; с попаданием смазочных масел в электролит, вызывающих флотацию частиц тонкодисперсногошлама. Устранение этих причин и является средством борьбы с возникновением плавучих шламов.
Примеси третьей группы, не растворяющиеся анодно (более электроположительные, чем медь, металлы: Аu, Аg, Sе, Те, Рt и платиноиды) переходят в шлам. В случае недостатка халькогенов, золото и серебро, находящиеся в аноде в виде твердых растворов, выделяются в элементномвиде. При избытке халькогенов, в основном селена, происходит выделение элементных халькогенов, а также происходит увеличение доли диселенидов, образование селенидасвинца, вторичного селенида меди. Эти компоненты вместе с другими нерастворимыми соединениями и составляют основу шлама. Установлено, что в них большая часть золота входит в медную матрицу, образуя твердый раствор наоснове меди. Более 95% серебра также входит в медную матрицу, остальная его часть в основном ассоциирована с СuSе. В процессе электролиза они освобождаются из медной матрицы и образуют самостоятельную фазу: на поверхности селенида начинается рост сфероидальных золотых частиц размером менее 1 мкм.
Оксидные матричные фазы могут содержать более 22% Аs. В процессе электролиза серебро растворяется, но большая часть растворенного серебра затем быстро удаляется из раствора, образуя труднорастворимые осадки. В анодных шламах обнаружены сложные комплексы, содержащие около 12% Аи (ориентировочная формула Аu(Аg,Сu)6Sе5). Серебро также реагирует с выделившимися из анода частицами Си2(Sе,Те), образуя АgСuSе и Аg2Sе. Реакции протекают достаточно быстро; около 50% серебра реагирует за первые 5 ч. По отношению Аg/(Sе+Те) в медных анодах можно судить о содержании селенидов в анодном шламе.
Поведение серебра при электролизе меди было изучено на шести промышленных образцах медных анодов (состав, %: Сu 98,8-99,4; Аg 0,019-0,14; Рb 0,003-0,13; Ni 0,06-0,31, примеси Вi, Sb, Аs, Sе и Те). Переменные параметры: температура 333, 338 и 343 К, плотность тока 280, 350 и 420 А/м2. Состав электролита, г/дм3: Сu42±2; Н2SO4160±5, добавки (в г на 1 т Сu): тиомочевина 60, клей 100; скорость подачиэлектролита 30 дм3/час. Электролизер (вместимость 15,5 дм3) был снабжен разделительной диафрагмой и устройством для периодического удаления образующихся шламов. Показано, что при анодном растворении меди определенное количество серебра находится в растворе в коллоидной форме при концентрации, значительно превышающей равновесную, причем на анодное поведение серебра оказывают влияние примеси, содержащиеся в исходных анодах (Sе, Аs). Рассчитана энергия активации исследуемого процесса, равная для различных образцов анодов 50-116 кДж/моль. Отдельные металлы платиновойгруппы при электрорафинировании меди ведут себя по-разному. Всего 1-5% платины и палладия переходят из анодов в электролит, остальное - в шлам; родий, рутений и осмий растворяются в электролите в виде комплексных ионов, частично разряжающихся на катоде; иридий хорошо растворяется в электролите в составе стабильных комплексных ионов, которые на катоде не разряжаются. При типичных условиях промышленного электролиза (состав электролита, г/дм3:Н2SO4 140-190, Сu 40-45, температура 328-333 К) извлечение в электролит составило, %:Iг> >(80) >Ru(64,5) >Os(56)> Рt (2) > Рd (0). Извлечение в шлам, %: Рt (94) = Рd(94) > Rh (44) > Os (31) >Ru (25) > Iг (17). Плотность тока в пределах 200-400 А/м2 не влияет на эти порядки расположения металлов. Применение реверсивного тока повышает извлечение в электролит платины, палладия и родия (до 10-15%) и их концентрацию в катодной меди (до 3,5%), но не влияет на иридий и рутений из-за стабильности их комплексных ионов. В ходе электролитического обезмеживания отработанного электролита все металлы платиновой группы проявляют тенденцию к переходу в катодную медь.
При изучении влияния селена и кислорода на поведение медных анодов при электролизе в исходном аноде обнаружены сфероидальные и эллипсоидальные частицы Сu2Sе, покрытые пленкой из смеси Сu2Sе и Си2O. При электролизе частицы Си2Sе не растворяются, а образуют шламовую корку на аноде. Корка не образуется при плотностях тока <2 А/дм2и появляется при плотностях тока свыше3 А/дм2, причем при электролизе происходит удаление меди из корки с образованием при соответствующих анодныхпотенциалах фаз определенных составов: Сu2Sе (100 мВ), Сu3Sе2 (440 мВ) и СuSе (740 мВ). При повышенных температурах из пленки Сu2Sе-Сu2Oвыделяется самостоятельная фаза Си2O. Шламовые корки, образующиеся на аноде при повышенных температурах, прочно связаны с основой и приводят к пассивации медного анода, а следовательно,и к ухудшению технологических параметров процесса.
Благородные металлы частично попадают в катодный осадок (например, содержание золота достигает 0.1-1 г/т). Это в основном результат механического захвата шлама развитой поверхностью катода и поэтому переход благо родных металлов в катоды увеличивается с повышением плотности тока, уменьшением расстояния между электродами и чрезмерным увеличением скорости циркуляции электролита. В промышленных условиях неоднократно отмечалась прямая зависимость заработки серебра в катодный осадок от содержания шламовых взвесей в электролите.
Явление механического захвата растущим медным (или никелевым) катодным осадком твердых частиц - алмазного порошка АСМ крупностью (5-20)-106м - использованов технологии упрочнения инструмента для обработки сверхтвердых материалов. Композиционное покрытие осаждалось на горизонтально расположенный катод из бронзыБРОФ 6.5-0.15 площадью25∙10-6 м2. Электроосаждение проводилось из электролита никелирования Уоотса и кислого электролита меднения. Бронзовые образцы предварительно покрывались никелем или медью в течение 10 мин. Электроосаждение проводилось без перемешивания после однократного взмучивания и оседания алмазного порошка на катод. После снятия поляризационной кривой незакрепленный алмазный порошок смывался с катода и с помощью микроскопа ОРИМ-1 определялась поверхностная концентрация порошка в покрытии. Разработанная на основании проведенных исследований технология позволяетполучить монослойные и многослойные покрытия с требуемой поверхностной концентрацией алмазного порошка в пределах от 5 до 60%.
Небольшое количество серебра в виде Аg2SO4(до10-3 г/дм3) переходит в раствор. На модельных анодах, содержащих 0,3-1,0% Аg, изучено влияние ряда параметров электролиза на содержание серебра в катодной меди (температура, концентрация серебра в исходных анодах, скорость циркуляции электролита и др.). Наибольший эффект на исследуемый процесс оказывает температура 1 для минимизации концентрации серебра в катодном осадке температура электролита должна быть не выше 318 К. В этом случае катодная медь содержит 0,3∙10-3Аg. В то же время изменение скорости циркуляции электролита от 3,0 до9,0 дм3/час практически не оказывало влияния на катодное соосаждение серебра.
Неметаллические примеси (Сu2O, Си2Sе, СuS, Сu2Те,NiO,ZnО,SnО и др.) также в основном переходят в шлам. В процессе рафинирования селениды и теллуриды меди превращаются в селениды и теллуриды благородных металлов: АuТе2, АgТе, Аg2Sе, СuАgSе. Оксид меди Си2O, находясь уже в составе шлама, частично растворяется в электролите, тем самым обогащая его медью и увеличивая расход серной кислоты, а частично распадается с образованием более устойчивого при низких температурах оксида СuО. В обоих случаях вследствие диспропорционирования соединений меди (I) образуется порошкообразная металлическая медь, переходящая в шлам, в т.ч. - взвешенный в электролите.
Катодная медь чистотой 99,999% была получена из черновой меди электролизом с применением диафрагмы, уменьшающей механический захват частиц шлама растущим осадком. В диафрагму с воздухопроницаемостью 0,5-6,0 см3/(с∙см2), окружающую катод, подавали электролит, содержащий сульфат меди и серную кислоту, а также вяжущее вещество из расчета 5-20 г на 1 т электролитическоймеди. Электролиз вели при температуре 303-323 К и плотности тока на катоде 50-150 А/дм2.
Электролит непрерывно выводили из электролизера и фильтровали для удаления твердых примесей, а затем возвращали внутрь диафрагмы.
