
- •Раздел 1. Введение. Лекция 1. Требования, предъявляемые к современным металлургическим процессам.
- •Вопрос 1. Комплекснгость использования сырья (кис)
- •Вопрос 2. Экологическая безопасность технологий.
- •Вопрос 3. Удельная производительность оборудования
- •Вопрос 1. Способы получения порошков.
- •Вопрос 2. Механическое изельчение
- •Вопрос 3. Распыление расплава
- •Вопрос 1. Твердофазное восстановление
- •Вопрос 2. Электролиз.
- •Вопрос 3. Цементация
- •Вопрос 4. Карбонильный метод
- •Вопрос 5. Термолиз
- •Вопрос 6. Автоклавный способ
- •Вопрос 7. Специальные способы
- •Вопрос 1. Химические свойства
- •Вопрос 2. Физические свойства
- •Вопрос 3. Технологические свойства
- •Вопрос 4. Производство изделий из порошков
- •Раздел 3. Автогенные процессы в металлургии меди. Лекция 5. Некоторые теоретические аспекты автогенных процессов
- •Вопрос 1. . Физико-химические принципы автогенности, методы достижения.
- •Вопрос 2.Особенногсти тепловых балансов.
- •Вопрос 3. Влияние различных факторов на тб ап в общем случае автогенный режим автогенных процессов зависит от следующих факторов:
- •Вопрос 4. Оксисульфидные системы.
- •Лекция 3. Практика автогенных процессов (ап)
- •Вопрос 1. Классификация ап и преимущества ап
- •Совмещенная плавка-конвертирование (спк)
- •Технологические преимущества автогенных процессов.
- •Вопрос 2. Кислородно-факельная плавка, аппаратурное оформление
- •Технологическая схема приведена на рис. 1. Вопрос 2. Особенности ф-х процессов технологии
- •Вопрос 3. Технологическая схема производства с использованием кфп следующая
- •Вопрос 3. Т-э показатели процессса, преимущества, недостатки, перспективы.
- •Недостатки:
- •Лекция 7. Плавка во взвешенном состоянии.
- •Вопрос 2. Практика процесса.
- •Недостатки ап первой группы (классификация):
- •Лекция 8. Плавка в печах Ванюкова.
- •Вопрос 2. Конструкция печи. Печь представляет собой шахту, кессонированную в средней части и футерованную ниже оси фурм.
- •Вопрос 7. Показатели и перспективы процесса пв:
- •Вопрос 1. Спк на уральских предприятиях(оао «ммск»)
- •Вопрос 2. Практика спк на оао «Святогор». Технологическая схема спк на оао «Святогор» включает (рис.2.) плавку концент-
- •Вопрос 3. Технология «Эльтениенте» (Чили).
- •Вопрос 2. Технология «Мицубиси»
- •Вопрос 3. Практика работы завода «Гресик» Индонезия
- •Лекция 11. Ап с погружной фурмой. Аусмелт
- •Вопрос 1. Классификация процессов.
- •Особенность фурмы аусмелт
- •Вертикальная фурма многоцелевого назначения.
- •Вопрос 2. Оосбенности технологии « кивцэт»
- •Вопрос 3. Схема кифцэт:
- •Показатели
- •Вопрос 3. Факельно-барботажная плавка фбп.
- •Технико-экономические показатели факельно-барбатажной плавки:
- •Раздел 4. Современное состояние и пути модернизации существующих процессов.
- •Вопрос 2. Характеристика шахтной плавки.
- •Вопрос 1. Характеристика современного состояния
- •Вопрос 2. Пути совершенствования оп и ее перспективы
- •Лекция 14. Современное состояние процесса конвертирования медных штейнов и перспективы развития производства.
- •Вопрос 1. Теория конвертирования
- •Вопрос 1. Распределение основных спутников меди
- •Лекция 16 Современная практика конвертирования и направление совершенствования процесса.
- •Вопрос 1. Характеристика конвертеров и технологии
- •Вопрос 2. Прогресс в области конвертирования:
- •Вопрос 3. Повышение качества флюса.
- •Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
- •Вопрос 1. Термодинамика реакций окисления меди и примесей
- •Вопрос 2. Анализ системы Cu-п-о
- •Вопрос 5. Термодинамика дегазации и раскисления
- •Вопрос 1. Типы печей.
- •Стационарная отражательная печь
- •Технические характеристики пламенных печей
- •Наклоняющиеся печи, по сравнению с отражательными печами, имеют преимущества:
- •Вопрос 2. Характеристика печи «Мерц»
- •Вопрос 3. Оборудование для разливки анодов
- •Вопрос 4. Разливочная машина.
- •Технические характеристики
- •Лекция 20. Технология рафинирования. Режимные параметры операций
- •Вопрос 1. Основные операции рафинрвания
- •Вопрос 3. Виды восстановителя
- •Вопрос 4.Особенности восстановления в печи Мерц
- •Вопрос 5. Реагентное рафинирование.
- •Вопрос 2. Поведение примесей на аноде и катоде
- •Вопрос 4. Образование медеэлектролитного шлама
- •Вопрос 5. Пассивация анода
- •Вопрос 6. Структура катодных осадков
- •Вопрос 7. Добавки в электролит
- •Вопрос 8. Влияние температуры электролита
- •Вопрос 3. Принцип работы автоматической линии для сборки и расстановки стартерных катодов
- •Вопрос 4. Работа «Стрипп-машины».
- •Вопрос 5. Конструкции электролизных ванн
- •Вопрос 6. Системы включения электродов
Вопрос 2. Анализ системы Cu-п-о
Воспользуемся результатами термодинамического анализа системы
Cu-П-О для оценки конечной
концентрации примеси в расплаве меди
при условии ее насыщенияCu2О
(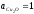 ,aCu
=1), находящегося в равновесии с чистым
оксидом примеси (
,aCu
=1), находящегося в равновесии с чистым
оксидом примеси (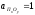 ).
В этом случае согласно равновесию
реакции 2.2 активность двухвалентной
примеси (х=у=1) составляет
).
В этом случае согласно равновесию
реакции 2.2 активность двухвалентной
примеси (х=у=1) составляет
 =
=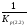 ,
(2.14)
,
(2.14)
и введя эффективное значение активности
примеси
 для ограниченной ее растворимости в
меди
для ограниченной ее растворимости в
меди
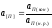 ,
(2.15)
,
(2.15)
где:
 ,
,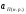 -
активность, соответствующая конечной
концентрации примеси и насыщенному
раствору в меди, получим
-
активность, соответствующая конечной
концентрации примеси и насыщенному
раствору в меди, получим
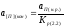 . (2.16)
. (2.16)
Для трехвалентной примеси (х=2, у=3) аналогичное уравнение имеет вид

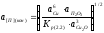 =
=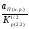 . (2.17)
. (2.17)
Из выражений 2.16, 2.17 следует, что остаточная концентрация примеси в меди зависит только от константы равновесия и предельной растворимости примеси при данной температуре. В частности конечная концентрация железа, цинка, свинца в анодной меди, рассчитанная по уравнению 2.16 при температуре 1423 К составляет (%, по массе): 9,36∙10-4; 8,3∙10-4; 8,14 соответственно. При расчете по данным Аглицкого приняты величины предельной растворимости в медиFe0,089,Pb0,15 моль и допускается полная растворимость цинка. Аналогично рассчитаны пределы рафинирования некоторых трехвалентных примесей, в частности для мышьяка и сурьмы остаточные концентрации данных компонентов составляют: 0,33; 0,13. Величины ΔGo , Кр,lgКрдля реакции 2.2 окисления различных металлов и элементов получены с использованием современного термодинамического пакета программыHSC-4 и представлены в табл.2.2.
Таблица 2.2.
|
№ |
Реакция |
ΔGo, кДж/моль |
Кр |
lgKp |
|
1 |
2As+3Cu2O=As2O3+6Cu |
-136,21/-138,85/-141,50 |
(1,52 /1,25/1,04)∙105 |
5,18/5,10/5,02 |
|
2 |
2Sb+3Cu2O=Sb2O3+6Cu |
-154,64/-157,04/-159,46 |
(7,63 /5,81 /4,51)∙105 |
5,88/5,76/5,65 |
|
3 |
2Bi+3Cu2O=Bi2O3+6Cu |
-0,34/-2,70/-5,14 |
1,03/1,26/1,52 |
0,013/0,100/0,182 |
|
4 |
Co+Cu2O=CoO+2Cu |
-68,95/-69,89/-70,81 |
(4,20 /3,68 /3,24)∙102 |
2,62/2,56/2,51 |
|
5 |
Fe+Cu2O=FeO+2Cu |
-105,70/-106,87/-108,05 |
1,05 104/(8,37 /6,78) ∙103 |
4,02/3,92/3,83 |
|
6 |
Ni+Cu2O=NiO+2Cu |
-48,85/-49,09/-49,33 |
7,22/6,34/5,61 |
1,86/1,80/1,75 |
|
7 |
Pb+Cu2O= PbO+2Cu |
-19,37/-20,26/-21,17 |
5,45/5,54/5,63 |
0,737/0,744/0,751 |
|
8 |
Sn+ Cu2O=SnO+2Cu |
-77,11/-77,80/-78,52 |
(5,80 /7,18 /6,09) ∙102 |
2,93/2,85/2,78 |
|
9 |
Zn+Cu2O=ZnO+2Cu |
-139,51/-138,67/-137,81 |
(2,03 /1,23 /7,71) ∙105 |
5,31/5,09/4,89 |
Изменение свободной энергии Гиббса ΔGo , константы равновесия Кр,lgКрокисления
примесей расплава черновой меди по реакции 2.2 при температуре, К: 1373/1423/1473
Результаты выполненных расчетов
свидетельствуют о достаточной сходимости
с данными практики для железа, цинка.
В случаях рафинирования от As,Sb,Pbполучены
завышенные величины остаточной
концентрации. Причиной заметного
отклонения от реального состава анодной
меди являются следующие обстоятельства.
Во первых, при огневом рафинировании
окисление меди осуществляют до
концентраций кислорода существенно
меньших пределов его насыщения, поэтому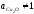 .
Во вторых, расплав меди покрыт шлаком,
в котором активная концентрация примесей
намного ниже активности чистого
компонента. Кроме того, растворы примесей
в металле не являются идеальными.
.
Во вторых, расплав меди покрыт шлаком,
в котором активная концентрация примесей
намного ниже активности чистого
компонента. Кроме того, растворы примесей
в металле не являются идеальными.
Рассчитаем остаточную концентрацию примесей с учетом их окисления, растворенным в объеме расплава меди кислородом по брутто-реакции
П+у/х[О]= 1/х ПхОу. (2.18)
Запишем
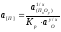 , (2.19)
, (2.19)
где:
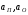 -активности
примеси и кислорода, равные соответственно
-активности
примеси и кислорода, равные соответственно и
и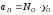 ;
;
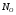 -
мольные доли кислорода и примесей в
меди;
-
мольные доли кислорода и примесей в
меди;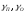 -коэффициент
активности примеси и кислорода.
-коэффициент
активности примеси и кислорода.
Тогда, конечная концентрация, выраженная в мольных долях, составит
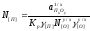 . (2.20)
. (2.20)
Предположим, что суммарное содержание кислорода и мышьяка в расплаве меди составляет 1 % , тогда коэффициент активности компонентов в таком разбавленном растворе равны единице и остаточное содержание П может быть рассчитано по уравнению
 ,
(2.21)
,
(2.21)
где:
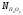 -мольная
доля оксида примеси определенная из
условия образования идеального шлака
состава, % (по массе): 29SiO2;
70Cu2O;
1ПхОу.
-мольная
доля оксида примеси определенная из
условия образования идеального шлака
состава, % (по массе): 29SiO2;
70Cu2O;
1ПхОу.
|
№ |
Реакция |
ΔGo, кДж/моль |
Кр |
lgKp |
|
1 |
As+1,5[O]=0.5As2O3 |
-170,93/-165,55/-160,20 |
(11,70/7,54/4,87)∙105 |
6,07/5,88/5,69 |
|
2 |
Sb+1,5[O]=0.5Sb2O3 |
-180,14/-174,64/-169,17 |
(24,86/15,85 /10,14)∙105 |
6,40/6,20/6,01 |
|
3 |
Bi+1,5[O]=0.5Bi2O3 |
-102,99/-97,47/-92,02 |
(4,53/2,88/1,85)∙103 |
3,66/3,46/3,27 |
|
4 |
Co+[O]=CoO |
-130,44/-133,97/-137,50 |
(4,22 /8,27 /17,02)∙104 |
4,63/4,92/5,23 |
|
5 |
Fe+[O]=FeO |
-174,24/-170,95/-167,68 |
(4,25/1,88)∙106/8,83∙105 |
6,63/6,27/5,95 |
|
6 |
Ni+[O]=NiO |
-117,40/-113,18/-108,96 |
(2,93/1,43)∙104/7,31∙103 |
4,47/4,15/3,86 |
|
7 |
Pb+[O]= PbO |
-87,91/-84,34/-80,81 |
(2,21/1,25)∙103/7,33∙102 |
3,34/3,09/2,86 |
|
8 |
Sn+ [O]=SnO |
-145,65/-141,89/-138,16 |
(3,48/1,62)∙105/7,93∙104 |
5,54/5,21/4,90 |
В таблице 2.3 показаны значения величин изменения свободной энергии Гиббса, константы равновесия и ее логарифма для реакций окисления примесей кислородом по реакции 2.18 при различных температурах.
Таблица 2.3.
Изменение свободной энергии Гиббса ΔGo , константы равновесия Кр,lgКрокисления
примесей расплава черновой меди по реакции 2.19 при температуре, К: 1373/1423/1473
После подстановки численных значений
для AsвеличинN[O]=0.0158
мол. (0,4 %, по массе) и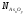 =0,0055
мол. (1 %,по массе),Кр=7,54∙105,
1423 К (табл.2.3) и соответственно для свинца
=0,0055
мол. (1 %,по массе),Кр=7,54∙105,
1423 К (табл.2.3) и соответственно для свинца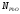 =0,0048
мол. иКр=1,25∙103, получим:
=0,0048
мол. иКр=1,25∙103, получим:
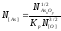 =
=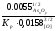 =
=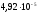 мол, или 5,76 ∙10-3%, по массе;
мол, или 5,76 ∙10-3%, по массе;

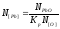 =
=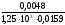 =
=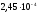 мол,
или 0,079 %, по массе.
мол,
или 0,079 %, по массе.
В случае образования реальных растворов,
например, содержащих 0,7 % [O]
и 0,5 %Pbпроведем аналогичные
расчеты с использованием мольных
параметров взаимодействия. Величины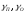 определяем по уравнениям
определяем по уравнениям
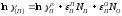 (2.22)
(2.22)
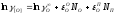 , (2.23)
, (2.23)
где:
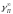
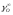 -коэффициенты
активности примеси и кислорода в
бесконечно разбавленном растворе жидкой
меди;
-коэффициенты
активности примеси и кислорода в
бесконечно разбавленном растворе жидкой
меди; ,
, параметры взаимодействия одноименных
и разноименных частиц.
параметры взаимодействия одноименных
и разноименных частиц.
Определим конечную концентрацию,
например, мышьяка и свинца в меди при
1423 К, характерной для окислительной
стадии рафинирования. Максимальная
растворимость кислорода, рассчитанная
по уравнению 2,12 составляет 0,8 %. Допускаем,
что за счет непрерывного ввода дутья
поддерживается постоянная концентрация
кислорода в объеме меди 0,7 % (по массе)
и расплав находится в равновесии с
идеальным шлаком ( =
=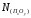 )
состава, % (по массе): 80Cu2O;
19SiO2; ≤1 ПхОу.
Принимаем максимальные исходные
содержания (%, по массе)As(0,4),Pb(0,5). При этих
концентрациях примеси незначительно
влияют на физико-химические свойства
расплава, растворимы в жидкой меди и не
образуют химических соединений и
эвтектик. Вместе с тем, они в состоянии
изменять величину активности
растворенного кислорода, что учитывается
соответствующими параметрами
взаимодействия. Параметром взаимодействия
одноименных примесей
)
состава, % (по массе): 80Cu2O;
19SiO2; ≤1 ПхОу.
Принимаем максимальные исходные
содержания (%, по массе)As(0,4),Pb(0,5). При этих
концентрациях примеси незначительно
влияют на физико-химические свойства
расплава, растворимы в жидкой меди и не
образуют химических соединений и
эвтектик. Вместе с тем, они в состоянии
изменять величину активности
растворенного кислорода, что учитывается
соответствующими параметрами
взаимодействия. Параметром взаимодействия
одноименных примесей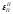 пренебрегаем.
пренебрегаем.
Выполняем расчеты в следующей последовательности. Первоначально из данных табл. 2.1. и 2.3 выбираем следующие термодинамические характеристики (1423 К):
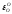 =-7,7;
=-7,7;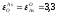 ;
;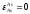 ;
; (по
уравнению 2.13);Кр=7,54∙105;
(по
уравнению 2.13);Кр=7,54∙105;
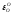 =-7,7;
=-7,7;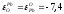 ;
; ;
;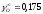 (по
уравнению 2.13);Кр=733;
(по
уравнению 2.13);Кр=733;
Выразим состав расплава меди и шлака в мольных долях.
Медный расплав
CuAs[O]CuPb[O]
% ( по массе)…… 98,9 0,4 0,7 98,8 0,5 0,7
А( %/Мв)………..1,5453 0,0053 0,0438 1,5438 0,0024 0,0438
Мв………………..64 75 16 64 207 16
Ni …………………………..0,9692 0,0033 0,0274 0,9710 0,0015 0,0275
Идеальный шлаковый раствор
Cu2OSiO2As2O3Cu2OSiO2PbO
% ( по массе)…... 70,9350 29,0 0,0650 70,0 29,0 1,0
А( %/Мв)………..0,4433 0,4833 0,0003 0,4375 0,4833 0,0045
Мв………………..140 60 198 140 60 223
Ni …………………………..0,4783 0,5214 0,0004 0,4728 0,5224 0,0048
Рассчитаем коэффициенты активности компонентов.
Кислород: Мышьяк:
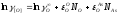
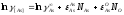


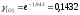

Кислород: Свинец:
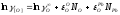
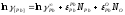
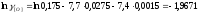
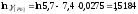
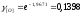
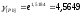
Подставляя полученные величины в уравнение 2.20, получим:
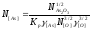 =
= =0,001542,
=0,001542,
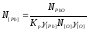 =
= =0,000374.
=0,000374.
После пересчета размерности концентраций, выраженных в мольных долях на % (по массе), окончательно имеем [As]кон= 0,18 % и [Pb]кон=0,12 %, что по порядку величин в большей степени соответствует практическим данным. Предлагаем читателям самостоятельно выполнить аналогичные расчеты применительно к остальным компонентам черновой меди.
Таким образом, остаточная концентрация
примеси в меди снижается с увеличением
ее сродства к кислороду, т.е. ростом Крреакции 2.18, уменьшением активности ее
оксида в шлаке (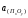 ),
повышением активности кислорода (
),
повышением активности кислорода ( )
и коэффициента активности примесей (
)
и коэффициента активности примесей (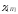 )
в меди. В общем случае предельное
содержание удаляемых металлов и элементов
определяется технологическими условиями
огневого рафинирования, среди которых
наибольшее значение приобретают
температура, степень окисленности
расплава и состав шлака.
)
в меди. В общем случае предельное
содержание удаляемых металлов и элементов
определяется технологическими условиями
огневого рафинирования, среди которых
наибольшее значение приобретают
температура, степень окисленности
расплава и состав шлака.
Вопрос 3. Система Cu2O-SiO2 .Основой медерафинировочного шлака является системаCu2O-SiO2, в которой обнаружены следующие соединенияcтемпературой плавления, К:Cu2O∙SiO2(1393); 2Cu2O∙SiO2(1343); 3Cu2O∙SiO2(1363); 5Cu2O∙SiO2 (1383). При содержании 8 %SiO2(по массе) в системеCu2O-SiO2 имеется эвтектика (рис. 2.1.) с температурой плавления 1333 К. Наличие оксидов железа, свинца, СаО+MgO(<6 %) расширяет область гомогенности, и такой шлак сравнительно легко плавится до концентрацииSiO240 %. По мере растворения в расплаве других компонентов (NiO,SnO,ZnO), происходит разрыв смесимости и появляется твердая фаза (гетерогенизация расплава). В этом случае образуется «свернутый» шлак, представляющий собой полурасплавленную массу смеси оксидов, которую удаляют из печи в виде съемов.
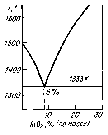
Рис. 2.1. Диаграмма состояния Cu2O-SiO2
В соответствии с современными положениями
теории о строении шлаковых расплавов,
его составляющие находятся в состоянии
электролитической диссоциации,
продуктами которой могут являться
катионы металлов (Pb2+,
Ni2+,Сu+,Са2+),
анионы неметаллов (О2-) и
комплексные анионы (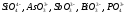 ).
Для гомогенной системыCu2O-SiO2( <30 %SiO2) уравнения
для констант равновесия реакций
взаимодействия компонентов металла
([Me],[O]) и
шлака (О2-)
).
Для гомогенной системыCu2O-SiO2( <30 %SiO2) уравнения
для констант равновесия реакций
взаимодействия компонентов металла
([Me],[O]) и
шлака (О2-)
[Me]+[O]=(Me2+)+(O2-) (2.24)
[Me]+3/2[O]+3/2(О2-)=(MeО3)3- (2.25)
можно записать следующим образом:
- для элементов, оксиды которых диссоциируют на катион Меn+и анионО2-(1-ая группа примесей)
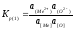 (2.26)
(2.26)
-для элементов, образующих комплексные анионы (2-ая группа примесей)
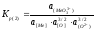 . (2.27)
. (2.27)
Обозначим за L Meкоэффициент распределения примесей между шлаком и металлом, равный отношению их активностей (концентраций) в шлаке и металле, т.е.
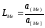 . (2.26)
. (2.26)
Тогда, коэффициент распределения может быть рассчитан по уравнениям:
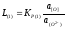 (2.27)
(2.27)
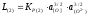 . (2.28)
. (2.28)
Из выражений 2.27, 2.28 следует, что переводу примесей в шлак способствуют более высокое сродство примеси к кислороду, повышение окисленности меди и снижение в металле активности (концентрации) свободных ионов кислорода для элементов 1-ой группы. Последнее достигается добавкой в шлак оксидов, имеющих высокие комплексообразующие свойства (SiO2,P2O5,B2O3,Fe2O3) за счет ковалентной связи кислорода с катионами металлов. Для примесей 2-ой группы (As,Sb,Bi) более эффективно использование флюсов на основе оксидов щелочных и щелочноземельных с ионным характером связи между кислородом и катионами (Li2O,K2O,Na2O,MgO,CaO,Ba2O). По этой причине степень удаления примесей в процессе огневого рафинирования зависит от характера футеровки печи, составляющие которой, принимают участие в процессах шлакообразования. В этой связи известно, что с использованием кислых огнеупоров (динас) происходит более полный перевод в шлак свинца, никеля и кобальта, а основных (магнезит) мышьяка и сурьмы. При отсутствии шлакового расплава активность оксида примеси близка к единице (чистый оксид) и согласно уравнения 2.20, степень рафинирования становится невысокой.
В практике рафинирования удаление меди от железа, цинка, олова и фосфора осуществляют без наведения специальных шлаков, т.к. оксиды данных примесей образуются непосредственно в расплаве меди. По этой причине возможно также достаточно полное рафинирование меди от никеля, кобальта и свинца.
Наибольшие трудности при огневом рафинировании возникают при удалении висмута, мышьяка, сурьмы, где коэффициент распределения составляет относительно низкую величину в частности, для висмута 1.4, мышьяка 4.1, сурьмы 7.5 и не зависит от концентрации примеси в расплаве меди (рис.2.2). Аналогично поведение теллураселена, где величины LMe приобретают значения 3.9, 5.5, соответственно. Данное обстоятельство свидетельствует о протекании реакций рафинирования преимущественно с участием шлака по реакции 2.25 и объясняется тем, чтоBi,As,Sb,Te,Seв разных фазах имеют одинаковое структурное состояние: молекулярное или ионное.

[Me], % (по массе)
Рис.2.2. Зависимость коэффициента распределения LMe
Sn,Pb,Sb,As,Ni,Biмежду металлом и шлаком при 1523 К
от концентрации в меди
Увеличение значений LМеможно достигнуть, нарушив ближний
порядок в расположении атомов
воздействием на их структуру сильным
энергетическим полем катионов-модификаторов
щелочных и щелочноземельных металлов.
При этом, большаячасть
жестких ковалентных связей Ме-О
в шлаке заменяется ионнымиМеп+-О,
что снижает активность оксидов-примесей
в шлаковой фазе. Этот принцип в определенной
степени реализован при удалении
мышьяка и сурьмы, когда ошлакование
Аs2O5иSb2O5осуществляется в форме нерастворимых
в меди арсенатов и антимонатов. АктивностьSb2O5
в шлаке системы
Na2O-Sb2O5
при мольной доле
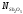 =0.7
и температуре
1523 К, снижается до 1.42∙10-6,
а стандартная свободная энергия
образованияNa3AsO4иNa3SbO4по реакциям
=0.7
и температуре
1523 К, снижается до 1.42∙10-6,
а стандартная свободная энергия
образованияNa3AsO4иNa3SbO4по реакциям
3(Na2O) + (As2O5) = 2(Na3AsO4) (2.29)
3(Na2O) + (Sb2O5) = 2(Na3SbO4) (2.30)
составляет 504,8 кДж/моль As2O5и 466, 8 кДж/мольSb2O5.
Поэтому для более глубокого удаления мышьяка, сурьмы, висмута необходимо дополнительно вводить щелочные флюсы, что снижает активность оксидов примесей. Такой технологический прием относится к методу реагентного рафинирования и основан на переводе (ПхОу) в устойчивые соединения шлаковой фазы (ПхО∙RО) за счет их взаимодействия с реагентами (RО)по реакции:
(RО) + (ПхОу) = (ПхОу ∙RО) (2.31)
В этом случае активность ПхОу зависит от изменения свободной энергии Гиббса образования и активностиПхОу∙RО, активностиRO согласно уравнения
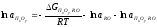 , (2.32)
, (2.32)
и чем прочнее
(ПхОу∙RО),
выше активность реагента
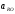 ,тем меньше величина
,тем меньше величина
 .
.
Активность ПхОув шлаковой фазе можно уменьшить, связывая основные оксиды примесей (РbО, NiO, СоО, РЬО,ZnО), добавкамиSiO2иFe2O3в силикаты или ферриты. При образовании кислых оксидов (SnО2, Аs2O3, Sb2O3, Вi2O3, Р2O5) эффективность рафинирования повышается добавкой оксидов щелочных и щелочноземельных металлов.Применение в качестве рафинирующих флюсовNa2СО3, СаО обеспечивает перевод Аs2O5 в устойчивые формыСа3(АsO4), Na3(АsO4) и снижает концентрацию мышьяка в анодной меди <0.08%.
Вопрос 4. Распределение примесей. Коэффициенты распределения селена и теллура в рассматриваемом интервале концентраций рис. 2.2. (кривые не приводятся) также постоянны. Селен и теллур при обычном окислении меди на стадии огневого рафинирования не выводятся итолько при электролизе они переходят в шлам. Изменение структуры шлакового расплава может быть достигнуто добавкойNа2СO3, что приводит к образованию теллуридов (селенидов) натрия
[Те(Sе)] + (Na2O) =Nа2Те (Na2Sе) +1/2O2(2.33)
При создании восстановительных условий, применения шлаков, содержащих карбонат натрия, можно повысить коэффициент распределения селена и теллура до 1000.
Коэффициент распределения свинца и олова зависит от исходной концентрации (активности) этих металлов в медном расплаве. В большей мере эта закономерность проявляется для системы Сu-Sn-О, когда величинаLSnв узком интервале начальных концентрацийSnвозрастает практически в несколько раз (рис.2.2). Такой эффект объясняется образованием твердой суспензииSnO2 и достижением условий тройного равновесия фаз жидкой меди, расплава оксидов и твердойSnO2.
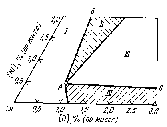
Рис.2.3. Разрез при 1423 К медного угла диаграммы Cu-Ni-O
Коэффициент распределения никеля остается постоянным (LNi~3.1) до содержания его в металле ~0.9% (по массе). Данному значению соответствует предельная растворимость NiO в Си2O (1523 К), при достижении которой выделяется твердая закись никеля в форме самостоятельной фазы. Равновесная концентрация никеля в меди, соответствующая трехфазной области (NiOт+ Сu2От+ Сuж) согласно диаграмме состояния Cu-Ni-O (рис.2.3.) составляет 0.5% (1423 К). При уменьшении температуры до 1373 К растворимость никеля в меди снижается до предельного значения 0.4%, (по массе), когда сохраняется возможность выделения закиси никеля из медного расплава.ээээээРассмотрим потенциальные возможности термодинамики для удаления никеля на основе анализа медного угла диаграммы Сu-Ni-Oпри 1423 К (рис.2.3). В поле диаграммы отмечены четыре области составов, различающихся поведением оксидов никеля и меди. В области Ι, характерной для низкой окисленности расплава независимо от концентрации никеля фазыCu2OиNiOотсутствуют. Удаление никеля здесь происходит в результате протекания реакции 2.24 на границе раздела меди и шлака. Коэффициент распределения никеля между металлом и шлаком в этой области постоянный и равен 3-5. На этом участке целесообразно введение в шлак флюсующих добавок, что несколько увеличивает коэффициент распределения никеля. Известно, что использование с этой целью оксида железаIIIповышаетLNi до 6-8 за счет протекания реакции
Ni+ [O]+Fе2О3= (NiО∙Fе2O3)(2.34)
образуется нерастворимый в расплаве меди феррит никеля и снижается активность NiOв шлаке. Диоксид кремния увеличиваетLNiтолько при температурах выше 1473 К, т.к. при более низкихSiO2выделяется из шлака в виде самостоятельной фазы, что увеличивает вязкость шлака и затрудняет протекание реакции между компонентами шлака и металла. Наиболее эффективной для рафинирования меди от никеля является область диаграммы ΙΙ. В этом случае образуется шлак с повышенным содержаниемNiO, поскольку при достижении некоторого предела насыщения расплава меди кислородом в объеме металла появляется фазаNiOт, который всплывает на поверхность ванны и ассимилируется шлаком. Вместе с тем концентрации кислорода в меди выше 0.9% является нецелесообразной, т. к. сопровождается дополнительным переводом меди в шлак без изменения состава металлической фазы.
В области ΙΙΙ диаграммы, соответствующей большее высокой концентрации кислорода из расплава меди наряду с оксидом никеля, выделяется CuO, что увеличивает выход шлака и снижает коэффициент распределения никеля. При низких концентрациях никеля в меди (областьIV) его удаление возможно в результате взаимодействия на границе раздела металл-шлак с коэффициентом распределенияLNi < 5.
Нижнему пределу содержания никеля, при котором из расплава меди выделяется NiOт, соответствует излом на кривой распределения (рис.2.2). С повышением температуры линияАВ (минимальной эффективной окисленности расплава) смещается вправо, а граница наиболее низкой концентрации никеляАС вверх. Таким образом, снижение температуры является эффективным технологическим приемом для удаления никеля из расплава при минимальной окисленности меди. В зависимости от температуры минимальная концентрация никеля, при которой из расплава меди выделяетсяNiO, составляет, % (по массе): 0,4-0,5(1423 К); 0,6-0,7 (1473 К); 0,9-1,0 (1523 К).
Практически концентрация никеля в анодной меди составляет 0.35-0.45, а в отдельных случаях повышается до 0.8-0.9%, что объясняется также, сравнительно небольшим различием меди и никеля в сродстве к кислороду. Кроме того в присутствии мышьяка и сурьмы, возможно образование растворимых в меди арсенатов, антимонатов меди и никеля в частности, прочного халькофиллита (слюдки)ЗСи2О∙4NiO∙Sb2O5 (Тпл=1653 К). Снижение активности закиси никеля в шлаке за счет введения специальных флюсов предотвращает образование антимоната и повышает коэффициент распределения никеля.
В общем случае, образование оксидов примесей в расплаве меди, или гетерогенизация шлака приводят к возрастанию коэффициента распределения практически всех удаляемых металлов и элементов.
