
- •Раздел 1. Введение. Лекция 1. Требования, предъявляемые к современным металлургическим процессам.
- •Вопрос 1. Комплекснгость использования сырья (кис)
- •Вопрос 2. Экологическая безопасность технологий.
- •Вопрос 3. Удельная производительность оборудования
- •Вопрос 1. Способы получения порошков.
- •Вопрос 2. Механическое изельчение
- •Вопрос 3. Распыление расплава
- •Вопрос 1. Твердофазное восстановление
- •Вопрос 2. Электролиз.
- •Вопрос 3. Цементация
- •Вопрос 4. Карбонильный метод
- •Вопрос 5. Термолиз
- •Вопрос 6. Автоклавный способ
- •Вопрос 7. Специальные способы
- •Вопрос 1. Химические свойства
- •Вопрос 2. Физические свойства
- •Вопрос 3. Технологические свойства
- •Вопрос 4. Производство изделий из порошков
- •Раздел 3. Автогенные процессы в металлургии меди. Лекция 5. Некоторые теоретические аспекты автогенных процессов
- •Вопрос 1. . Физико-химические принципы автогенности, методы достижения.
- •Вопрос 2.Особенногсти тепловых балансов.
- •Вопрос 3. Влияние различных факторов на тб ап в общем случае автогенный режим автогенных процессов зависит от следующих факторов:
- •Вопрос 4. Оксисульфидные системы.
- •Лекция 3. Практика автогенных процессов (ап)
- •Вопрос 1. Классификация ап и преимущества ап
- •Совмещенная плавка-конвертирование (спк)
- •Технологические преимущества автогенных процессов.
- •Вопрос 2. Кислородно-факельная плавка, аппаратурное оформление
- •Технологическая схема приведена на рис. 1. Вопрос 2. Особенности ф-х процессов технологии
- •Вопрос 3. Технологическая схема производства с использованием кфп следующая
- •Вопрос 3. Т-э показатели процессса, преимущества, недостатки, перспективы.
- •Недостатки:
- •Лекция 7. Плавка во взвешенном состоянии.
- •Вопрос 2. Практика процесса.
- •Недостатки ап первой группы (классификация):
- •Лекция 8. Плавка в печах Ванюкова.
- •Вопрос 2. Конструкция печи. Печь представляет собой шахту, кессонированную в средней части и футерованную ниже оси фурм.
- •Вопрос 7. Показатели и перспективы процесса пв:
- •Вопрос 1. Спк на уральских предприятиях(оао «ммск»)
- •Вопрос 2. Практика спк на оао «Святогор». Технологическая схема спк на оао «Святогор» включает (рис.2.) плавку концент-
- •Вопрос 3. Технология «Эльтениенте» (Чили).
- •Вопрос 2. Технология «Мицубиси»
- •Вопрос 3. Практика работы завода «Гресик» Индонезия
- •Лекция 11. Ап с погружной фурмой. Аусмелт
- •Вопрос 1. Классификация процессов.
- •Особенность фурмы аусмелт
- •Вертикальная фурма многоцелевого назначения.
- •Вопрос 2. Оосбенности технологии « кивцэт»
- •Вопрос 3. Схема кифцэт:
- •Показатели
- •Вопрос 3. Факельно-барботажная плавка фбп.
- •Технико-экономические показатели факельно-барбатажной плавки:
- •Раздел 4. Современное состояние и пути модернизации существующих процессов.
- •Вопрос 2. Характеристика шахтной плавки.
- •Вопрос 1. Характеристика современного состояния
- •Вопрос 2. Пути совершенствования оп и ее перспективы
- •Лекция 14. Современное состояние процесса конвертирования медных штейнов и перспективы развития производства.
- •Вопрос 1. Теория конвертирования
- •Вопрос 1. Распределение основных спутников меди
- •Лекция 16 Современная практика конвертирования и направление совершенствования процесса.
- •Вопрос 1. Характеристика конвертеров и технологии
- •Вопрос 2. Прогресс в области конвертирования:
- •Вопрос 3. Повышение качества флюса.
- •Часть 5.Современное состояние и перспективы технологии рафинирования черновой меди.
- •Вопрос 1. Термодинамика реакций окисления меди и примесей
- •Вопрос 2. Анализ системы Cu-п-о
- •Вопрос 5. Термодинамика дегазации и раскисления
- •Вопрос 1. Типы печей.
- •Стационарная отражательная печь
- •Технические характеристики пламенных печей
- •Наклоняющиеся печи, по сравнению с отражательными печами, имеют преимущества:
- •Вопрос 2. Характеристика печи «Мерц»
- •Вопрос 3. Оборудование для разливки анодов
- •Вопрос 4. Разливочная машина.
- •Технические характеристики
- •Лекция 20. Технология рафинирования. Режимные параметры операций
- •Вопрос 1. Основные операции рафинрвания
- •Вопрос 3. Виды восстановителя
- •Вопрос 4.Особенности восстановления в печи Мерц
- •Вопрос 5. Реагентное рафинирование.
- •Вопрос 2. Поведение примесей на аноде и катоде
- •Вопрос 4. Образование медеэлектролитного шлама
- •Вопрос 5. Пассивация анода
- •Вопрос 6. Структура катодных осадков
- •Вопрос 7. Добавки в электролит
- •Вопрос 8. Влияние температуры электролита
- •Вопрос 3. Принцип работы автоматической линии для сборки и расстановки стартерных катодов
- •Вопрос 4. Работа «Стрипп-машины».
- •Вопрос 5. Конструкции электролизных ванн
- •Вопрос 6. Системы включения электродов
Вопрос 5. Реагентное рафинирование.
Для удаления As,Sb… Надо вводить щелочные флюсы.
Такой технологический прием относится к методу реагентного рафинирования. И основан на переводе применсых оксидов (Пх Oy)(Пх Оу-1RO)RO– Флюс или реагент. Взаимодействие идет по реакцииRO+ Пх Оу= ПхОу*RO. См.валентность флюса.
Чем прочнее соединение ПхОу RO, тем выше активность реагента и тем менее вероятна обратная реакция.
Чем прочнее соединение помесных оксидов, тем больше вероятность протекания реакции в прямом направлении. От сюда следует, что: необходимо подбирать восстановитель с высокой «активностью» участвующих в процессе восстановительных реагентов.
Основная реакция Cu2O+ вСuметалл примесей +2Сu.
активность раскислителей. В этой реакции восстановителями, как правило, участвуют водород, СО, СН4(метан). Полнота протекания реакции 1 зависит от избытка восстановителя в газе, от сюда следует технологический вывод: необходимо реализовать кинетические возможности протекания реакции восстановления. Например Cu2O+CH42Cu+CO2+H2O. Степень протекания этой реакции зависит о т гидро-газодинамических условий ввода дутья в расплав меди. Эти факторы оцениваются критерием Архимеда Ар=f(расхода газа, от скорости истечения газа восстановителя из сопел, от плотности жидкости (расплава меди), плотности газовой фазы реагентов) делить наg9,8. Важное значение имеют также и физико-химические свойства расплавленной меди: плотность, коэффициент динамической вязкости. Проблемным вопросом в использовании природного газа или продуктов его конверсии (водород иCO) являются низкая степень поглощения восстановителей расплавом меди. Низкая степень использования восстановителейVпри продувке расплава при существующих приемах его ввода в расплав являются:
Низкая степень усвоения углеводородов жидкой меди
Высокие энергетические затраты на «распад» относительно прочной молекулы метанаСН4.
С технологической точки зрения это обуславливало решение следующих проблем:
Оптимизация гидро- газо- аэро- динамических условий в объем жидкой меди.
Активизация распада молекулы метана
На заводе Дуглас США применяют крекинг, крекинговую установку, для предварительного получения высокоактивных продуктов сгорания (водород, СО) и при этом применяется катализатор Al2O3. Усилиями сотрудников кафедры мтцм удалось установить, что в продуктах сгорания топлива при<1 наиболее эффективный восстановитель – водород, а не СО или метан. Это связано с кинетикой процесса. Водород при первой стадии адсорбируется на 2 атома, в условиях высокой температуры меди >1200 градусов, водород присутствует в форме протонов, учитывая его маленькие размеры порядка 10-8мкМ. В условиях ограничения диффузии, последний наиболее полно растворяется в объем металлической меди, что обеспечивает перемещение фронта реакции с поверхности раздела фаз в объем жидкой меди. СО- менее активный восстановитель. Поэтому в технологических расчетах его влияние можно не учитывать. На заводах Японии и Чехии применяют аммиак, а восстановитель все тот же водород.
Лекция 21. Непрерывные процессы
Вопрос 1. Печь Мицубиси. Периодический процесс огневого рафинирования меди характеризуется сравнительно низкой производительностью и высоким расходом топливно-энергетических ресурсов. Использование в цветной металлургии непрерывных автогенных процессов плавки сульфидного сырья, включая конвертирование штейна во взвешенном состоянии, послужили основанием для разработки аналогичных высокопроизводительных технологий рафинирования меди.
Презентация
Создание принципиально новых способов огневого рафинирования меди развивается по двум направлениям. Это совмещение всех операций в одном агрегате или их осуществление в отдельных печах. Вариантами совмещенного метода непрерывного рафинирования вошедшие в практику работы некоторых зарубежных заводов являются процессы «Мицубиси» (Япония), «Гумбольд» (Германия») и «Контимелт» (совместная разработка фирм Германии и Бельгии).
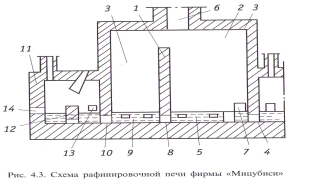
Процесс «Мицубиси».Особенностью данного способа является то, что агрегат рафинирования установлен в конце непрерывной технологической линии аппаратов автогенной плавки сульфидного сырья на черновую медь. Печь разделена перегородкой 1 на зоны окисления 2 и восстановления 3 (рис. 4.3.). Расплав меди по перетоку 4 непрерывно поступает из печи конвертирования в зону окисления рафинировочной камеры, где его с помощью фурм 5 продувают воздухом, обогащенным кислородом, или технологическим кислородом в смеси с топливом для обогрева. Отходящие газы поступают в газоход 6 , а шлаки удаляют через окно 7. Окисленная медь перетекает под перегородкой 8 в зону восстановления, где ее продувают с помощью боковых фурм 9 топливно-воздушной смесью с целью.

Презентация
восстановления и дразнения. Сжигание топлива позволяет j одновременно поддерживать в печи необходимую температуру и восстановительную атмосферу. Расплав меди после окисления через переток 10 поступает в разделительную камеру 11, снабженную перегородкой 12, где из окна 13 удаляют остатки шлака. Рафинированную медь через окно 14 выпускают в приемный ковш разливочной машины.
Новый комплекс «Мицубиси» производительностью 240 тыс. т меди в год работает на заводе «Наосима» (Япония) с 1991 г.
Процесс «Гумбольд».Все технологические операции данного процесса осуществляются в печи типа отражательной (рис. 4.4), разделенной перегородками на три зоны: плавильную 1, окислительную 2, восстановительную 3.
Агрегат оборудован котлом-утилизатором, системой пылеулавливания, имеется кислородная станция. В печи установлено 6 фурм для окисления и 22 - с целью восстановления меди. Длина полупромышленного агрегата 6 м, ширина 3 м, высота над поверхностью ванны составляет 1 м, глубина 0.25 м.
Расплав перетекает навстречу газовой фазе, проходя последовательно все три зоны. Использование способа верхней продувки расплава газами существенно интенсифицирует процессы тепломассопередачи на разных стадиях рафинирования. Этому в значительной степени способствует применение вертикальных фурм с соплами Лаваля, позволяющими подавать газ на поверхность ванны с давлением 16-105Па.
В зоне 1 плавят черновую медь (80% массы шихты), и анодный скрап (20%), твердые слитки металла загружают через отверстие в боковой стене печи, а расплав заливают через отверстие в торцевой ее части. Далее жидкая медь переливается через порог и поступает в зону окисления 2, где ее продувают кислородом со сверхзвуковой скоростью. Окисленный расплав (1.5% О2) через отверстие в перегородке перетекает в зону восстановления, где его обрабатывают пропаном или природным газом с помощью вертикальных фурм. Восстановленную медь удаляют из зоны носстановления под перегородкой в торце печи, а шлак - из зоны окисления через окно в боковой стене.
Процесс сгорания топлива организован таким образом, чтобы углеводороды восстановительной зоны (α=0.5-0.95) догорали на всех остальных участках печи, куда дополнительно вводится избыточное количество воздуха или кислорода. Агрегат «Humbold» может работать в непрерывном и периодическом режимах.
Скорость рафинирования в непрерывном режиме практически на порядок выше, чем в периодическом, и на два порядка по сравнению с обычной отражательной печью. Показано, что за 1000с пребывания расплава в зоне окисления степень удаления примесей составляет, %: 90- 100 (Sn, Fe, Zn, S); 65 Pb и при использовании содового шлака80 As и Sb. Повышение температуры расплава до 1873 К за счет применения кислорода обеспечивает отгонку до 80% РЬ, 90% Bi, остаточное их содержание в анодах соответственно составляет 0.07 и 0.05%. Анодные шлаки содержат 15-20% Си, 8-10% Sn, 4-5% Pb, их выход несколько выше, чем при обычной технологии (5-7%) из-за более высокой окисленности меди.
Постоянное обновление наружной поверхности жидкого пограничного слоя реакционной зоны за счет динамического напора струи газов приводит к высоким скоростям массопередачи и увеличивает интенсивность окисления и удаления примесей.
Экономические расчеты и сопоставимый анализ их результатов с рафинированием в отражательных и наклоняющихся печах показал, что себестоимость анодной меди,
Презентация.
получаемой способом «Humbold», соответственно на 23.8 и 12.3% отн. ниже, чем в указанных вариантах. Следует отметить более высокие затраты на топливо, возросшие более чем на 50% [48]. Это может объясняться повышенным расходом восстановителя и неэффективными условиями плавления твердой меди в зоне 1 печи, где отсутствует организация направленного тепломассообмена. Общим недостатком технологии является переокисление меди и высокий выход шлака.
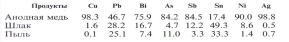
Вопрос 3. Процесс «Контимелт».Для плавки и непрерывного рафинирования черновой меди и переработки вторичного сырья разработан процесс «Contimelt» с использованием комплекса шахтной и отражательной печей (рис. 4.5).
Шихту загружают скиповым подъемником в шахту печи, высотой 10.5, диаметром верхней части 2 и нижней 2.4 м. Такое расширение предусмотрено для предотвращения забивания шахты загрузочными материалами. Верхняя часть шахты футерована силикатокарбидовым, а нижняя - глиноземистым кирпичом. Нижняя часть шахты кессонирована. Стены и под выполнены соответственно из хромомаг- незитового и магнезитового огнеупоров. Печь отапливается 16 горелками, из которых 10 установлены в стене, а 3 .*- и своде отражательной печи. Горелки копильника установлены под углом к ванне, что обеспечивает эффективные условия теплообмена между металлом и факелом.
Дымовые газы с температурой 873 К поступают в котел- утилизатор, рукавный фильтр и дымовую трубу. Транспортировка газов осуществляется двумя вентиляторами общей мощностью 90 тыс. м3/ч. Количество уловленной пыли составляет 4 кг/т меди, остаточная концентрация пыли в газе - 50 мг/м3.
При переработке черновой меди состава, %, мае: Сu- 97.5; Рb—0.15; Bi-0.058; As-0.093; Sb-0.078; Sn-0.158; Ni- 0.253; Ag-0.074 с α=1.0 получено следующее распределение компонентов, % по продуктам рафинирования.
Увеличение коэффициента избытка воздуха до α=1.3 повышает извлечение в шлак Pb, Sn, Ni, Sb до 59.3, 85.6, 42.9 и 71.6% соответственно. Получен анодный шлак состава: Cu-40.1, Pb-3.2, Bi-0.03; As-0.2, Sb-0.3, Ni-0.4.
Восстановление меди производят в барабанной печи природным газом с помощью 2 боковых фурм. Производительность печи составляет 20-60 т/ч, удельный расход газа - 10-13 м3/т. Содержание кислорода уменьшается с 0.4-0.8 до 0.07-0.2%.
Технические характеристики анодной печи приведены ниже.
Технические характеристики анодной печи

Процесс «Контимелт» используется в сочетании с Непрерывным способом литья анодов и позволяет увеличить производительность по сравнению с обычными стационарными печами на 30% и в 1.8-2.6 раза повысить тепловой КПД агрегата.
Наряду с рассмотренными процессами, в укрупненно- лабораторном и п/промышленном масштабе испытаны близкие к режимам непрерывной технологии процессы вакуумной дистилляции , струйного рафинирования.
Применение аналогичных процессов на отечественных предприятиях в условиях дефицита и непостоянства состава сырья, отсутствия надежной технологии непрерывного конвертирования медных штейнов представляется преждевременным. Увеличение производства анодной меди в этих условиях экономически целесообразно осуществлять на основе совершенствования существующих агрегатов периодического действия, при необходимости используя дополнительные единичные мощности.
Лекция 22. Электрохимические процессы при электролизе меди и поведение примесей
Вопрос. 1. Электродные процессы.
В основе электролитического рафинирования меди лежит процесс, при котором происходит растворение загрязненной (анодной) меди и осаждение чистой меди на катоде, а имеющиеся в анодной меди примеси распределяются между раствором и шламом. Данная электрохимическая система может быть представлена следующим образом:
+ Сuс примесями | СиSO4, Н2SO4, Н2O, ПАВ, Сu+| Сu -.
где ПАВ - поверхностно-активное вещество.
Рассмотрим сначала систему, в которую входят катод и анод из чистой меди и электролит, представляющий собой водный раствор сульфата меди и серной кислоты, гипотетически исключив вероятность образования ионов Сu+
+ Сu| СuSO4, Н2SO4, Н2O| Сu-.
Компоненты раствора дают при электролитической диссоциации следующие ионы:
СuSO4↔Сu2+ +SO42-;(5.27)
Н2O ↔Н+ + ОН- (5.28)
Н2SO4 ↔Н+ + НSO4- ↔2Н+ + SO42- (5.29)
Тогда на электродах рассматриваемой системы возможны электрохимические реакции:
на катоде: разряд ионов меди (II) с образованием металлической меди Сu2+ + 2е = Сu и разряд ионов гидроксония 2Н3O++ 2е = Н2+ 2Н2O.
-на аноде: растворение меди Сu- 2е = Сu2+, разряд ионов гидроксила 2OН + +2е = Н2O+ 1/2O2и разряд ионовSO42-.
Из всех возможных процессов желательными при электролитическом получении меди являются процессы образования металлической меди и ее растворение. Разряд ос- гальных ионов не только нарушает ход процесса, но и увеличивает расход электроэнергии на электролиз.
При условии, что плотность тока близка к нулю, когда отсутствует любой вид электрохимической поляризации (концентрационная, химическая и др.), потенциал, при котором начинается разряд какого-либо иона, зависит только от его природы и концентрации и от температуры электролита в соответствии с уравнением Нернста:
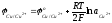 (5.30)
(5.30)
 (5.31)
(5.31)
 (5.32)
(5.32)
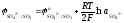 (5.33)
(5.33)
Эти уравнения позволяют определить, в каком диапазоне концентраций сульфата меди при заданной температуре можно вести процесс так, чтобы на электродах протекали только необходимые реакции. Так, совместный разряд ионов меди и гидроксония будет возможен, когда потенциалы разряда медных и водородных ионов станут равными, т.е.
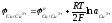 =
=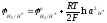 (5.34)
(5.34)
Стандартные потенциалы водорода
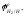 и
меди
и
меди
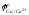 равны
соответственно 0.000 и 0.344 В. Поскольку
равны
соответственно 0.000 и 0.344 В. Поскольку
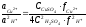 (5.35)
(5.35)
где
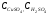 - концентрации сульфата меди и серной
кислоты;
- концентрации сульфата меди и серной
кислоты;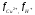 коэффициенты
активности ионов Сu2+и Н+, нижний предел концентрации
сульфата меди равен
коэффициенты
активности ионов Сu2+и Н+, нижний предел концентрации
сульфата меди равен

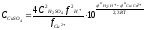 (5.36)
(5.36)
Обычно при электролитическом получении
меди концентрация
серной кислоты составляет 1...2 моль/дм3;
тогда нижний
предел концентрации сульфата меди,
согласно уравнению
(5.36) для 313 К очень мал:
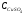 = 10-10
моль/дм3.Поэтому при плотностях тока, близких к
нулю, при любых концентрациях сульфата
меди на катоде будет протекать только
разряд ионов меди.
= 10-10
моль/дм3.Поэтому при плотностях тока, близких к
нулю, при любых концентрациях сульфата
меди на катоде будет протекать только
разряд ионов меди.
Аналогично разряд ионов ОН совместно с анодным растворением меди возможен при условиях
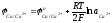 =
=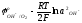 (5.37)
(5.37)
Откуда
 (5.38)
(5.38)
При 523 К
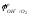 =
0,3976 В; в нейтральном растворе(
=
0,3976 В; в нейтральном растворе(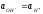 =
=
=10-7моль/дм3) активность ионов меди, при которой начнется ее совместный разряд с ионами гидроксила, равна ~1016 моль/дм3, т.е. во много раз превосходит растворимость сульфата меди в воде. Поскольку увеличение активности ионов Н+ведет к уменьшению активности ионов ОН-, в кислой среде верхний предел концентрациисульфата меди сместится в сторону еще больших значений. С другой стороны, растворимость сульфата меди в присутствии серной кислоты будет меньше, чем в воде, и тем меньше, чем больше концентрация серной кислоты.
Таким образом, при плотностях тока,
близких к нулю (обратимые условия), на
аноде из двух возможных процессов -
растворения меди и разряда ионов
гидроксила - всегда (т.е. при любых
концентрациях СuSO4)
произойдет растворение
меди. То же самое справедливо и для ионов
SO42-,
так как потенциал разряда их
значительно более положителен, чем
ионов ОН-( ~ 1-9 В).
~ 1-9 В).
Введение серной кислоты в раствор сужает (даже при обратимом процессе) пределы рабочих концентраций сульфата меди. Верхний предел понижается за счет уменьшения растворимости сульфата меди, а нижний возрастает из-за опасности разряда ионов водорода на катоде. В практике электролиза применяют значительные плотности тока, т.е. работают в условиях необратимого процесса, связанного с возникновением электродной поляризации, которая дополнительно ограничивает интервал рабочих концентраций сульфата меди. При конечных плотностях тока концентрации ионов меди у поверхности электродов будут иные, чем в объеме раствора.
Если ничто не препятствует процессам разряда ионов меди на катоде и растворению медного анода, то через определенное время, зависящее от концентрации сульфата
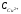
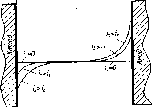
Рис. 1. Влияние плотности тока I на
изменение концентрации ионов Сu2+ в
межэлектродном пространстве
меди и силы тока, у катода концентрация меди достигнет достаточно малых значений, и на катоде станет возможен разряд ионов водорода. В этом случае у анода раствор будет перенасыщен сульфатом меди, и начнется его кристаллизация.
Однако, как только у катода снижается концентрация ионов меди, начинается их диффузия к катоду из объема электролита. Обратные явления будут наблюдаться у анода. Следует отметить, что массоперенос в растворе электролита осуществляется также миграцией (к противоположно заряженному электроду) и конвекцией (перемешиванием). Скорость диффузии не зависит от плотности тока, но при ее увеличении возрастает скорость электрохимических реакций и тем самым скорость изменения концентрации ионов Сu2+ у электродов. Поэтому в конечном счете концентрация ионов меди у поверхности катода и анода зависит как от плотности тока, так и от скорости диффузии. Чем больше плотность тока, тем значительнее будет изменяться концентрация сульфата меди у электродов (рис.1).
