
- •КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
- •По абсолютной конфигурации молекулы
- •В зависимости от положения аминогруппы
- •По оптической активности
- •По участию аминокислот в синтезе белков
- •АМИНОКИСЛОТЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •СТРОЕНИЕ И СВОЙСТВА ПЕПТИДНОЙ СВЯЗИ
- •ФУНКЦИИ БЕЛКОВ
- •УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВОЙ СТРУКТУРЫ
- •Первичная структура
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Амфотерность
- •Влияние рН на заряд белка
- •Растворимость
- •МЕТОДЫ ОСАЖДЕНИЯ БЕЛКОВ
- •Денатурация
- •Обратимое осаждение
- •Высаливание
- •Осаждение водоотнимающими средствами
- •Изменение рН
- •СВОЙСТВА БЕЛКОВЫХ РАСТВОРОВ
- •КЛАССИФИКАЦИЯ БЕЛКОВ
- •А. По функции
- •Б. По строению
- •1. По форме молекулы
- •2. По количеству белковых цепей в одной молекуле
- •3. По химическому составу
- •КЛАССИФИКАЦИЯ ПРОСТЫХ БЕЛКОВ
- •Альбумины
- •Глобулины
- •Гистоны
- •Протамины
- •Коллаген
- •Эластин
- •СТРОЕНИЕ И КЛАССИФИКАЦИЯ СЛОЖНЫХ БЕЛКОВ
- •Металлопротеины
- •Нуклеопротеины
- •Фосфопротеины
- •Липопротеины
- •Хромопротеины
- •Гемопротеины
- •Цитохромы
- •Флавопротеины
- •Гликопротеины (гликоконъюгаты)
- •Гликопротеины
- •Протеогликаны
- •Гликопротеины
- •Протеогликаны
- •ВИТАМИНЫ, ИХ КОФЕРМЕНТНЫЕ ФОРМЫ, ФУНКЦИИ
- •Общая характеристика
- •ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
- •Источники
- •Суточная потребность
- •Метаболизм
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Гипервитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Гипервитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Антивитамины
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины В1
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины В2
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •ФЕРМЕНТЫ, СВОЙСТВА, КЛАССИФИКАЦИЯ, РЕГУЛЯЦИЯ АКТИВНОСТИ
- •ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
- •МЕХАНИЗМЫ КАТАЛИЗА
- •ТИПЫ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •СХОДСТВО И ОТЛИЧИЯ ФЕРМЕНТОВ И НЕОРГАНИЧЕСКИХ КАТАЛИЗАТОРОВ
- •Сходство
- •Отличия
- •СТРОЕНИЕ ФЕРМЕНТОВ
- •Изоферменты
- •Мультиферментные комплексы
- •ПРИНЦИПЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ
- •СВОЙСТВА ФЕРМЕНТОВ
- •СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
- •Механизмы специфичности
- •ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
- •Необратимое ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •ЭНЗИМОПАТОЛОГИИ
- •Энзимодиагностика
- •Энзимотерапия
- •Использование ингибиторов ферментов
- •КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
- •НОМЕНКЛАТУРА ФЕРМЕНТОВ
- •I класс. Оксидоредуктазы
- •Пример 1
- •Пример 2
- •Пример 3
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •V класс. Изомеразы
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Пример 3
- •а. Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Пример 3
- •ОБЩИЕ ПУТИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ
- •Анаболизм
- •Катаболизм
- •I этап
- •II этап
- •III этап
- •ОСНОВНЫЕ ИСТОЧНИКИ ЭНЕРГИИ В КЛЕТКЕ
- •ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ
- •Регуляция пируватдегидрогеназного комплекса
- •ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
- •Регуляция ЦТК
- •ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
- •Краткая характеристика
- •Принцип работы дыхательной цепи
- •Ферментные комплексы дыхательной цепи
- •I комплекс, НАДН-KoQ-оксидоредуктаза
- •IV комплекс, цитохром с – кислород-оксидоредуктаза
- •V комплекс
- •Работа комплексов дыхательной цепи
- •Регуляция окислительного фосфорилирования
- •РАЗОБЩИТЕЛИ
- •ИНГИБИТОРЫ ФЕРМЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ
- •Расчет энергетической ценности коэффициента Р/О при окислении некоторых аминокислот
- •ГИПОЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ
- •ИСПОЛЬЗОВАНИЕ АТФ И ЕГО ПРЕДШЕСТВЕННИКОВ В МЕДИЦИНЕ
- •ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
- •АЗОТИСТЫЙ БАЛАНС
- •ВНЕШНИЙ ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
- •Желудок
- •Регуляция желудочного пищеварения
- •Соляная кислота
- •Пепсин
- •Гастриксин
- •Двенадцатиперстная кишка и тонкий кишечник
- •Регуляция кишечного пищеварения
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Карбоксипептидазы
- •Аминопептидазы
- •Дипептидазы
- •Толстый кишечник
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ БЕЛКА У ДЕТЕЙ
- •ТРАНСПОРТ АМИНОКИСЛОТ ЧЕРЕЗ МЕМБРАНЫ
- •НАРУШЕНИЕ ПРОЦЕССОВ ПЕРЕВАРИВАНИЯ БЕЛКОВ
- •Пищевые аллергии
- •Целиакия
- •Гниение белков в кишечнике
- •ДЕТОКСИКАЦИОННЫЕ СИСТЕМЫ ПЕЧЕНИ
- •Микросомальное окисление
- •Конъюгация
- •Образование животного индикана
- •ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ
- •Судьба аминокислот в клетке
- •Превращение аминокислот по радикалу
- •Превращение аминокислот по карбоксильной группе
- •Гистамин
- •Физиологические эффекты
- •Серотонин
- •Физиологические эффекты
- •Физиологические эффекты
- •Дофамин
- •Физиологические эффекты
- •Обезвреживание биогенных аминов
- •Превращение аминокислот с участием аминогруппы
- •Типы дезаминирования
- •Окислительное дезаминирование
- •Прямое окислительное дезаминирование
- •Непрямое окислительное дезаминирование (трансдезаминирование)
- •Механизм трансаминирования
- •Дезаминирование
- •Энзимодиагностика с помощью аминотрансфераз
- •Роль трансаминирования и трансдезаминирования
- •Обмен и роль креатина
- •ОБРАЗОВАНИЕ И УБОРКА АММИАКА
- •ОСНОВНЫЕ ИСТОЧНИКИ АММИАКА В ОРГАНИЗМЕ
- •СВЯЗЫВАНИЕ АММИАКА
- •ТРАНСПОРТ АММИАКА
- •Глюкозо-аланиновый цикл
- •УДАЛЕНИЕ АММИАКА ИЗ ОРГАНИЗМА
- •Синтез мочевины
- •Синтез аммонийных солей
- •ГИПЕРАММОНИЕМИИ
- •Наследственные формы
- •Приобретенные формы
- •ГИПОТЕЗЫ ТОКСИЧНОСТИ АММИАКА
- •ЧАСТНЫЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ И ИХ НАРУШЕНИЯ
- •ПУТИ ИСПОЛЬЗОВАНИЯ ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ КИСЛОТ
- •ПУТИ ИСПОЛЬЗОВАНИЯ ЦИСТЕИНА
- •Цистиноз
- •Цистиноз ранний нефропатический
- •Цистиноз нефропатический поздний
- •Цистиноз доброкачественный взрослых
- •Основы лечения
- •ПУТИ ИСПОЛЬЗОВАНИЯ ГЛИЦИНА И СЕРИНА
- •ВЗАИМОСВЯЗЬ ОБМЕНА ГЛИЦИНА, СЕРИНА, ЦИСТЕИНА И МЕТИОНИНА
- •Гомоцистеинемия
- •ОБМЕН ФЕНИЛАЛАНИНА И ТИРОЗИНА
- •Катаболизм фенилаланина и его нарушения
- •Фенилкетонурия I (классическая)
- •Фенилкетонурия II
- •Материнская ФКУ
- •Обмен тирозина и его нарушения
- •Тирозинемия типа I
- •Тирозинемия типа II
- •Тирозинемия новорожденных
- •Алкаптонурия
- •Альбинизм
- •Паркинсонизм
- •Лейциноз (болезнь мочи с запахом кленового сиропа)
- •Изовалератацидемия
- •ОБМЕН ТРИПТОФАНА
- •Синдром Хартнупа (триптофанурия)
- •СТРОЕНИЕ И ОБМЕН НУКЛЕОТИДОВ
- •ВНЕШНИЙ ОБМЕН НУКЛЕОПРОТЕИНОВ
- •ПУРИНОВЫЕ НУКЛЕОТИДЫ
- •Синтез пуриновых оснований и нуклеотидов
- •Регуляция синтеза пуриновых нуклеотидов
- •Внутриклеточная регуляция
- •Лекарственная регуляция
- •Распад пуриновых нуклеотидов
- •Реутилизация пуриновых оснований
- •НАРУШЕНИЕ ОБМЕНА ПУРИНОВЫХ ОСНОВАНИЙ
- •Подагра
- •Основы лечения
- •Мочекаменная болезнь
- •Основы лечения
- •Синдром Леша-Нихана
- •ПИРИМИДИНОВЫЕ НУКЛЕОТИДЫ
- •Синтез пиримидиновых оснований и нуклеотидов
- •СИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ
- •Синтез тимидилтрифосфата
- •Регуляция синтеза пиримидинов
- •Физиологическая регуляция
- •Лекарственная регуляция
- •Распад пиримидиновых оснований
- •Реутилизация пиримидиновых оснований
- •НАРУШЕНИЕ ОБМЕНА ПИРИМИДИНОВЫХ ОСНОВАНИЙ
- •Оротатацидурия
- •Наследственная форма
- •Приобретенная форма
- •НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •МАТРИЧНЫЕ БИОСИНТЕЗЫ
- •ОСНОВНОЙ ПОСТУЛАТ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
- •СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
- •Строение дезоксирибонуклеиновой кислоты
- •Строение хроматина
- •Строение рибонуклеиновых кислот
- •РЕПЛИКАЦИЯ ДНК
- •ПОВРЕЖДЕНИЯ И РЕПАРАЦИЯ ДНК
- •ТРАНСКРИПЦИЯ
- •Стадии транскрипции
- •Инициация
- •Элонгация
- •Терминация
- •Процессинг РНК
- •Процессинг предшественника мРНК
- •Процессинг предшественника рРНК
- •Процессинг предшественника тРНК
- •Регуляция транскрипции
- •Прокариоты
- •Лактозный оперон
- •Триптофановый оперон
- •Эукариоты
- •Внутриклеточная регуляция
- •Лекарственная регуляция
- •Ингибирование
- •Активация
- •ГЕНЕТИЧЕСКИЙ КОД
- •Свойства биологического кода
- •АДАПТОРНАЯ РОЛЬ ТРАНСПОРТНЫХ РНК
- •ТРАНСЛЯЦИЯ
- •Инициация
- •Элонгация
- •Терминация
- •Полирибосомы
- •Посттрансляционная модификация белков
- •Фолдинг белков
- •Лекарственная регуляция трансляции
- •ГЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ
- •СТРОЕНИЕ И ОБМЕН УГЛЕВОДОВ
- •ФУНКЦИИ УГЛЕВОДОВ
- •КЛАССИФИКАЦИЯ
- •Моносахариды
- •Производные моносахаридов
- •Дисахариды
- •Полисахариды
- •Гомополисахариды
- •Гетерополисахариды
- •ИСПОЛЬЗОВАНИЕ УГЛЕВОДОВ В БИОЛОГИИ И МЕДИЦИНЕ
- •ВНЕШНИЙ ОБМЕН УГЛЕВОДОВ
- •Ротовая полость
- •Желудок
- •Кишечник
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ УГЛЕВОДОВ У ДЕТЕЙ
- •Нарушения переваривания дисахаридов
- •Роль целлюлозы в пищеварении
- •ПЕРЕНОС ГЛЮКОЗЫ ЧЕРЕЗ МЕМБРАНЫ
- •Всасывание в кишечнике
- •Транспорт из крови через клеточные мембраны
- •РЕАКЦИИ ВЗАИМОПРЕВРАЩЕНИЯ САХАРОВ
- •Превращение галактозы
- •Нарушения превращения галактозы
- •Превращение фруктозы
- •Нарушения превращения фруктозы
- •Эссенциальная фруктозурия
- •Наследственная фруктозурия
- •СУДЬБА И ИСТОЧНИКИ ГЛЮКОЗЫ В КЛЕТКЕ
- •Фосфорилирование-дефосфорилирование глюкозы
- •МЕТАБОЛИЗМ ГЛИКОГЕНА
- •Синтез гликогена
- •Мобилизация гликогена
- •Регуляция обмена гликогена
- •Активация фосфорилазы гликогена
- •Ковалентная модификация
- •Кальций-зависимая активация
- •Аллостерическая активация
- •ГЛИКОГЕНОВЫЕ БОЛЕЗНИ
- •Гликогенозы
- •Печеночные гликогенозы
- •Мышечные гликогенозы
- •Смешанные гликогенозы
- •Агликогенозы
- •ОКИСЛЕНИЕ ГЛЮКОЗЫ
- •Гликолиз
- •Первый этап гликолиза
- •Второй этап гликолиза
- •Гликолитическая оксидоредукция
- •Энергетический эффект окисления глюкозы
- •Анаэробное окисление
- •Аэробное окисление
- •Эффект Пастера
- •Челночные системы
- •Глицеролфосфатный челночный механизм
- •Малат-аспартатный челночный механизм
- •ГЛЮКОНЕОГЕНЕЗ
- •Обход десятой реакции гликолиза
- •Обход третьей реакции гликолиза
- •Обход первой реакции гликолиза
- •Взаимосвязь гликолиза и глюконеогенеза
- •Регуляция гликолиза и глюконеогенеза
- •Регуляция глюконеогенеза
- •Регуляция гликолиза
- •СИНТЕЗ ГЛЮКОЗЫ ИЗ АМИНОКИСЛОТ
- •МЕТАБОЛИЗМ ЭТАНОЛА
- •Утилизация этанола
- •Спиртовое брожение
- •ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ОКИСЛЕНИЯ ГЛЮКОЗЫ
- •Значение пентозофосфатного пути
- •Нарушения пентозофосфатного пути
- •РЕГУЛЯЦИЯ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ В КРОВИ
- •Снижение глюкозы крови
- •Повышение глюкозы крови
- •Гипергликемические состояния
- •Сахарный диабет
- •Причины
- •Основные осложнения сахарного диабета
- •Быстрые последствия
- •Отдаленные последствия
- •СТРОЕНИЕ И ОБМЕН ЛИПИДОВ
- •КЛАССИФИКАЦИЯ
- •ФУНКЦИИ
- •СТРОЕНИЕ ЛИПИДОВ
- •Жирные кислоты
- •Роль жирных кислот
- •Типы эйкозаноидов
- •Синтез эйкозаноидов
- •Лекарственная регуляция синтеза
- •Разновидности эйкозаноидов
- •Триацилглицеролы
- •Функции триацилглицеролов
- •Прогоркание жиров
- •Фосфолипиды
- •Глицерофосфолипиды
- •Сфингофосфолипиды
- •Холестерол
- •Функции холестерола
- •Гликолипиды
- •ВНЕШНИЙ ОБМЕН ЛИПИДОВ
- •Ротовая полость
- •Желудок
- •Кишечник
- •СВОЙСТВА, СОСТАВ И ФУНКЦИИ ЖЕЛЧИ
- •Свойства и состав
- •Роль желчи
- •Образование желчных кислот
- •Кишечно-печеночная циркуляция
- •Нарушение желчеобразования
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ ЛИПИДОВ У ДЕТЕЙ
- •НАРУШЕНИЕ ПЕРЕВАРИВАНИЯ ЛИПИДОВ
- •ВСАСЫВАНИЕ ЛИПИДОВ
- •РЕСИНТЕЗ ЛИПИДОВ В СТЕНКЕ КИШЕЧНИКА
- •Ресинтез триацилглицеролов
- •Ресинтез эфиров холестерола
- •Ресинтез фосфолипидов
- •ФОРМЫ ТРАНСПОРТА ЛИПИДОВ В КРОВИ
- •ТРАНСПОРТ ТРИАЦИЛГЛИЦЕРОЛОВ В КРОВИ
- •Характеристика хиломикронов
- •Общая характеристика
- •Функция
- •Метаболизм
- •Характеристика липопротеинов очень низкой плотности
- •Общая характеристика
- •Функция
- •Метаболизм
- •ПРОМЕЖУТОЧНЫЙ ОБМЕН ЛИПИДОВ
- •Источники и судьба жирных кислот
- •Состояние покоя и отдыха в абсорбтивный период
- •Голодание, мышечная работа, состояние покоя в постабсорбтивный период
- •ИСПОЛЬЗОВАНИЕ ТРИАЦИЛГЛИЦЕРОЛОВ
- •Общая характеристика мобилизации жиров
- •Транспорт жирных кислот и глицерола
- •Окисление жирных кислот с нечетным числом углеродных атомов
- •Окисление ненасыщенных жирных кислот
- •Пример 1. Окисление пальмитиновой кислоты
- •Пример 2. Окисление линолевой кислоты
- •КЕТОНОВЫЕ ТЕЛА
- •ЗАПАСАНИЕ ЖИРОВ
- •Биосинтез жирных кислот
- •Удлинение цепи жирных кислот
- •Гормональная регуляция
- •Метаболическая регуляция
- •Общие принципы биосинтеза
- •Синтез фосфатидной кислоты
- •Синтез триацилглицеролов
- •Синтез фосфолипидов
- •Липотропные вещества
- •НАРУШЕНИЯ ОБМЕНА ТРИАЦИЛГЛИЦЕРОЛОВ
- •Жировая инфильтрация печени
- •Ожирение
- •Основы лечения
- •Сахарный диабет II типа
- •Основы лечения
- •ОБМЕН ХОЛЕСТЕРОЛА
- •Источники
- •Выведение
- •Биосинтез
- •Регуляция синтеза холестерола
- •ТРАНСПОРТ ХОЛЕСТЕРОЛА И ЕГО ЭФИРОВ
- •Характеристика липопротеинов высокой плотности
- •Общая характеристика
- •Функция
- •Обмен
- •Характеристика липопротеинов низкой плотности
- •Общая характеристика
- •Функция
- •Обмен
- •НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРОЛА
- •Атеросклероз
- •Стадии атеросклероза
- •1 стадия – повреждение эндотелия
- •2 стадия – стадия начальных изменений
- •3 стадия – стадия поздних изменений
- •4 стадия – стадия осложнений
- •Основы лечения
- •Нарушения обмена липопротеинов
- •Тип I. Гиперхиломикронемия
- •1. Подтип IIa (семейная гиперхолестеролемия)
- •Болезни накопления липидов – липидозы
- •ГОРМОНЫ
- •КЛАССИФИКАЦИЯ ГОРМОНОВ
- •Классификация по строению
- •Классификация по влиянию на обмен веществ
- •Классификация по месту синтеза
- •МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
- •Мембранные рецепторы
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •Гуанилатциклазный механизм
- •Цитозольные рецепторы
- •ИЕРАРХИЯ И ПРИНЦИПЫ РЕГУЛЯЦИИ ГОРМОНАЛЬНЫХ СИСТЕМ
- •ГОРМОНЫ ГИПОТАЛАМУСА
- •ГОРМОНЫ ГИПОФИЗА
- •Соматотропный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Семейство пептидов проопиомеланокортина
- •Липотропный гормон
- •Мишени и эффекты
- •Меланоцитстимулирующий гормон
- •Строение
- •Синтез
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ, РЕГУЛИРУЮЩИЕ ОБМЕН КАЛЬЦИЯ И ФОСФОРА
- •Кальцитриол
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Паратиреоидный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Гипофункция
- •Гиперфункция
- •Кальцитонин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ ТИРЕОИДНОЙ ФУНКЦИИ
- •Тиреотропный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Йодтиронины
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ ПЕРИФЕРИЧЕСКИХ ЖЕЛЕЗ
- •Катехоламины
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Глюкагон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Инсулин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГРУППА ГОРМОНОВ РЕПРОДУКТИВНОЙ СИСТЕМЫ
- •Окситоцин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Гонадотропные гормоны
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Половые гормоны
- •Строение
- •Синтез
- •Механизм действия
- •Женские половые гормоны
- •Регуляция синтеза и секреции
- •Гормональный цикл женщины
- •Мишени и эффекты
- •Патология
- •Мужские половые гормоны
- •Механизм действия
- •Регуляция синтеза и секреции
- •Мишени и эффекты
- •Патология
- •Производные проопиомеланокортина
- •Адренокортикотропный гормон
- •Строение
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Глюкокортикоиды
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Минералокортикоиды
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •АЗОТСОДЕРЖАЩИЕ ВЕЩЕСТВА КРОВИ
- •Составные компоненты крови
- •БЕЛКИ КРОВИ
- •Типы протеинограмм
- •Белки острой фазы
- •Функции белков плазмы крови
- •ОСОБЕННОСТИ КОЛИЧЕСТВА БЕЛКОВЫХ ФРАКЦИЙ У ДЕТЕЙ
- •ИНДИВИДУАЛЬНЫЕ БЕЛКИ ПЛАЗМЫ КРОВИ
- •Альбумин
- •ФЕРМЕНТЫ КРОВИ
- •Энзимодиагностика
- •Причины изменения активности ферментов в крови
- •Группы ферментов сыворотки крови
- •Единицы измерения активности ферментов
- •ОСТАТОЧНЫЙ АЗОТ КРОВИ
- •Фракции остаточного азота
- •ОБМЕН ЖЕЛЕЗА
- •Суточная потребность
- •Пищевые источники
- •Растительная пища (в 100 г)
- •Животная пища (в 100 г)
- •Всасывание
- •Метаболизм железа
- •Выведение
- •Нарушение обмена железа
- •Избыток железа
- •Железодефицит
- •Причины
- •Симптомы
- •ГЕМОПРОТЕИНЫ. ОБМЕН ГЕМА
- •СТРОЕНИЕ И СИНТЕЗ ГЕМА
- •Регуляция синтеза гема
- •МИОГЛОБИН
- •ГЕМОГЛОБИН
- •Строение гемоглобина
- •Нормальные и патологические формы гемоглобина
- •Нормальные формы
- •Патологические формы
- •Изменение рН среды
- •Кооперативное взаимодействие
- •Роль 2,3-дифосфоглицерата
- •Нарушение синтеза гемоглобина
- •Порфирии
- •Талассемии
- •ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ
- •КАТАБОЛИЗМ ГЕМА
- •НАРУШЕНИЯ ОБМЕНА БИЛИРУБИНА
- •Гемолитическая желтуха
- •Механическая желтуха
- •Паренхиматозная желтуха
- •Нарушения обмена билирубина у детей
- •Гемолитическая болезнь новорожденного
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Физиологическая (транзиторная) желтуха новорожденных
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Желтуха недоношенных
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Негемолитическая гипербилирубинемия новорожденных, вызываемая молоком матери
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
- •РОЛЬ ВНЕКЛЕТОЧНЫХ ИОНОВ ВОДОРОДА
- •РОЛЬ ВНУТРИКЛЕТОЧНЫХ ИОНОВ ВОДОРОДА
- •ОСНОВНЫЕ ПОКАЗАТЕЛИ КОС
- •Водородный показатель
- •Нормальные величины
- •Клинико-диагностическое значение
- •Парциальное давление углекислого газа
- •Нормальные величины
- •Клинико-диагностическое значение
- •Нормальные величины
- •Клинико-диагностическое значение
- •Концентрация буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •Избыток буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оксигемоглобин
- •Насыщение гемоглобина кислородом
- •Общее содержание кислорода
- •Парциальное давление кислорода
- •КОМПЕНСАЦИЯ ИЗМЕНЕНИЙ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА В ПЛАЗМЕ КРОВИ
- •Буферные системы
- •Бикарбонатная буферная система
- •Фосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Дыхательная система
- •Костная ткань
- •Печень
- •Почки
- •Реабсорбция бикарбонат-ионов
- •Ацидогенез
- •Аммониегенез
- •ВНУТРИКЛЕТОЧНАЯ РЕГУЛЯЦИЯ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА
- •Метаболический ацидоз
- •Причины
- •Компенсация
- •Метаболический алкалоз
- •Причины
- •Компенсация
- •Респираторный ацидоз
- •Причины
- •Компенсация
- •Респираторный алкалоз
- •Причины
- •Компенсация
- •ВОДНЫЙ БАЛАНС
- •Источники воды
- •Выведение воды
- •Регуляция водного баланса
- •БИОХИМИЯ ПОЧЕК
- •ЭКСКРЕТОРНАЯ ФУНКЦИЯ
- •РЕГУЛИРУЮЩАЯ ФУНКЦИЯ
- •МЕТАБОЛИЧЕСКАЯ ФУНКЦИЯ
- •МЕХАНИЗМ ОБРАЗОВАНИЯ МОЧИ
- •Ультрафильтрация
- •Лабораторная оценка фильтрации
- •Реабсорбция
- •Проксимальный извитой каналец
- •Тонкое нисходящее колено петли Генле
- •Тонкое восходящее колено петли Генле
- •Толстая восходящая часть петли Генле
- •Дистальный каналец
- •Конечный отдел дистального канальца и собирательные трубочки
- •Лабораторная оценка реабсорбции
- •СВОЙСТВА И СОСТАВ МОЧИ В НОРМЕ И ПАТОЛОГИИ
- •Поверхностное натяжение
- •Кислотно-основная реакция (рН)
- •Нормальные величины
- •Цвет
- •Нормальные величины
- •Физиологические изменения
- •Патологические изменения
- •Прозрачность
- •Запах
- •Плотность
- •Нормальные величины
- •Физиологические изменения
- •Осмоляльность
- •Нормальные величины
- •Физиологические изменения
- •Патологические изменения
- •Объем
- •Нормальные величины
- •Физиологические изменения
- •Патологические изменения
- •ПРОИСХОЖДЕНИЕ КОМПОНЕНТОВ МОЧИ
- •Физиологические компоненты мочи
- •Неорганические компоненты мочи
- •Вода
- •Натрий
- •Нормальные величины
- •Калий
- •Нормальные величины
- •Кальций и магний
- •Нормальные величины
- •Аммиак
- •Нормальные величины
- •Хлориды
- •Нормальные величины
- •Бикарбонаты
- •Нормальные величины
- •Фосфаты
- •Нормальные величины
- •Органические компоненты мочи
- •Мочевина
- •Нормальные величины
- •Креатинин
- •Нормальные величины
- •Креатин
- •Нормальные величины
- •Мочевая кислота
- •Нормальные величины
- •Гиппуровая кислота
- •Нормальные величины
- •Органические кислоты
- •Нормальные величины
- •Пигменты
- •Нормальные величины
- •Патологические компоненты мочи
- •Пигменты
- •Нормальные величины
- •Белки
- •Нормальные величины
- •Глюкоза
- •Нормальные величины
- •Кетоновые тела
- •Нормальные величины
- •БИОХИМИЯ ПЕЧЕНИ
- •Функции печени
- •МЕТАБОЛИЧЕСКАЯ ФУНКЦИЯ
- •Углеводный обмен
- •Липидный обмен
- •Белковый обмен
- •Пигментный обмен
- •Оценка метаболической функции
- •ОБЕЗВРЕЖИВАЮЩАЯ ФУНКЦИЯ
- •Реакции микросомального окисления
- •Антипириновая проба
- •Реакции конъюгации
- •БИОТРАНСФОРМАЦИЯ С ОБРАЗОВАНИЕМ ТОКСИЧНЫХ ПРОДУКТОВ
- •Органотоксичность
- •Химический канцерогенез

www.biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
19 |
|
|
|
СТРОЕНИЕ И КЛАССИФИКАЦИЯ СЛОЖНЫХ БЕЛКОВ
У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа. Она называется лиганд, (лат. ligo – связываю) то есть молекула, связанная с белком. В случае если лиганд несет структурную и/или функциональную нагрузку, он называется просте-
тической группой.
В роли лиганда могут выступать любые молекулы:
o молекулы, выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы, какие-либо другие органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах, медь в церулоплазмине,
o переносимые белками молекулы: железо в трансферрине, гемоглобин в гаптоглобине, гем в гемопексине,
o субстраты для ферментов – любые молекулы и даже другие белки.
Узнавание лиганда обеспечивается:
o комплементарностью структуры центра связывания белка структуре лиганда, иначе говоря, пространственным и химическим соответствием белка и лиганда. Они подходят друг к другу как ключ к замку, например, соответствие фермента и субстрата,
o иногда узнавание может зависеть от реакционной способности атома, к которому присоединяется лиганд. Например, связывание кислорода железом гемоглобина, или жирной кислоты с альбумином.
Функции лиганда в составе сложного белка разнообразны:
o изменяет свойства белков (заряд, растворимость, термолабильность), например, фосфорная кислота в фосфопротеинах или остатки моносахаридов в гликопротеинах,
o защищает белок от протеолиза вне и внутри клетки, например углеводная часть в гликопротеинах,
o обеспечивает возможность транспорта нерастворимых в воде соединений, например, перенос жиров липопротеинами,
o придает биологическую активность и определяет функцию белка, например, нуклеиновая кислота в нуклеопротеинах, гем в гемоглобине, углевод в рецепторных белках, o влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и
секрецию белков, это выполняет, как правило, углеводный остаток.
МЕТАЛЛОПРОТЕИНЫ
Металлопротеины, кроме белка, содержат ионы одного или нескольких металлов. Металлопротеины часто являются ферментами. Ионы металлов соединены координационными связями с функциональными группами белка и выполняют следующие функции:
Строение, свойства и классификация аминокислот и белков |
20 |
|
|
o участвуют в ориентации субстрата в активном центре фермента,
o входят в состав активного центра фермента и участвуют в катализе, например, служат акцепторами электронов на определенной стадии ферментативной реакции.
К металлопротеинам, например, относятся белки, содержащие:
o медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ,
o железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови,
o цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, карбоангидраза, образующая уголюную кислоту из CO2 и H2O, щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений.
o селен – тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы, антиоксидантный фермент глутатионпероксидаза,
o кальций – α-амилаза слюны и панкреатического сока, гидролизующая крахмал.
НУКЛЕОПРОТЕИНЫ
Нуклеопротеины – сложные белки, включающие нуклеиновые кислоты. Они формируют в рибосомы, хроматин, вирусы.
Вхромосомах нуклеиновая кислота представлена дезоксирибонуклеиновой кислотой (ДНК) и связана с гистонами, формируя хроматин.
Врибосомах рибонуклеиновая кислота (РНК) связывается со специфическими рибо-
сомальными белками.
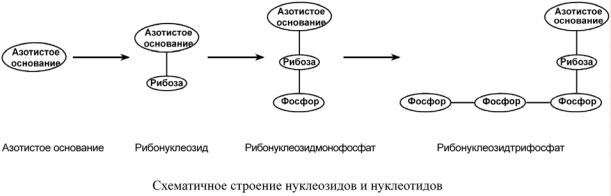
Нуклеиновые кислоты являются полимерными молекулами и состоят из мономеров, называемых нуклеотидами. Нуклеотид содержит фосфорную кислоту (один, два или три остатка), сахар (рибозу или дезоксирибозу), азотистое основание (аденин, гуанин, цитозин, урацил либо тимин).
www.biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
21 |
|
|
|
Самым распространенным в природе является нуклеотид аденозинтрифосфат, используемый как высокоэнергетическое соединение для реакций трансмембранного переноса веществ и реакций синтеза.
Связываясь через фосфатные остатки, нуклеотиды образуют длинные цепочки – нуклеиновые кислоты.
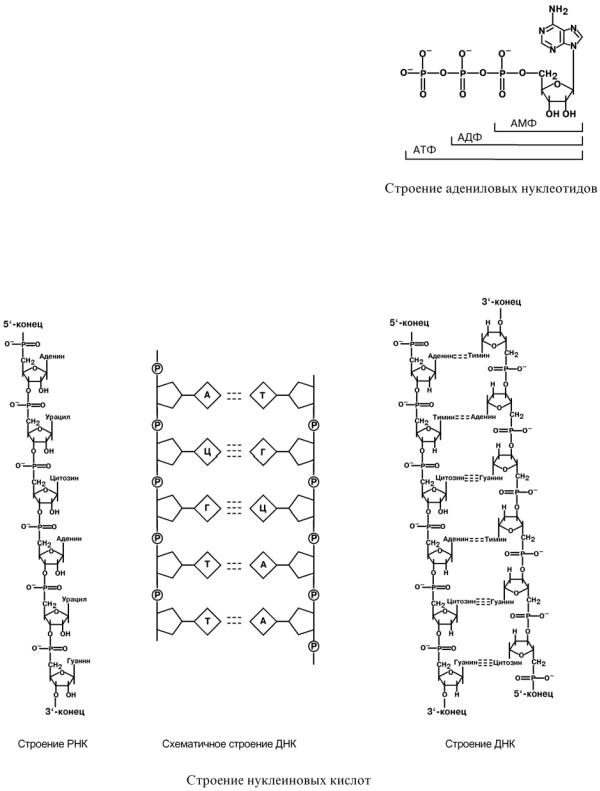
Выделяют два вида нуклеиновых кислот в зависимости от пентозы, входящей в их состав – рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК). Сахарофосфатный остов в ДНК и РНК заряжен отрицательно благодаря заряду фосфатных групп. В то же время пуриновые и пиримидиновые основания гид-
рофобны.
Цепи ДНК и РНК обладают направленностью, т.е. имеют 3'-конец и 5'-конец. В ДНК цепи антипараллельны, т.е. направлены в разные стороны. Имеется комплементарность азотистых оснований, соответствие аденин комплементарен тимину (А=Т), гуанин комплементарен цитозину (Г=Ц).
ФОСФОПРОТЕИНЫ
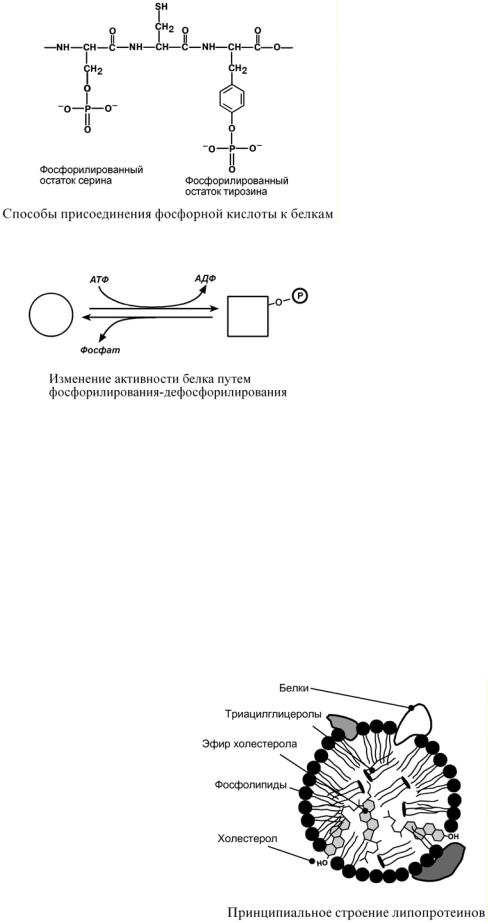
Фосфопротеины – это белки, в которых присутствует фосфатная группа, она связывается с пептидной цепью через остатки тирозина, серина, треонина (т.е. тех аминокислот, которые содержат ОН-группу).
Строение, свойства и классификация аминокислот и белков |
22 |
|
|
Фосфорная кислота может выполнять:
1.Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в
казеине молока, яичном альбумине.
2.Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированную или в дефосфорилированную форму, что играет регулирующую роль в его работе. Например, 1) ферменты гликогенсинтаза и гликогенфосфорилаза (см "Регуляция активности ферментов"), 2) гистоны в фосфорилированном состоянии менее прочно связываются с ДНК и активность генома возрастает.
ЛИПОПРОТЕИНЫ
Клипопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды.
Однако традиционно к липопротеинам относят и надмолекулярные образования, выполняющие транспортную функцию и состоящие из белков и молекул всех классов липидов.
Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупа и ядро. "Скорлупа" липопротеина является гидрофильной, ядро – гидрофобное. Ядро формируют неполярные эфиры холестерола и триацилглицеролы. В поверхностном слое ("скорлупе") находятся фосфолипиды, холестерол, белки.
Белки в липопротеинах называются апо-
