
- •Вопрос 4. Структурная классификация полиморфизма
- •Вопрос 6. Твердые растворы
- •Вопрос 9. Признаком краевой дислокации является наличие в одной части кристалла лишней («оборванной» или «недостроенной») атомной плоскости, не имеющей продолжения в другой части кристалла.
- •Вопрос 11. Свойства дислокаций:
- •Вопрос 12. Гипотезы строения жидкостей .
- •Вопрос 14. Фх особенности стеклообразного сост-я:
- •Вопрос 15. Процесс стеклообразования определяется следующими факторами:
- •Вопрос 16.
- •Вопрос 17. Устойчивость и коагуляция коллоидных силикатных систем
- •Вопрос 18. Структуры, образующиеся в высокодисперсных системах, п. А. Ребиндер предложил классифицировать:
- •Вопрос 22. Общий вид диаграммы состояния однокомпонентной системы
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25. Двухкомпонентные диаграммы состояния
- •Вопрос 26. Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно).
- •Вопрос 27.
- •Вопрос 28. Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов.
- •Вопрос 29. Динамический и статический методы построения диаграмм состояния.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32. Система MgO—SiO2
- •Вопрос 33. Система а12o3— SiO2
- •Вопрос 34. Трехкомпонентные диаграммы состояния
- •Вопрос 36. Диагр.Сост. Трехкомп.Сист. С эвтектикой.
- •Вопрос 37.
- •Вопрос 39.
- •Вопрос 40. Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями и ликвацией.
- •Вопрос 42. Система Na2o-CaO-SiO2
- •Вопрос 43. Система CaO-Al2o3-SiO2
- •Вопрос 44. Система MgO- Al2o3- SiO2
- •Вопрос 45. Система СаО—MgO — SiO2
- •Вопрос 46. Диссоциация –химический процесс распада молекул, радикалов, ионов на несколько частиц, имеющих меньшую молекулярную массу.
- •Вопрос 47. Дегидратация.
- •Вопрос 49.
- •Вопрос 50. Особенности твердофазовых реакций:
- •Вопрос 51. Кинетика твердофазовых реакций
- •Вопрос 52. Факторы, влияющие на скорость твердофазовых реакций:
- •Вопрос 54. Жидкостное спекание.
- •Вопрос 55. Твердофазовое спекание. Осуществляется под действием температуры за счет переноса вещества в твердой фазе в отсутствие жидкости и без участия газовой фазы.
- •Вопрос 56. Кинетика твердофазового спекания.
- •Вопрос 57. Спекание за счет процесса “испарние — конденсация”
- •Вопрос 58. Первичная Рекристаллизация.
- •Вопрос 59. Вторичная рекристаллизация.
- •Вопрос 61. Кристаллизация.
- •Вопрос 62. Гомогенное образование центров кристаллизации
- •Вопрос 63. Гетерогенное образование центров кристаллизации.
- •Вопрос 66. Структура и классиф полимеров
- •Вопрос 67. Химическое строение макромолекул
- •Вопрос 68. Особенности линейных, разветвленных и сетчатых полимеров
- •Вопрос 69. Способы получения полимеров.
- •Вопрос 70. Карбоцепные полимеры
- •Вопрос 72. Старение и стабилизация полимеров.
- •Вопрос 73. Физическая Структура Полимеров.
- •Вопрос 74.Агрегатные и фазовые состояния полимеров
- •Вопрос 75. Аморфное состояние полимеров.
- •Вопрос 78. Химический состав древесины.
- •Вопрос 79. Под макроскопическим строением (макроструктурой) древесины понимают детали структуры, которые можно исследовать невооруженным глазом и с помощью лупы.
- •Вопрос 80. Анатомическое строение древесины
Вопрос 25. Двухкомпонентные диаграммы состояния
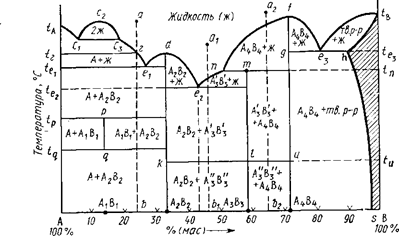
правило фаз Гиббсаf=K+1—Р=2+1-P=3-P
Вертикали состава- например, ab, d—А2В2, а1b1. Всем точкам этой вертикали соответствует один и тот же состав с одинаковым содержанием компонентов.Изотермы – горизонтали, например, прямые, соответствующие точкамte1,tе2,tp. Поскольку вдоль кривых ликвидуса и солидуса в равновесии находятся две фазы — жидкая и одна твердая, по правилу фаз все точки этих кривых (кроме тройных точек и точек, отвечающих составам индивидуальных химических соединений) выражают моновариантное состояние системы (f=K+1—Р=2+1—2=1). Однофазная область жидкой фазы над кривыми ликвидуса является дивариантной.
«Путь кристаллизации»- описываемая на диаграмме последовательность фазовых изменений и изменений составов жидкой и твердой фаз при охлаждении расплава данного состава; под«путем плавления»— та же последовательность, но для твердой смеси. Для одного и того же состава графически путь кристаллизации и путь плавления идентичны, но противоположны по направлению и последовательности фазовых превращений.
Диаграмма состояния двухкомпонентной системы с эвтектикой без химических соединений и твердых растворов:
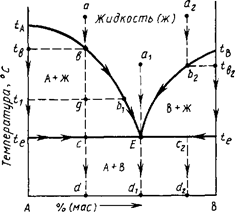
Основные элементы строения - tAE и tBE–кривые ликвидуса,которые показывают:
1) Состав жидкой фазы (расплава), насыщенной при температуре ликвидуса по отношению к одной твердой кристаллической фазе, т. е. существующей с ней в равновесии (например, на кривой tAE в равновесии с жидкой фазой находятся кристаллы соединения А, на кривой tBE — кристаллы соединения В).
2.Точки кривых ликвидуса показывают температуру начала кристаллизации расплава при его охлаждении или температуру конца плавления твердого вещества при его нагревании.
3. Поскольку в точках ликвидуса в равновесии находятся две фазы – один вид кристаллов и насыщенная жидкость, то система в них будет иметь 1 степень свободы, то есть будет моновариантной.
Закон Рауля- Вант-Гоффа: при прибавлении до определенной концентрации к любому веществу другого вещества, не образующим с первым твердого раствора, во всех случаях наблюдается понижение температуры плавления при нагревании смеси, или понижение температуры кристаллизации расплава при охлаждении.
Эвтектическая точка –точка пересечения кривых ликвидуса.
Эвтектический состав строго постоянен для каждой данной частной двухкомпонентной системы и расположен между точками составов соединений, образующих эту частную систему. Плавление или кристаллизациялюбого составатаких систем происходит (начинается и заканчивается) при одной и той же строго постоянной и наинизшей (по сравнению со всеми другими составами этой частной системы) температуре, называемой эвтектической температурой (в данном случае, температура te).
В точках эвтектики в равновесии находятся три фазы: одна жидкая и две твердые А и В, поэтому в соответствии с правилом фаз точки эвтектики выражают инвариантное состояние системы (f=K +1—Р=2 +1—3=0). Это означает, что система из характеризуемой точкой эвтектики состояния не может перейти в другое состояние (т. е. не может изменить свои параметры — температуру и концентрацию), пока не исчезнет хотя бы одна фаза.
Следует отметить, что в точках эвтектики происходит только физический процесс кристаллизации (при охлаждении) или плавления (при нагревании) и кристаллизация в этой точке всегда заканчивается(т. е. жидкая фаза исчезает).
Любую смесь твердых компонентов А и В можно представить как эвтектическую смесь + избыток А или В. Например, пусть эвтектический состав содержит 25% А и 75%В, то есть в соотношении А:В=1:3. Если взять смесь, содержащую 40%А и 60%В, то в ней можно мысленно выделить эвтектический состав (20%А и 60%В, т.е. А:В=1:3), который расплавится при эвтектической температуре, и избыток кристаллов А в количестве 20%, плавление которого уже будет происходить при более высокой температуре.
Для определения концентрации компонентов в жидкой фазе или их содержания в твердом веществе данного состава в двухкомпонентных диаграммах состояния необходимо из фигуративной точки, выражающей этот состав, опустить на ось концентраций вертикаль состава и отсчитать по этой оси содержание компонентов.
Область на диаграмме выше кривых ликвидуса однофазна (расплав того или иного состава), и в соответствие с правилом фаз число степеней свободы f=3-1=2, то есть система дивариантна. ОбластиtetAEиtetBEявляются моновариантными, поскольку в них в равновесии находятся две фазы – один вид кристаллов (А или В) и расплав, насыщенный по отношению к ним. произвольно без изменения количества и природы фаз можно менять только один параметр – температуру или концентрацию, тогда второй параметр будет меняться уже «зависимым» образом, то есть не произвольно, а в соответствии с математической закономерностью, которая задается видом кривой ликвидуса.
Для определения составов фаз, находящихся в равновесии при данной температуре, проводят линии, параллельные оси концентраций, которые называются коннодами.Коннодами на диаграммах состояния называются отрезки прямых, соединяющие своими концами точки составов фаз, находящихся в равновесии при данной температуре (например, коннодаt1b1, лежащая своими концами на кривой ликвидуса, показывает, что при соответствующей температуре в равновесии находятся жидкая фаза состава b1и кристаллы А которых выражаются точками c1 и с2, коннода kl, лежащая своими концами на вертикалях состава соединений А2В2 и А3В3, показывает, что в равновесии находятся фазы кристаллов этих фаз.
Правило рычага:если одна фаза при изменении параметров системы разлагается на две другие фазы, то количественное соотношение образующихся фаз будет обратно пропорциональным длинам отрезков от точки состава исходной фазы до точек составов образующихся фаз.
![]()
Предположим, что фаза, состав которой выражается точкой М(рис. 74), разлагается на две фазы, составы которых выражаются точкамиkиn(например, при охлаждении жидкой фазы состава М происходит ее частичная кристаллизация, в результате чего жидкость разлагается на кристаллическую фазу составаkи жидкую фазу составаn).
. В соответствии с правилом рычага количественное соотношение фаз kиnбудет обратно пропорциональным длинам отрезков МnиMkот точки состава исходной фазы М до точек состава образующихся фазkиn, причем обратную пропорциональность следует понимать в том смысле, что длина отрезкаMk(прилегающего своим концом к точкеk) будет характеризовать содержание фазы составаnи, наоборот, длина отрезка Мn(прилегающего своим концом к точкеn) будет определять содержание фазы составаk. Таким образом, можно написать следующее соотношение:
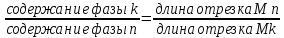
Поскольку Mk+Mn=kn, количественное содержание фаз, выраженное в процентах, можно найти из следующих выражений:
содержание
k=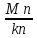 100%:
содержаниеn=
100%:
содержаниеn=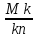 100%:
100%:
где Мn,Mkиkn— длины соответствующих отрезков, мм или см.
ПРИМЕР:
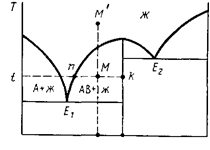
Предположим, что исходный расплав состава М' (рис. 75) охлажден до температуры t. При этой температуре в равновесии находятся жидкая фаза, состав которой выражается точкойn, и твердая фаза (кристаллы соединения АВ), состав которой выражается точкойk, лежащей на вертикали состава соединения АВ. Исходный состав можно выразить
точкой М, лежащей на пересечении конноды nkс вертикалью исходного состава М't(составы М' и М одинаковы). По правилу рычага содержание при температуреtжидкой фазы (точкаn) и кристаллической фазы АВ (точкаk) определится из выражений:
содержание жидкой фазы n=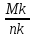 100%;
100%;
содержание кристаллов АВ = 100%;
100%;
