
- •Вопрос 4. Структурная классификация полиморфизма
- •Вопрос 6. Твердые растворы
- •Вопрос 9. Признаком краевой дислокации является наличие в одной части кристалла лишней («оборванной» или «недостроенной») атомной плоскости, не имеющей продолжения в другой части кристалла.
- •Вопрос 11. Свойства дислокаций:
- •Вопрос 12. Гипотезы строения жидкостей .
- •Вопрос 14. Фх особенности стеклообразного сост-я:
- •Вопрос 15. Процесс стеклообразования определяется следующими факторами:
- •Вопрос 16.
- •Вопрос 17. Устойчивость и коагуляция коллоидных силикатных систем
- •Вопрос 18. Структуры, образующиеся в высокодисперсных системах, п. А. Ребиндер предложил классифицировать:
- •Вопрос 22. Общий вид диаграммы состояния однокомпонентной системы
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25. Двухкомпонентные диаграммы состояния
- •Вопрос 26. Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно).
- •Вопрос 27.
- •Вопрос 28. Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов.
- •Вопрос 29. Динамический и статический методы построения диаграмм состояния.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32. Система MgO—SiO2
- •Вопрос 33. Система а12o3— SiO2
- •Вопрос 34. Трехкомпонентные диаграммы состояния
- •Вопрос 36. Диагр.Сост. Трехкомп.Сист. С эвтектикой.
- •Вопрос 37.
- •Вопрос 39.
- •Вопрос 40. Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями и ликвацией.
- •Вопрос 42. Система Na2o-CaO-SiO2
- •Вопрос 43. Система CaO-Al2o3-SiO2
- •Вопрос 44. Система MgO- Al2o3- SiO2
- •Вопрос 45. Система СаО—MgO — SiO2
- •Вопрос 46. Диссоциация –химический процесс распада молекул, радикалов, ионов на несколько частиц, имеющих меньшую молекулярную массу.
- •Вопрос 47. Дегидратация.
- •Вопрос 49.
- •Вопрос 50. Особенности твердофазовых реакций:
- •Вопрос 51. Кинетика твердофазовых реакций
- •Вопрос 52. Факторы, влияющие на скорость твердофазовых реакций:
- •Вопрос 54. Жидкостное спекание.
- •Вопрос 55. Твердофазовое спекание. Осуществляется под действием температуры за счет переноса вещества в твердой фазе в отсутствие жидкости и без участия газовой фазы.
- •Вопрос 56. Кинетика твердофазового спекания.
- •Вопрос 57. Спекание за счет процесса “испарние — конденсация”
- •Вопрос 58. Первичная Рекристаллизация.
- •Вопрос 59. Вторичная рекристаллизация.
- •Вопрос 61. Кристаллизация.
- •Вопрос 62. Гомогенное образование центров кристаллизации
- •Вопрос 63. Гетерогенное образование центров кристаллизации.
- •Вопрос 66. Структура и классиф полимеров
- •Вопрос 67. Химическое строение макромолекул
- •Вопрос 68. Особенности линейных, разветвленных и сетчатых полимеров
- •Вопрос 69. Способы получения полимеров.
- •Вопрос 70. Карбоцепные полимеры
- •Вопрос 72. Старение и стабилизация полимеров.
- •Вопрос 73. Физическая Структура Полимеров.
- •Вопрос 74.Агрегатные и фазовые состояния полимеров
- •Вопрос 75. Аморфное состояние полимеров.
- •Вопрос 78. Химический состав древесины.
- •Вопрос 79. Под макроскопическим строением (макроструктурой) древесины понимают детали структуры, которые можно исследовать невооруженным глазом и с помощью лупы.
- •Вопрос 80. Анатомическое строение древесины
Вопрос 18. Структуры, образующиеся в высокодисперсных системах, п. А. Ребиндер предложил классифицировать:
Коагуляционные структурыобразуются при сцеплении частиц ван-дер-ваальсовыми силами в звенья, цепочки, пространственные сетки, агрегаты.
Достигнув определенного размера, агрегированные частицы образуют коагулят (коагулюм). При вовлечении дисперсионной среды в пространственную сетку агрегирующихся частиц имеет место гелеобразование, т. е. переход коллоидного раствора из свободнодисперсного состояния (золя) в связнодисперсное (гель). Твердообразная текучая коллоидная система с пространственно-сетчатым расположением частиц, ячейки между которыми заполнены дисперсионной средой, называется гелем(их разделяют на: хрупкие (неэластичные) и эластичные (студни)). Хрупкие гели образуются коллоидными частицамиSiO2, ТiO2,SnO2,Fе2О3,V2O5и т. п. Гели, впитывая смачивающую их жидкость, почти не изменяются в объеме, а потеряв жидкость, резко изменяют свои свойства, становясь хрупкими. Пример: гель кремниевой кислоты.
Эластичные гели (студни)характерны для высокомолекулярных полимеров. Такие гели поглощают не все смачивающие их жидкости, а только те, которые имеют химическое сходство по составу. Поглощение жидкости эластичным гелем сопровождается увеличением объема — набуханием.
Дисперсным системам с коагуляционными структурами свойственно явление синерезиса — самопроизвольного уменьшения объема геля с выделением из него дисперсионной среды, находящейся в геле. Процессы набухания, растворения, гелеобразования и высушивания определяются природой вещества и могут происходить многократно или только один раз. Например, при прибавлении к разбавленному водному раствору силиката натрия соляной кислоты образуется коллоидный гель кремниевой кислоты. Высушивание такого геля мало изменяет его объем, так как выделяющаяся вода замещается воздухом. Свойства этого геля с уменьшением содержания воды изменяются постепенно — от пластичного до жесткого.
Гели, из которых удаленная жидкая фаза способна ими вновь поглощаться, называются ксерогелями. Например, продукты гидратации цемента, формирующиеся в затвердевшем материале, обладают свойствами ксерогелий, которые в результате неоднократного увлажнения и сушки снижают физико-механические свойства, стабилизирующиеся затем через несколько циклов. . Коагуляционные системы в результате механических воздействий способны к обратимому разрушению и восстановлению структуры. Это явление, называемоетиксотропией, характерно для многих силикатных дисперсных систем. Глинистые водные суспензии, обладающие тиксотропными свойствами, широко применяют при бурении нефтяных и газовых скважин. Попадая на стенку скважины, глинистый раствор упрочняется, предотвращая осыпание породы в скважину. Обратное тиксотропии явление называетсядилатансией. Этот процесс, выражающийся в загустевании вследствие механического воздействия, наблюдается в суспензиях зерен кварца в воде или в концентрированных растворах метасиликата калия при избытке кремниевой кислоты. В результате механического воздействия на высококонцентрированный раствор жидкого стекла (происходит резкое его загустевание и переход в твердое состояние. Механизм дилатансии объясняется нарушением непрерывных водных оболочек в результате резкого увеличения напряжения сдвига. При этом в системе появляются воздушные пустоты, способствующие загустеванию. Явление дилатансии иногда наблюдается в отливочных глинистых массах.
Конденсационно-кристаллизационные структурывозникают в результате срастания частиц химическими силами с формированием жесткой структуры. При срастании аморфных частиц образуется структура, называемая конденсационной, кристаллических частиц — кристаллизационной.
Не проявляют тиксотропии, пластичности и эластичности, а обладают упруго-хрупкими свойствами. Пример— структура затвердевших минеральных вяжущих веществ. Растворение безводных вяжущих и последующее выкристаллизовывание из пересыщенных растворов гидратных новообразований является главным условием образования конденсационно-кристаллизационных структур. Типичные кристаллизационные структуры формируются при спекании, например, композиции глинистых минералов. В этом случае структура обусловливает основные свойства керамических материалов— водопоглощение, плотность, пористость, а также характер кристаллических новообразований.
Вопрос 19. «Глина-вода». Глинистые минералы, будучи в коллоидно-дисперсном состоянии, обладают некоторымихарактерными особенностями: определенным строением кристаллической решетки, способностью к ионному обмену, проявлением упругопластичных свойств и тиксотропии в пастах и суспензиях, сорбцией дисперсной фазы. Глинистые минералы обладают сетчаткой или слоистой структурой. В соответствии с их структурой глинистыеминералы классифицируются накаолинитовые, монтмориллонитовые и иллитовые (гидрослюды) группы. Кристаллическая решетка глинистых минералов состоит из тетраэдров [SiO4] и октаэдров [АlO6].
В каолинитовую группу входят минералы каолинит, диккит, галлуазит, в монтмориллонитовую — монтмориллонит, нонтронит, гекторит; в группу гидрослюд — гидрослюда, иллит, аллевардит. По мере повышения дисперсности увеличиваются адсорбция катионов, вязкость суспензии, предел текучести, пластичность. Для глинистых суспензий, так же как и для коллоидных систем, решающую роль оказывает адсорбция ионов электролитов, сопровождаемая образованием двойного электрического слоя и гидратной защитной оболочки. Характерные свойства глинистых суспензий определяются химико-минералогическим составом глинистого вещества, а также видом и содержанием примесей, степенью дисперсности и отношением дисперсной фазы к дисперсионной среде.
В процессе взаимодействия между водой и поверхностью глинистых минералов водородная связь играет основную роль. Имеющиеся на поверхности глинистых частиц многочисленные кислородные атомы, которые являются структурными элементами их кристаллической решетки, обусловливают ориентацию гидроксильных групп молекул воды по отношению к поверхности и возникновение при этом водородной связи. Вследствие высокой удельной поверхности глины обладают значительным запасом свободной энергии, что проявляется в действии в поверхностных слоях глинистых частиц молекулярных сил. На поверхности глинистых частиц возникают граничные фазы из ориентированных молекул воды, по структуре и вязкости отличающиеся от свободной воды. Около коллоидной частицы сначала располагается прочно связанный слой адсорбционной воды, за которым следует диффузный слой слабо (рыхло) связанной воды. Общее содержание прочно- и слабосвязанной воды определяется величиной заряда, дисперсностью, минералогическим составом, емкостью поглощения, состоянием поверхности частиц, видом и концентрацией адсорбированных ионов и ионов в растворе. В свою очередь, адсорбционные и гидратационные свойства ионов зависят от их заряда, ионного радиуса и степени поляризуемости.
Тонкие слои жидкости, находящиеся на поверхности глинистых частиц, вызывают расклинивающее давление, а по мере увеличения толщины пленки до нескольких десятых микрометра расклинивающее действие обусловливается электростатическим взаимодействием наружных диффузных слоев двойного электрического слоя. Кроме этого, расклинивающее действие частично обусловлено силами молекулярного притяжения. Толщина гидратных оболочек, окружающих глинистые частицы, колеблется от 0,77 мкм до 5 нм.
Возникновение вокруг глинистых частиц ориентированных молекул определяется зарядом двойного электрического слоя, который возникает вследствие избирательной адсорбции ионов. Знак и значение электрокинетического потенциала являются суммированным результатом наличия положительных и отрицательных зарядов на частицах.
Ионы, закрепленные на поверхности глинистых частиц размером меньше 1 мкм, определяют знак электростатических зарядов. При этом первично адсорбируются те ионы, которые, взаимодействуя с ионами и атомами кристаллической поверхности этих глинистых частиц, могут давать практически нерастворимые соединения. В нейтральных и слабощелочных средах у глинистых частиц преобладает отрицательный заряд. Вид и число адсорбированных ионов оказывает существенное влияние на свойства системы глина — вода.
Вопрос 20. В природе растворимый кремнезем получается в основном в результате разрушения минералов в атмосферных условиях, лишь незначительная часть образуется вследствие растворения песков морских побережий.
Разновидности кремнезема:
безводный кристаллический кремнезем SiO2;
гидратированный кристаллический кремнезем SiO2·xH2O;
безводный аморфный кремнезем, имеющий микропористое анизотропное строение (волокнистого или пластинчатого строения);
безводный и содержащий воду кремнезем, имеющий изотропное строение (золи, гели, тонкодисперсные порошки);
аморфное кварцевое стекло.
Природными гидратами кремнезема общего состава SiO2·xH2O, имеющими аморфное или скрытокристаллическое строение, являются опалы, опаловые горные породы.
Аморфный кремнезем может быть в виде кварцевого стекла, кремнезема, получаемого облучением быстрыми нейтронами аморфных или кристаллических разновидностей кремнезема, а также микроаморфного кремнезема (золи, гели, пористые стекла).
Растворение кремнезема. Монокремниевая или ортокремниевая кислотаSi(ОН)4является растворимой формой кремнезема. РастворимостьSi(ОН)4в воде при 25°С для аморфного кремнезема составляет 0,007% (маc.)SiO2, в то время как для высокопористого аморфного кремнезема, состоящего из тонкодисперсных частиц, растворимость несколько выше и составляет около 0,010...0,013% (маc). Кристаллический кремнезем (кварц) при той же температуре имеет значительно меньшую растворимость в воде —0,0006% (мас).
Для растворения кремнезема в воде, представляющего собой деполимеризацию посредством гидролиза, необходимо присутствие катализатора, способного хемосорбироваться(поглощать одно в-во другим) на поверхности частиц кремнезема, повышая тем самым координационное число поверхностных атомов кремния до четырех и более и ослабляя их кислородные связи с другими атомами кремния, расположенными в последующем слое.
Схема предполагаемого механизма (по Р. Айлеру) растворения кремнезема в воде в присутствии ОН_-ионов (пунктирная линия показывает поверхность раздела между кремнеземом и водой):
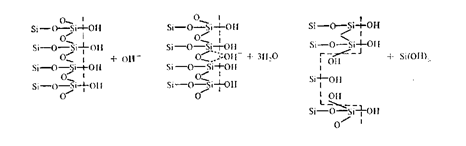
Адсорбированный на поверхности частицы кремнезема ОН--ион
способствует ослаблению связи кислород — кремний с последующим образованием силикат-иона, переходящего в раствор. Этот процесс идет непрерывно, обусловливая растворение SiO2.
Полимеризация кремнезема. В результате растворения кремнезема в воде при высокой температуре под давлением с последующим охлаждением образуются пересыщенные растворы мономераSi(ОН) 4, которые, будучи термодинамически нестабильными вследствие дегидратации, подвергаются конденсационной полимеризации.
Процесс полимеризации сопровождается конденсацией силанольных групп по схеме
≡ SiOH+HOSi≡ → ≡SiOSi≡+ Н2O
Сначала образуется димер, а затем другие разновидности кремниевой кислоты с более высокой относительной молекулярной массой. Будучи очень слабой, в чистом виде монокремниевая кислота не выделяется. Ее существование возможно лишь в разбавленном водном растворе, так как по мере повышения концентрации происходит конденсационная полимеризация. Полимеризации — поликремниевая кислота — сначала имеет вид прозрачной вязкой безводной жидкости, а затем по мере дальнейшей полимеризации превращается в прозрачный твердый гель, который, будучи высокогигроскопичным, растворим в полярных органических растворителях, но не в углеводородах.
МОДУЛЬ 2.
Вопрос 21. Системойназывается выделяемое из окружающей среды материальное тело или совокупность тел, ограниченных реальной физической или воображаемой математической поверхностью, которые могут взаимодействовать между собой или другими телами энергетически или путем обмена веществом. Изолированными являются системы, совершенно не взаимодействующие с окружающей средой
К закрытым относятся системы, не обменивающиеся с окружающей средой веществом, но взаимодействующие с ней путем передачи энергии (в виде теплоты или работы).Открытые системы—это системы, обменивающиеся с окружающей средой веществом (они могут обмениваться и энергией). Различают также системыгомогенные, не имеющие внутри себя поверхностей раздела между отдельными частями, различающимися по свойствам, игетерогенные, содержащие указанные поверхности. Системы, состоящие только из твердых и (или) жидких веществ, называютсяконденсированными. Значения свойств, характеризующих состояние системы, называются еепараметрами состояния - любые свойства системы — температура, давление, концентрация, удельный или молярный объем, в некоторых случаях — электрический потенциал, магнитное лоле, поверхностное натяжение и пр.
Различают внешние параметры(например, температура, давление), ивнутренние параметры(например, концентрация, удельный объем или другие удельные величины). Кроме того, параметры разделяют наэкстенсивные и интенсивные. Кэкстенсивным параметрами определяемым ими свойствам (например, объем, масса, внутренняя энергия, энергия Гиббса) относятся параметры, значения которых пропорциональны массе системы и аддитивны, т. е. равны сумме значений таких же параметров отдельных частей системы. Интенсивные параметры(например, температура, давление, концентрация, различные удельные и молярные свойства) не зависят от массы системы, а определяются только ее состоянием и характеризуют собой специфические свойства системы в данном состоянии. Чаще всего в качественезависимыхвыбирают такиепараметры, которые поддаются непосредственному измерению,—температуру, давление или упругость пара, концентрацию, молярный или удельный объем.
Изобарно-изотермический потенциал или энергия Гиббса . Энергия Гиббса для закрытых систем является функцией независимых параметров—температурыТ и давленияр и определяется выражением
G =H —TS =U—TS+pV,
где H—энтальпия;U— внутренняя энергия;S—энтропия.
Энергия Гиббса— одна из функций состояния, которая, с одной стороны,позволяетустановить возможность самопроизвольного (т. е. без затрат энергии извне) протекания процесса в системах, находящихся при постоянной температуре и давлении, и, с другой позволяет определить условия равновесия.
Фазой называется часть или совокупность гомогенных частей системы, отделенных от других частей системы поверхностью раздела и характеризующихся в отсутствие внешнего поля сил одинаковыми во всех своих точках составом и свойствами. С термодинамической точки зрения подфазойследует понимать совокупность частей системы, термодинамические свойства которых описываются одним и тем же уравнением состояния.
Простые или сложные вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной системы, находящейся в равновесны, называются независимыми компонентамисистемы. Они не превращаются друг в друга и общее содержание (концентрация) их в системе при данных параметрах не зависит от концентрации других составных частей системы. Число независимых компонентовК системы определяется по формулеK=K0- n,гдеК0 — общее число соединений, существующих в системе;n — число независимых уравнений, с помощью которых можно связать концентрации веществ, составляющих фазы системы.В чисто физических системах,n= 0 иК= Ко, т. е.число независимых компонентов равно общему числу индивидуальных химических соединений, существующих в системе.В химических системах, т. е. в системах, в которых между составными частями протекают обратимые химические реакции, концентрации лишь части соединений, входящих в систему, могут изменяться независимо. В этом случае концентрации участвующих в реакциях соединений количественно связаны друг с другом термодинамическими уравнениями химического равновесия, число которых равно числу независимо протекающих обратимых реакций.
Равновесным называется такое состояние системы, которое характеризуется при постоянных внешних условиях неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты. Для равновесных системdG = 0 и d2G>0.
Термодинамическими степенями свободы ( f ) называются независимые параметры системы находящейся в равновесии, изменение которых в определенных пределах не вызывает нарушения фазового равновесия, т. е. не приводит к изменению природы и числа существующих фаз.
Число степеней свободы равновесной системы характеризует ее вариантность, в зависимости от которой система может находиться в инвариантном (f=0), моновариантном (f=l), дивариантном (f=2) и т. д. состояниях. В инвариантном состоянии система не имеет степеней свободы, все ее параметры (например, температура, давление, концентрация) фиксированы и ни один из них не может изменяться без нарушения равновесия, т. е. без исчезновения старых и появления новых фаз. Моновариантное состояния системы означает, что в некоторых пределах можно произвольно изменять один параметр (все другие параметры в соответствии с этим будут принимать строго определенные значения) без изменения числа и природы фаз, при дивариантном состоянии системы можно изменять два параметра и т. д.
Правило фаз Гиббса, определяющее условия равновесия в таких системах
устанавливает соотношение между числом степеней свободы, числом независимых компонентов и числом фаз для систем, находящихся в термодинамическом равновесии.
Уравнение f=K+m-P
является общим математическим выражением правила фаз:
число степеней свободы (f) равновесной системы равно числу независимых компонентов(K)плюс число внешних параметров (m), влияющих на состояние системы, минус число фаз в системе (P).
Правило фаз позволяет априорно установить, находится ли система в равновесии, а если нет, то какова степень отклонения от равновесного состояния и какие изменения следует ожидать в системе при приближении ее к равновесному состоянию.
