
- •Вопрос 4. Структурная классификация полиморфизма
- •Вопрос 6. Твердые растворы
- •Вопрос 9. Признаком краевой дислокации является наличие в одной части кристалла лишней («оборванной» или «недостроенной») атомной плоскости, не имеющей продолжения в другой части кристалла.
- •Вопрос 11. Свойства дислокаций:
- •Вопрос 12. Гипотезы строения жидкостей .
- •Вопрос 14. Фх особенности стеклообразного сост-я:
- •Вопрос 15. Процесс стеклообразования определяется следующими факторами:
- •Вопрос 16.
- •Вопрос 17. Устойчивость и коагуляция коллоидных силикатных систем
- •Вопрос 18. Структуры, образующиеся в высокодисперсных системах, п. А. Ребиндер предложил классифицировать:
- •Вопрос 22. Общий вид диаграммы состояния однокомпонентной системы
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25. Двухкомпонентные диаграммы состояния
- •Вопрос 26. Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно).
- •Вопрос 27.
- •Вопрос 28. Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов.
- •Вопрос 29. Динамический и статический методы построения диаграмм состояния.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32. Система MgO—SiO2
- •Вопрос 33. Система а12o3— SiO2
- •Вопрос 34. Трехкомпонентные диаграммы состояния
- •Вопрос 36. Диагр.Сост. Трехкомп.Сист. С эвтектикой.
- •Вопрос 37.
- •Вопрос 39.
- •Вопрос 40. Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями и ликвацией.
- •Вопрос 42. Система Na2o-CaO-SiO2
- •Вопрос 43. Система CaO-Al2o3-SiO2
- •Вопрос 44. Система MgO- Al2o3- SiO2
- •Вопрос 45. Система СаО—MgO — SiO2
- •Вопрос 46. Диссоциация –химический процесс распада молекул, радикалов, ионов на несколько частиц, имеющих меньшую молекулярную массу.
- •Вопрос 47. Дегидратация.
- •Вопрос 49.
- •Вопрос 50. Особенности твердофазовых реакций:
- •Вопрос 51. Кинетика твердофазовых реакций
- •Вопрос 52. Факторы, влияющие на скорость твердофазовых реакций:
- •Вопрос 54. Жидкостное спекание.
- •Вопрос 55. Твердофазовое спекание. Осуществляется под действием температуры за счет переноса вещества в твердой фазе в отсутствие жидкости и без участия газовой фазы.
- •Вопрос 56. Кинетика твердофазового спекания.
- •Вопрос 57. Спекание за счет процесса “испарние — конденсация”
- •Вопрос 58. Первичная Рекристаллизация.
- •Вопрос 59. Вторичная рекристаллизация.
- •Вопрос 61. Кристаллизация.
- •Вопрос 62. Гомогенное образование центров кристаллизации
- •Вопрос 63. Гетерогенное образование центров кристаллизации.
- •Вопрос 66. Структура и классиф полимеров
- •Вопрос 67. Химическое строение макромолекул
- •Вопрос 68. Особенности линейных, разветвленных и сетчатых полимеров
- •Вопрос 69. Способы получения полимеров.
- •Вопрос 70. Карбоцепные полимеры
- •Вопрос 72. Старение и стабилизация полимеров.
- •Вопрос 73. Физическая Структура Полимеров.
- •Вопрос 74.Агрегатные и фазовые состояния полимеров
- •Вопрос 75. Аморфное состояние полимеров.
- •Вопрос 78. Химический состав древесины.
- •Вопрос 79. Под макроскопическим строением (макроструктурой) древесины понимают детали структуры, которые можно исследовать невооруженным глазом и с помощью лупы.
- •Вопрос 80. Анатомическое строение древесины
Вопрос 45. Система СаО—MgO — SiO2
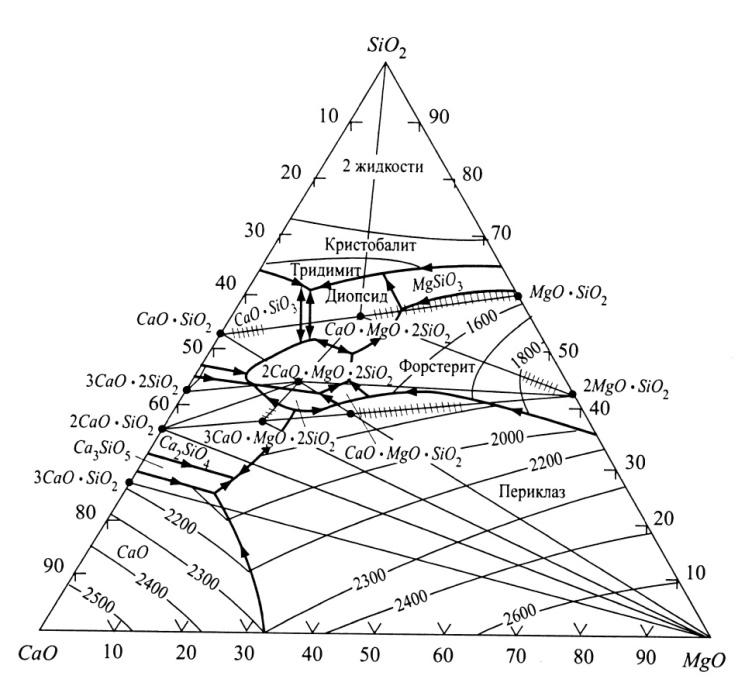
На рис. 73 приведена диаграмма состояния системы СаО — MgO—SiO2по Э. Осборну и А. Муану.
Монтичеллит CaO·-MgO·SiO2 является соединением, плавящимся инконгруэнтно при 1485°С с разложением на жидкость и периклазMgO. Имеет островную структуру оливинового типа, сходную со структуройγ-2CaO·SiO2и форстерита. Встречается в природе в виде минерала того же названия, из технических продуктов встречается в основных доменных и мартеновских шлаках, в составе связок магнезиальных огнеупоров.
Мервинит 3CaO·MgO·2SiO2— соединение, плавящееся инконгруэнтно при 1575°С, разлагаясь на жидкость, 2CaO·SiO2и, по некоторым данным,MgO. По структуре напоминаетα'-2CaO·αSiO2и оптически трудно отличим от него. Существовало даже предположение, что мервинит —одна из формα'-2CaO·αSiO2. Известен как природный минерал и встречается в некоторых технических продуктах в частности в различных шлаках, доломитовых огнеупорах и т. д.
Окерманит 2CaO·MgO·2SiO2— соединение, плавящееся конгруэнтно при 1454°С. При нормальном давлении и длительной выдержке в интервале температур 1200... 1350°С окерманит частично разлагается с появлением внутри его кристаллов зерен новых фаз (2CaO·SiO2, мервинита и др.). По другим данным, окерманит полностью стабилен, а его наблюдаемое разложение обусловлено присутствием примесей. Окерманит встречается в природе и в некоторых технических продуктах, в основном в доменных шлаках и некоторых шлаках цветной металлургии.
Диопсид CaO·MgO·2SiO2 плавится конгруэнтно при 1390°С. В природе распространен как минерал пироксеновой группы в виде твердых растворов сMgO·SiO2, играющих важную роль в конституции обычных силикатных породообразующих минералов — пироксенов.
Характерная особенность системы СаО—MgO— SiO2— образование между многими соединениями твердых растворов (на диаграмме они условно обозначены штрихами на соединительных линиях между точками составов соединений, образующих твердые растворы). В частности, монтичеллит образует широкую (но ограниченную) серию твердых растворов с форстеритом, а форстрит - твердые растворы с диопсидом. Ограниченные твердые растворы существуют между окерманитом, с одной стороны, и мервинитом, ранкинитом 3CaO·2SiO2, форстеритом и ортосиликатом кальция — с другой (в последнем случае растворимость, возможно, весьма незначительна). Диопсид образует твердые растворы с волластонитомCaO·SiO2. Не обнаружены твердые растворы между монтичеллитом и мервинитом, окерманитом и волластонитом, монтичеллитом и ортосиликатом кальция.
Система СаО—MgO— SiO2 имеет существенное значениедля многих технических силикатных продуктов: доломитовых огнеупоров, магнезиальных портландцементов, магнезиальных керамических масс, металлургических шлаков, стеклокристаллических материалов и т. д.
МОДУЛЬ 3
Вопрос 46. Диссоциация –химический процесс распада молекул, радикалов, ионов на несколько частиц, имеющих меньшую молекулярную массу.
Разновидность явления диссоциации, когда конденсированная фаза (твердая или жидкая) распадается с образованием газообразных продуктов и конденсированной фазы. Пример: разложениепри термообработке CaCO3,MgCO3,CaSO4,NaNO3и т.д. Диссоциация таких соединений относится кгетерогенным процессамтипа:aA=bB+dD, где:AиB– конденсированные (твердые, жидкие) вещества,D– газ.
Если газ будет отводиться от зоны реакции, то она пойдет слева-направо до конца без установления равновесия.
По закону действующих масс константа равновесия:
КР=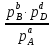 ,где p– парциальное
давление (упругость пара) веществ,
участвующих в реакции. Если конденсированные
фазы А и В имеют постоянный состав и не
образуют смешанных фаз друг с другом и
с газом, то для них
,где p– парциальное
давление (упругость пара) веществ,
участвующих в реакции. Если конденсированные
фазы А и В имеют постоянный состав и не
образуют смешанных фаз друг с другом и
с газом, то для них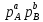 будут постоянными величинами, не сильно
зависящими от внешних факторов, кроме
того, их значения зачастую не велики
для твердых тугоплавких продуктов.
Следовательно,КР=
будут постоянными величинами, не сильно
зависящими от внешних факторов, кроме
того, их значения зачастую не велики
для твердых тугоплавких продуктов.
Следовательно,КР=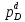 и константа равновесия при данной
температуре определяется только
парциальным давлением газообразного
продукта реакции. Это равновесное
давление называетсядавлением (или
упругостью) диссоциации. Его величина
зависит только от температуры для
данного чистого вещества с определенной
дисперсностью – она растет с ростом
температуры и для каждого значения
температуры
и константа равновесия при данной
температуре определяется только
парциальным давлением газообразного
продукта реакции. Это равновесное
давление называетсядавлением (или
упругостью) диссоциации. Его величина
зависит только от температуры для
данного чистого вещества с определенной
дисперсностью – она растет с ростом
температуры и для каждого значения
температуры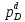 будет иметь свое значение. Большинство
процессов обжига в силикатных технологиях
протекает в печах, обустроенных дымососами
(открытая система), то процессы диссоциации
идут при атмосферном давлении 1 атм (0,1
МПа). Поэтомутемпературой диссоциации
(разложения)называется такая
температура, при которой парциальное
давление газообразного продукта
достигает величины 1 атм.
Само разложение при этом может
в той или иной степени происходить и
при более низкой температуре. Такой
процесс подобен поведению воды при
нагревании– ниже температуры кипения
идет испарение и его интенсивность
зависит от температуры и скорости отвода
паров от поверхности, температура
кипения соответствует 100°С, когда
парциальное давление станет равно 1
атмосфере, При этом процесс превращения
жидкой воды в пар наиболее интенсивно
идет именно при температуре диссоциации
(выкипание).
будет иметь свое значение. Большинство
процессов обжига в силикатных технологиях
протекает в печах, обустроенных дымососами
(открытая система), то процессы диссоциации
идут при атмосферном давлении 1 атм (0,1
МПа). Поэтомутемпературой диссоциации
(разложения)называется такая
температура, при которой парциальное
давление газообразного продукта
достигает величины 1 атм.
Само разложение при этом может
в той или иной степени происходить и
при более низкой температуре. Такой
процесс подобен поведению воды при
нагревании– ниже температуры кипения
идет испарение и его интенсивность
зависит от температуры и скорости отвода
паров от поверхности, температура
кипения соответствует 100°С, когда
парциальное давление станет равно 1
атмосфере, При этом процесс превращения
жидкой воды в пар наиболее интенсивно
идет именно при температуре диссоциации
(выкипание).
Температура диссоциации зависит от природы вещества, например для карбонатов щелочноземельных металлов повышается в ряду:
MgCO3(640°C)˂CaCO3(900°C)˂SrCO3(1100°C)˂BaCO3(1400°C)
Такая закономерность объясняется тем, что для диссоциации соединения необходимо, чтобы разрушился карбо-анион по схеме CO32-→CO2+O2-
На этот процесс влияет сила поля катиона, чем она выше, тем легче и при более низкой температуре протекает этот процесс. Катион Mg2+имеет наименьший радиус при том же заряде среди всех щелочноземельных карбонатов, поэтому его сила поля максимальна и он максимальным образом оттягивает на себя обобществленную электронную пару в связи с кислородом, поэтому для разрушения этой связи требуется меньше энергии извне (температура разложения минимальна в этом ряду).
Реальная температура разложения зависит:
От степени дисперсности вещества. С увеличением дисперсности упругость диссоциации повышается, а температура диссоциации падает. Это связано с тем, что по мере уменьшения размера частиц растет отношение площади поверхности зерна к его массе. Особенно этот эффект проявляется для очень тонко помолотых порошков, а для мелко кускового материала он практически незаметен. Скорость разложения вещества особенно сильно зависит от его дисперсности при температурах ниже температуры диссоциации, если температура выше этого значения, то размер зерен не является определяющим фактором. Наглядным примером может служить то, что мелкокристаллический мел разлагается при 895°C, а крупнокристаллический мрамороподобный известняк – при 920°C.
От степени дефектности кристаллической решетки вещества.
Реальная температура разложения и скорость диссоциации зависит от наличия примесей. Вступая в химическое взаимодействие в твердом состоянии с основным материалом или образуя с ним твердые растворы, примеси могут существенно понижать температуру диссоциации и интенсифицировать процесс разложения. Например, примеси кремнезема и глинозема понижают температуру диссоциацииCaCO3. Или температура разложения чистого доломитаCaMg(CO3)2составляет 700°C, а в присутствии небольшой добавкиNaClона может снизиться до 500°C
Механизм диссоциациирассмотримна примере разложения кальцита CaCO3.
При подводе к системе тепла процесс начинается с распада в решетке кальцита карбонатного аниона CaCO3→Cа2++CO2+O2-
Ионы O2-диффундируют в решетке кальцита из объема к поверхности зерна очень медленно и в ней они накапливаются. При этом анионы кислорода реагируют сCа2+с образованием СаО, но он в этот момент не представляет собой самостоятельной фазы, а образует твердый раствор сCaCO3. По мере развития процесса в этом твердом растворе увеличивается концентрация СаО, и со временем достигается пересыщение раствора, что приводит к массовому образованию и росту зародышей новой фазы СаО.
Как только возникла новая фаза СаО, так и образовалась граница раздела фаз СаО- CaCO3, и это приводит к интенсификации диссоциации, поскольку распадCO32-на границе идет намного легче.
Молекулы СО2вначале адсорбируются твердой фазой, образуя комплексы СаСО3(тв)·СО2(г)
После достижения предельной концентрации адсорбции происходит обратный процесс десорбции молекул углекислого газа. Эти молекулы диффундируют к поверхности зерен и удаляются в атмосферу.
Кинетика процессадиссоциации кальцита вначале определяется скоростью образования зародышей новой фазы СаО, а затем скоростью диффузии Cа2+и O2-к зародышу, что обеспечит рост кристалла новой фазы.
Процессы диссоциации для большинства значимых в наших технологиях карбонатов, сульфатов и других солей такого типа эти процессы эндотермические(с поглощением тепла), то есть для их осуществления к системе нужно подводить тепловую энергию (обжигать).При этом значения теплоты диссоциации достигают больших величин.
Энергия активации процесса диссоциациитакже довольно велика.
