
- •Вопрос 4. Структурная классификация полиморфизма
- •Вопрос 6. Твердые растворы
- •Вопрос 9. Признаком краевой дислокации является наличие в одной части кристалла лишней («оборванной» или «недостроенной») атомной плоскости, не имеющей продолжения в другой части кристалла.
- •Вопрос 11. Свойства дислокаций:
- •Вопрос 12. Гипотезы строения жидкостей .
- •Вопрос 14. Фх особенности стеклообразного сост-я:
- •Вопрос 15. Процесс стеклообразования определяется следующими факторами:
- •Вопрос 16.
- •Вопрос 17. Устойчивость и коагуляция коллоидных силикатных систем
- •Вопрос 18. Структуры, образующиеся в высокодисперсных системах, п. А. Ребиндер предложил классифицировать:
- •Вопрос 22. Общий вид диаграммы состояния однокомпонентной системы
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25. Двухкомпонентные диаграммы состояния
- •Вопрос 26. Диаграмма состояния двухкомпонентной системы с химическим соединением, плавящимся без разложения (конгруэнтно).
- •Вопрос 27.
- •Вопрос 28. Диаграмма состояния двухкомпонентной системы с непрерывным рядом твердых растворов.
- •Вопрос 29. Динамический и статический методы построения диаграмм состояния.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32. Система MgO—SiO2
- •Вопрос 33. Система а12o3— SiO2
- •Вопрос 34. Трехкомпонентные диаграммы состояния
- •Вопрос 36. Диагр.Сост. Трехкомп.Сист. С эвтектикой.
- •Вопрос 37.
- •Вопрос 39.
- •Вопрос 40. Диаграмма состояния трехкомпонентной системы с тройным химическим соединением, плавящимся конгруэнтно, полиморфными превращениями и ликвацией.
- •Вопрос 42. Система Na2o-CaO-SiO2
- •Вопрос 43. Система CaO-Al2o3-SiO2
- •Вопрос 44. Система MgO- Al2o3- SiO2
- •Вопрос 45. Система СаО—MgO — SiO2
- •Вопрос 46. Диссоциация –химический процесс распада молекул, радикалов, ионов на несколько частиц, имеющих меньшую молекулярную массу.
- •Вопрос 47. Дегидратация.
- •Вопрос 49.
- •Вопрос 50. Особенности твердофазовых реакций:
- •Вопрос 51. Кинетика твердофазовых реакций
- •Вопрос 52. Факторы, влияющие на скорость твердофазовых реакций:
- •Вопрос 54. Жидкостное спекание.
- •Вопрос 55. Твердофазовое спекание. Осуществляется под действием температуры за счет переноса вещества в твердой фазе в отсутствие жидкости и без участия газовой фазы.
- •Вопрос 56. Кинетика твердофазового спекания.
- •Вопрос 57. Спекание за счет процесса “испарние — конденсация”
- •Вопрос 58. Первичная Рекристаллизация.
- •Вопрос 59. Вторичная рекристаллизация.
- •Вопрос 61. Кристаллизация.
- •Вопрос 62. Гомогенное образование центров кристаллизации
- •Вопрос 63. Гетерогенное образование центров кристаллизации.
- •Вопрос 66. Структура и классиф полимеров
- •Вопрос 67. Химическое строение макромолекул
- •Вопрос 68. Особенности линейных, разветвленных и сетчатых полимеров
- •Вопрос 69. Способы получения полимеров.
- •Вопрос 70. Карбоцепные полимеры
- •Вопрос 72. Старение и стабилизация полимеров.
- •Вопрос 73. Физическая Структура Полимеров.
- •Вопрос 74.Агрегатные и фазовые состояния полимеров
- •Вопрос 75. Аморфное состояние полимеров.
- •Вопрос 78. Химический состав древесины.
- •Вопрос 79. Под макроскопическим строением (макроструктурой) древесины понимают детали структуры, которые можно исследовать невооруженным глазом и с помощью лупы.
- •Вопрос 80. Анатомическое строение древесины
Вопрос 59. Вторичная рекристаллизация.
Вторичная рекристаллизация- происходящий при нагревании твердого тела процесс роста небольшого числа крупных кристаллов за счет более тонкозернистой массы. Следствиемвторичной рекристаллизации является сильное изменение микроструктуры кристаллического тела (изменение размеров и числа составляющих его кристаллов).Конечным итогомявляется твердое тело, состоящее из небольшого числа крупных кристаллов. Этот вид рекристаллизации не связан с необходимостью предварительной деформации твердого тела. Он протекает при участии кристаллов как с деформированной, так и с недеформированной решеткой. Движущей силой процесса является стремление системы к уменьшению внутренней энергии, которое в данном случае достигается не за счет снятия внутренних напряжений, а за счет уменьшения поверхностной энергии, поскольку превращение мелких кристаллов в крупные приводит к уменьшению суммарной поверхности зерен. Рост одних зерен за счет других происходит благодаряперемещению имеющих определенную кривизну межзеренных границ. Это перемещение обусловлено силами поверхностного натяжения, а энергия для этого процесса черпается из избыточной межфазной поверхностной энергии. Скорость (I) перемещения границ между зернами в основном определяется двумя факторами: величиной межфазной поверхностной энергии (σ) и степенью кривизны поверхности между соприкасающимися зернами, характеризуемой радиусом кривизныr:
I=m·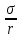 ,
,
где m- коэффициент, характеризующий подвижность частиц.
Следовательно, скорость перемещения межфазной границы будет возрастать с увеличением кривизны поверхности.
Механизм роста зерен при вторичной рекристаллизации, обусловленного перемещением межзеренных границ, заключается в переносе вещества через границу соприкосновения зерен, который происходит путем перехода (перескока) атомов или ионов через межзеренную границу. Рассмотрим, в каком направлении происходит этот переход в соответствии со схемой, предложеннойД. Бурке.

Атомы в поликристалическом теле движутся не только внутри отдельных зерен, но и перемещаются через их границы. В случае плоской границы эти перемещения сбалансированы, т.е. число атомов, движущихся (диффундирующих) в обоих направлениях, одинаково. Если же граница между зернами искривлена (рис. 71), то каждый атом, находящийся на вогнутой поверхности, будет иметь большее число соседних атомов и, следовательно, меньшую энергию, чем в том случае, когда он располагается на выпуклой поверхности. В связи с этим перемещение атомов в обоих направлениях через границу соприкосновения зерен окажется неодинаковым: перемещение атомов будет происходить преимущественно с выпуклой поверхности на вогнутую, а следовательно, граница между зернами будет перемещаться в противоположном направлении. Кривизна поверхности зерен в реальных порошках зависит от числа их сторон (граней): чем зерно крупнее, тем больше кривизна поверхности каждой стороны и, следовательно, больше скорость его роста.
Можно показать, что для кристаллов, имеющих более шести сторон, их границы (грани) будут вогнуты внутрь кристалла(кристалл 1), а для кристаллов, имеющих меньше шести сторон, — выгнуты во внешнюю сторону (кристаллы 2—12 ):
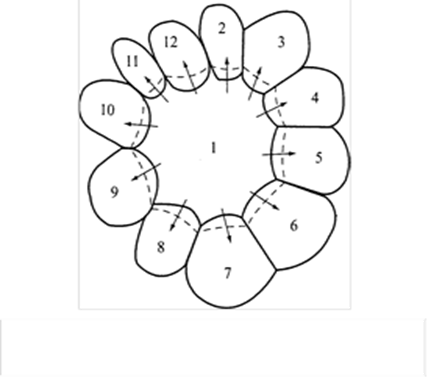
Кристаллы, имеющие более шести сторон, будут расти, а менее шести — уменьшаться в размерах (крупные кристаллы как бы «поедают» мелкие).
Кинетика процесса: Поскольку радиус кривизны пропорционален диаметру зерен, для данной температуры справедливо выражение.
![]()
Из которого выводится зависимость роста зерен от времени рекристаллизации:
![]()
где τ — время рекристаллизации; D0 — диаметр зерна до начала роста;D — диаметр зерна, выросшего за время τ;k— коэффициент пропорциональности.
Процесс зависит от таких факторов, как температура, время, размер исходных зерен, наличие в материале примесей и др. При прочих равных условиях степень вторичной рекристаллизации пропорциональна температуре и времени рекристаллизации, причем температурная зависимость имеет такой же вид, как для скорости роста кристаллов при первичной рекристаллизации.
Скорость вторичной рекристаллизацииувеличивается с уменьшением размера исходных зерен. В грубозернистых материалах будет наблюдаться меньший относительный рост зерен, чем в тонкозернистых материалах. Это связано с тем, что в тонкоизмельченных смесях всегда имеется небольшое число частиц, размер которых(Dмакс) значительно больше, чем средний размер частиц (Dср). Эти частицы действуют как зародыши вторичной рекристаллизации, так как в подобной системе выполняется условиеDмакс>>Dср . В грубозернистых массах вероятность присутствия частиц, у которыхDмакс>>Dсргораздо меньше.
Теоретически данное зерно должно расти до тех пор, пока его размеры не станут равными размеру образца, т.е. пока не образуется один монокристалл. Практически этого не происходит, хотя наблюдаются случаи увеличения размеров зерен в несколько сот раз.
Вопрос 60. Плавление - происходящий при нагревании фазовый переход вещества из твердого состояния в жидкое. Жидкая фаза является той средой, в которой происходят многие важные для синтеза силикатов процессы, например реакции образования химических соединений, растворение твердых фаз, кристаллизация различных минералов. Например, в керамикепри производстве фарфора, содержащего до 50об. % полевошпатового стекла, одной из важнейших стадий является процесс растворения кварца и продуктов разложения каолина в полевошпатовом расплаве и кристаллизация из последнего муллита.
При обжиге портландцементного клинкера образование основного минерала портландцемента алита 3СаО·Si02 происходит со значительной скоростью только путем растворения ранее образовавшихся кристаллов2СаО •SiO2 иСаО в жидкой фазе, их взаимодействия в расплаве и кристаллизации из него образовавшегося алита.
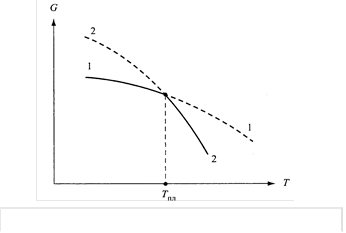
Изменение энергии Гиббса в процессе плавления: 1—1 — твердая фаза; 2—2 —жидкая фаза; Tпл — температура плавления
При равновесии между двумя состояниями энергия Гиббса (G) единицы массы вещества в обоих состояниях должна быть одинаковой, т.е. при плавлении условием равновесия является равенствоG(тв)=G(ж). При температуре плавления кривые энергии Гиббса твердой кристаллической и жидкой фаз пересекаются. Точка их пересечения соответствует температуре плавления, ниже которой устойчивым является твердое, а выше — жидкое состояние.Переход из твердого состояния в жидкое представляет собой фазовый переход первого рода, обусловленный скачкообразным изменением внутреннего строения вещества и связанным с ним изменением его физико-химических свойств.
Со структурной точки зрения процесс плавления представляет собой разупорядочение структуры — утрату решеткой кристалла дальнего порядка в расположении атомов или ионов при возможном сохраненииближнего порядка. Этот фазовый переход связан с предварительной структурной подготовкой —предплавлением, представляющим собой процесс усиленного разупорядочения, т.е. переход в жидкое структурно менее упорядоченное состояние небольших объемов кристалла, особенно вблизи межкристаллитных границ.
С повышением температуры возрастает амплитуда колебания структурных частиц(атомов, ионов, молекул) около регулярного положения равновесия в узлах решетки. Когда величина амплитуды превысит среднее межатомное расстояние, происходит ослабление и разрыв связей, после чего частица покидает узел решетки, образуя там вакансию. Накопление вакансий, концентрация которых вблизи температуры плавления может достигать 1—2 маc. %, вызывает перераспределение сил химической связи между частицами, а флуктуационное слияние вакансий — образование поверхностей разрыва, отделяющих друг от друга отдельные атомные группировки — микроблоки. Все это приводит к тому, что в расплав начинают переходить не отдельные атомы или ионы, а их группировки, т.е. происходит процесс, называемыйкооперативным позиционным разупорядочением. Этот процесс при температуре плавления охватывает постепенно весь объем кристалла — происходит превращение твердого тела в жидкое.
Вблизи температуры плавления тепловые колебания частиц существенно не возрастают, поскольку подводимое тепло затрачиваетсяна разрыв межатомных связейи разрушение дальнего порядка. Поэтому в твердом веществе вблизи температуры плавления наблюдается незначительное нарушение координации отдельных атомов кристаллической решетки, причем эти нарушения скачкообразно возрастают в точке плавления. При этом, однако, среднее расстояние между структурными единицами в субмикроскопических областях твердой и жидкой фаз мало отличаются друг от друга, т.е. сохраняется ближний порядок. Остатки полностью упорядоченного строения, характерного для кристаллов,могут исчезать только при значительном перегреве расплававыше температуры плавления и длительной выдержке при высоких температурах. Важной характеристикой кристаллических веществ являетсятемпература плавления, определяющая их тугоплавкость. Условием высокой температуры плавления (Tпл) является соотношениеTпл = НПЛ/SПЛ, гдеНПЛ иSПЛсоответственноэнтальпия иэнтропия плавления. Большая величина энтальпии
и низкая энтропия плавления обусловливают особенно большую тугоплавкость веществ. Высокое значение НПЛреализуется при большой энергии связей структурных единиц в решетке, а низкое значениеSnjl — когда имеет место простой механизм плавления.
Поскольку плавление соответствует температуре, при которой тепловое движение способно преодолеть взаимное притяжение структурных единиц, устойчивость кристалла к тепловым воздействиям является, прежде всего, функцией энергии связи и, следовательно, энергии кристаллической решетки. Тип решетки(кубическая или гексогональная) влияет на температуру плав: , гексагональныйВеО, имеющий большую, чем кубическийMgO, энергию решетки, плавится при более низкой температуре. ). Минералы с молекулярными решетками, молекулы в которых удерживаются слабыми остаточными ван-дер-ваальсовыми силами, имеют наиболее низкие температуры плавления.
Если в ков-ионной связи преоблад. ков. св., то Тпл уменьшается. Увеличение межионного расстояния при сохранении типа структуры и величины заряда иона приводит к снижению температуры плавления(для ков. крист. тоже).
Температура плавления растет с увеличением координационного числа атомов или ионов, компенсируя увеличение межатомного расстояния. Очень сильно температура плавления зависит от величины заряда (валентности) ионов, увеличиваясь существенно с возрастанием последнего.
Плавление является эндотермическим процессом, т.е. сопровождается поглощением теплоты, называемойскрытой теплотой плавления и представляющей собой количество тепла, которое необходимо сообщить веществу, нагретому до температуры плавления, чтобы полностью его расплавить.
Из внешних факторов на температуру плавления влияют внешнее давление, присутствие в веществе примесей и для мелкодисперсных порошков — степень их дисперсности.
Связь между температурой плавления(Тпл), давлением (Р), теплотой
плавления(Q)
и изменением объема (ΔV)
при плавлении выражается, как и для
других фазовых переходов,уравнением
Клаузиуса — Клапейрона
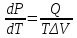
При плавлении межатомные расстояния увеличиваются (обычно на 2...6%), плотность уменьшается и удельный объем, соответственно, возрастает.
увеличение давления приводит к повышению температуры плавления.
Примеси посторонних веществ снижают температуру плавления.
Аморфные вещества не имеют определенной температуры плавления и переходят в жидкое состояние постепенно. Для таких тел характерен интервал размягчения, составляющий, например, для обычных стекол от 500 до 1000°С.
