
- •Методи контролю якості харчової продукції лабораторний практикум
- •Передмова
- •Загальні правила роботи в лабораторії технології
- •Підготовка до виконання лабораторних робіт, їх проведення та оформлення результатів
- •1 Методи контролю м’ясної продукції Лабораторна робота1.1. Методи контролю якості ковбаси вареної»
- •Метод визначення вмісту крохмалю ( витяг з гост 10574-91)
- •1.Підготовка проб для аналізу (гост 9792-73)
- •2. Проведення аналізу
- •Лабораторна робота 1.2. Методи контролю ковбаси в/к
- •Метод визначення вмісту вологи (експрес метод гост 9793-74)
- •1. Підготовка проб для аналізу(гост 9792-73)
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 1.3. Методи контролю виробів з цілісною м’язовою структурою сиро-копчених Метод визначення вмісту солі повареної (NaCl) за методом Мора (гост 9957-73)
- •1. Підготовка пробдля аналізу (гост 9792-73)
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 1.4. Методи контролю м'ясаяловичини в напівтушах та четвертинах Метод визначення свіжості м'яса (гост 7269-79)
- •1. Підготовка пробдля аналізу (гост 9792-73)
- •2. Проведення аналізу
- •2 Методи контролю молочної продукції Лабораторна робота 2.1. Методи контролю сиру кисломолочного
- •Метод визначення вмісту вологи (експрес метод гост 9793-74)
- •1. Підготовка проб для аналізу(дсту 4554:2006)
- •3. Обробка результатів
- •Лабораторна робота 2.2.Методи контролю сметани
- •Метод визначення вмісту жиру (Кислотний метод гост 5867-90)
- •1. Підготовка проб для аналізу(дсту 4418:2005)
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 2.3. Методи контролю молока питного
- •Метод визначення вмісту білку та загального азоту (за Кьельдалем гост 23327-98)
- •1. Підготовка проб для аналізу(гост 3622)
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 2.4. Методи контролю сирків сирних глазурованих
- •Метод визначення сахарози (йодометричний метод)
- •1. Підготовка проб для аналізу (гост 3622)
- •2. Проведення аналізу
- •3.Обробка результатів
- •3Методи контролю рибної продукції Лабораторна робота 3.1. Методи контролю консервіврибних
- •Метод визначення вмісту складових частин (гост 26664-85)
- •1. Підготовка проб для аналізу(гост 8756.0-70)
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 3.2. Методи контролю рибисолоної
- •Метод визначення вмісту солі повареної (NaCl) за методом Мора
- •1. Підготовка проб для аналізу(гост 9792-73)
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 3.3. Методи контролю риби пряного посолу
- •Метод визначення загальної кислотності
- •1. Підготовка проб для аналізу(гост 7631-85)
- •2. Проведення аналізу
- •3.Обробка результатів
- •4. Методи контролю овочевої продукції Лабораторна робота 4.1. Методи контролю огірків маринованих Метод визначення хлоридів (аргенометричний метод за Мором)
- •1. Підготовка проби для аналізу
- •2.Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 4.2. Методи контролю капусти квашеної Метод визначення титрованих кислот
- •1. Підготовка проби для аналізу
- •2.Проведення аназізу
- •3. Обробка результатів
- •Лабораторна робота 4.3. Методи контролю заправки борщової Метод визначення масової частки складових частин
- •1. Підготовка проби для аналізу
- •2.Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 4.4. Методи контролю повидла Метод визначення масової частки розчинних сухих речовин
- •1. Підготовка проби для аналізу
- •2.Проведення аналізу
- •3. Обробка результатів
- •5 Методи контролю хлібобулочних виробів Лабораторна робота 5.1. Методи контролю хлібобулочнихвиробів Метод визначення вологи хлібобулочних виробів (згідно з гост 21094-75)
- •1.Підготовка проби для аналізу
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 5.2. Арбітражний метод визначеннякислотностіхлібобулочнихвиробів (згідно з гост 5670-96)
- •1. Підготовка проби для аналізу
- •2. Проведення аналізу
- •3. Обробка результатів
- •Метод визначення пористості хлібобулочних виробів (згідно з гост 5669-96)
- •1. Підготовка проби для аналізу
- •2. Проведення аналізу
- •3. Обробка результатів
- •Лабораторна робота 5.3. Методи контролю якості пшеничного борошна Метод визначення кількості клейковини пшеничного борошна (згідно з гост 27839-88)
- •1. Підготовка проби для аналізу
- •2. Проведення аналізу
- •3. Обробка результатів
- •6Методи контролю кондитерської продукції
- •Лабораторна робота 6.1. Методи контролю мармеладних і пастильнихвиробів
- •Методи визначення масової частки сухих речовин
- •За допомогою рефрактометра
- •1. Підготовка проби для аналізу
- •2. Проведення аналізу
- •3. Обробка результатів
- •Визначення активної кислотності потенціометричним методом
- •1. Підготовка приладу для аналізу
- •2. Підготовка проби для аналізу
- •3. Проведення аналізу
- •Лабораторна робота 6.2. Методи контролю борошнянихкондитерськихвиробів
- •Феріцианідний метод визначення цукрів
- •1. Підготовка до аналізу
- •2. Проведення аналізу
- •Метод визначення намокаємості
- •1. Підготовка проби для аналізу
- •2. Проведення аналізу
- •3. Обробка результатів
- •Перелік рекомендованої літератури Додаток а Приготування розчинів
- •Додаток б Основний хімічний посуд та його призначення
- •Навчальне видання
- •Лабораторний практикум
Метод визначення намокаємості
Мета роботи. Визначити намокаємість печива, пряників.
Реактиви й матеріали:
трьохсекційна камера з металевої сітки розміром 93×80×60;
ємність для води діаметром 140 та висотою 150 C. 50 мл А + 1 мл В (придатний протягом одного дня);
ваги лабораторні;
термометр скляний;
годинник;
секундомір.
Методика проведення роботи
1. Підготовка проби для аналізу
Камеру занурюють у воду, виймають, витирають фільтрувальним папером із зовнішньої сторони та зважують. До кожної секції камери закладають печиво та зважують камеру з виробами.
2. Проведення аналізу
Камеру опускають до ємності з водою, що має температуру 200 С на 2 хв (для печива цукрового здобного або затяжного) та на 4 хв (для галет або крекеру). Камеру виймають з води та витримують 30 с в похилому стані. Потім камеру витирають із зовнішньої сторони та зважують разом із виробами, що досі знаходяться в камері. Відношення маси набряклого виробу до маси сухого характеризує ступінь його намокаємості.
3. Обробка результатів
Намокаємість Х,%, обчислюють за виразом:
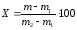 , (6.10)
, (6.10)
де m − маса камери з набряклим виробом, г;
m1 − маса пустої камери (після занурення у воду та витирання ззовні), г;
m2 − маса камери з сухим виробом.
Всі зважування проводять з похибкою не більш, ніж 0,01 г.
Результатвизначенняобчислюютьзточністюдопершогодесятковогознакуіокругляютьдоцілого. Заостаточнийрезультатвипробуванняприймаютьсереднєарифметичнетрьохпаралельнихвизначень,допустимірозбіжностіміжякими не повинніперевищуватиза абсолютноювеличиною5%.
За результатами досліджень борошняних кондитерських виробів необхідно зробити висновки щодо відповідності показників (табл. 6.5).
Таблиця 6.5. – Порівняльна характеристика одержаних результатів аналізу та нормативних показників кондитерських виробів
|
Найменування показників, що контролюються |
Нормативні данні |
Результати аналізу |
|
Намокаємість, %:
|
110…150 |
|
|
Масова частка редукуючих речовин, %:
|
20,0…40,0 10,0…25,0 |
|
Висновки: ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Перелік рекомендованої літератури Додаток а Приготування розчинів
У лабораторних роботах концентрація розчинів може бути виражена у відсотках, або в одиницях молярності і нормальності, або у одиницях густини.
Приготування водних розчинів твердих речовин заданої концентрації у відсотках.
а) Приготування розчинів твердих речовин, що не містять кристалізаційної води.
Розрахунки в цьому випадку носять чисто арифметичний характер.
Приклад.
Приготувати 250 г 10 %-го розчину будь-якої речовини (хлориду натрію, цукру, хлориду калію, тощо).
Знаходимо 10 % від 250 г (250•0,1), що дорівнює 25 г. Отже, речовини треба узяти 25 г, а води 225 г. Зміни об’єму води від зміни температури при цьому не враховують.
б) Приготування розчину кристалогідрату.
В цьому випадку спочатку потрібно зробити перерахунок маси безводної солі на масу відповідної кількості кристалогідрату.
Приклад.
Приготувати 100 г 10 %-го розчину сульфату міді з мідного купоросу.
Розрахунок: сульфату міді треба узяти 100•0,1 = 10 г;
МCuSO4•5Н2О = 250; 1 моль = 250 г; МCuSO4 = 160.
Складаємо пропорцію і вирішуємо її:
250:160=х:10, х = (250х10):160=15,625 (г).
Обчислення показує: щоб мати 10 г безводного сульфату міді, потрібно відважити 15,625 г (закруглено - 15,6 г) мідного купоросу.
Далі всю операцію проводять так само, як і в попередніх випадках.
Приготування водних розчинів рідин.
Найчастіше це роблять під час приготування розчинів кислот. При цьому майже завжди готують розчин заданої концентрації з іншого розчину.
Приклад.
Приготувати 250 г 10 %-го розчину сірчаної кислоти з більш концентрованого розчину.
Для цього за допомогою ареометру визначають густину кислоти.
Припустимо, що вона дорівнює 1,824.
Продовження додатку А
Знаходимо за таблицею (додаток) концентрацію кислоти. Вона дорівнює 92 %. Отже, для приготування 250 г 10 %-го розчину чистої (100 %) сірчаної кислоти треба узяти 25 г, а 92 %-ої — більше
(25 • 100) : 92 = 27,2 (г)
Відважувати рідини незручно, тому слід перевести вагові одиниці в об’ємні: 27,2: 1,824== 14,8 мл.
Відмірити 14,8 мл розчину кислоти і вилити його у 222,8 мл (250 - 27,2) води. Розчин готовий. Перевірку слід проводити шляхом вимірювання густини розчину кислоти, яка у даному випадку повинна дорівнювати 1,066.
Приготування розчинів заданої нормальної концентрації.
В деяких випадках зручніше готувати розчини заданої нормальної концентрації.
Приклад.
Потрібно приготувати 100 мл 0,1 н. розчину хлориду барію, формула якого BaCl2•2Н2О. Вирахуємо, що молекулярна маса кристалогідрату хлориду барію становить 244, еквівалент його складає 244 : 2 = 122.
Розчин готують 0,1 н., тобто на 1 л розчину необхідно узяти 12,2 г солі, а на 100 мл — 1,22 г.
Приготування розчинів заданої концентрації за їх густиною.
Значно простіше приготувати розчин за густиною, для цього знаходять густину розчину заданої концентрації. Рідину наливають у високий циліндр, в який після цього опускають ареометр. Якщо потрібно одержати більш розбавлений розчин, то до нього підливають воду. (Якщо дана сірчана кислота, то додають кислоту у воду.)
![]()
Рис. А.1 – Ареометр
Ареометри можуть бути призначені для рідин з густиною вище за одиницю, або для рідин, що мають густину нижче за одиницю. Є ареометри, придатні для вимірювання густини розчину у досить обмежених інтервалах (від 1 до 1,6, від 1,06 до 1,12 і т. д.). Існують і спеціально градуйовані ареометри для вимірювання сірчаної кислоти, спирту, молока і т. ін.
Для прозорих рідин покази ареометра відзначають за нижнім краєм меніска (рис. А 1).
Під час приготування розчинів потрібно дотримуватися наступних правил:
1. Посуд, в якій готують розчин, треба заздалегідь ретельно вимити і обполоснути дистильованою водою.
2. Всі реактиви треба готувати на дистильованій воді.
3. Починати приготування розчинів слід з проведення необхідних розрахунків.
4. Концентровані розчини лугів краще готувати у порцеляновому посуді.
5. Концентрацію розчинів рекомендується перевіряти за їх густиною ареометром.
6. Після приготування розчину його треба закупорити пробкою і на посуд наклеїти етикетку.
7. Під час вибору матеріалу посуду і пробки треба враховувати властивості розчинів, що зберігаються, підбираючи скло відповідного кольору і відповідний матеріал пробки.
Приготування реактивів спеціального призначення
Приготування розчинів індикаторів.
Фенолфталєїн - синтетична фарба, яка змінює свій колір залежно від реакції середовища, залишаючись безбарвною в кислому та у нейтральному середовищі, вона приймає малинове забарвлення у лужному. Пояснюється це тим, що за дії лугів виходить сіль, що має в своєму складі хіноїдне угруповання.
Для виготовлення реактиву беруть 1 гфенолфталєїну, розчиняють його у 1000 мл суміші, що складається з 600 мл етилового спирту та 400 мл води.
Реактив Фелінга. Складається з розчинів А і Б. Розчин А: 3,5 г СuSO4·5H2Oрозчиняють у 50 мл води. Розчин Б: 17, 3 гсегнетової солі і 6 г гідроксиду натрію розчиняють у 50 мл води. Розчини А І Б зберігають окремо. Перед використанням розчини А і Б перемішують рівних об’ємах.
