
- •Тема 1. Фізичні основи механіки. Кінематика Лекція 1. Основи кінематики поступального та обертального рухів Основні визначення
- •Швидкість і прискорення
- •Кінематика обертального руху
- •Лекція 2. Основи динаміки матеріальної точки та абсолютно твердого тіла Перший закон Ньютона.
- •Сила. Маса. Другий закон Ньютона.
- •Третій закон Ньютона.
- •Сили тертя
- •Сили пружності. Закон Гука.
- •Імпульс. Закон збереження імпульсу
- •Реактивний рух
- •Момент імпульсу. Закон збереження моменту імпульсу
- •Обертальний рух матеріальної точки відносно нерухомої осі
- •Теорема Штейнера (Гюйгенса)
- •Лекція 3. Робота. Енергія. Потужність
- •Робота при обертальному русі.
- •Закони збереження енергії в механіці
- •Потужність
- •Електростатичне поле та його характеристики
- •1. Електричний заряд. Закон збереження електричного заряду замкненої системи
- •2. Закон Кулона
- •3. Електростатичне поле та його напруженість. Лінії напруженості поля
- •4. Робота сил електростатичного поля по переміщенню точкового заряду
- •5. Потенціал електростатичного поля
- •6. Різниця потенціалів. Принцип суперпозиції електростатичних полів
- •7. Еквіпотенциальні поверхні
- •Лекція 05 Теорема Остроградського-Гаусса
- •Теорема Остроградського-Гауса для електростатичного поля у вакуумі
- •1. Поле рівномірно зарядженої нескінченної площини
- •2. Поле рівномірно зарядженої сферичної поверхні
- •3. Поле об'ємно зарядженої кулі
- •4. Поле рівномірно зарядженого нескінченного циліндра (нитки)
- •2. Поляризація діелектриків. Вектор поляризації
- •3. Лінії електричного зміщення і потік електричного зміщення.
- •Потік електричного зміщення для замкненої поверхні
- •4. Теорема Остроградського-Гаусса для електростатичного поля в діелектриці
- •5. Сегнетоелектрики, їх властивості та використання
- •Провідники в електричному полі
- •Електростатична індукція
- •Електрична ємність відокремленого (самотнього) провідника
- •Конденсатори, їх типи та ємність
- •Лекція 08 Постійний електричний струм
- •1. Електричний струм та його характеристики (сила, густина струму).
- •Умови існування електричного струму
- •Сторонні сили. Електрорушійна сила і напруга
- •Закон Ома
- •Опір і провідність провідників
- •Робота та потужність електричного струму
- •Правила Кірхгофа для розгалужених кіл
- •Під час розрахунку складних кіл із застосуванням правил Кірхгофа необхідно:
- •Лекція 09. Магнітне поле постійного струму Загальний опис магнітного поля
- •2. Потік вектора магнітної індукції. Теорема Остроградського-Гаусса для поля в
- •Магнітний потік крізь довільну поверхню s
- •3. Закон Біо-Савара-Лапласа та приклади його застосування (визначення індукції магнітного поля прямолінійного провідника зі струмом і магнітне поле в центрі кругового струму)
- •4. Теорема про циркуляцію векторів магнітної індукції та напруженості магнітного поля
- •Дія магнітного поля на рухомі заряди
- •1. Магнітне поле рухомого заряду
- •2. Дія магнітного поля на рухомий заряд. Сила Лоренца
- •3. Рух зарядженої частинки в магнітному полі
- •4. Формула Ампера
- •Робота по переміщенню контуру із струмом. Робота dА сил Ампера при даному переміщенні контуру (рис. 10.7) дорівнює сумі робіт по переміщенню провідників авс (dА1) і cda (dА2), тобто
- •Магнітне поле в речовині
- •1. Магнітний момент електрона і атома
- •2. Типи магнетиків
- •Намагніченість. Магнітне поле в речовині Намагніченість – це фізична величина, яка визначається магнітним моментом одиниці об'єму магнетика:
- •Феромагнетики та їх властивості Феромагнетики
- •1. Явище електромагнітної індукції. Закон Фарадея. Правило Ленца Досліди Фарадея і наслідки з них.
- •Індуктивність нескінченно довгого соленоїда. Соленоїд – це згорнутий в спіраль ізольований провідник, по якому протікає електричний струм. Повний магнітний потік соленоїда (потокозчеплення)
- •4. Енергія та об'ємна густина енергії магнітного поля
- •1. Коливання та їх типи
- •2. Механічні вільні гармонічні коливання, їх диференціальне рівняння та розв'язок
- •3. Енергія гармонічних коливань
- •Кінетична енергія
- •4. Електричний коливальний контур. Диференціальне рівняння власних електричних коливань та його розв'язок
- •Додавання гармонічних коливань
- •1. Метод векторних діаграм
- •2. Додавання гармонічних коливань одного напрямку
- •3. Биття
- •4. Додавання взаємно перпендикулярних гармонічних коливань. Поняття про фігури Ліссажу
- •Згасаючі коливання
- •1. Згасаючі механічні коливання
- •Енергія гармонічних коливань
- •Вимушені коливання
- •3. Вимушені електромагнітні коливання, диференціальне рівняння і його розв'язок і характеристики
- •4. Електричний резонанс і його використання в техніці
- •Резонанс напруг – це явище різкого зростання амплітуди сили струму в контурі при збігу циклічної частоти зовнішньої змінної напруги з власною частотою 0 коливального контура.
- •Пружні хвилі
- •1. Хвильовий процес. Види хвиль. Хвильова поверхня, фронт хвилі. Промінь
- •2. Гармонічна хвиля та її характеристики
- •3. Принцип Гюйгенса
- •4. Рівняння плоскої та сферичної хвиль
- •4. Хвильове рівняння пружної хвилі
- •Рівняння Максвелла
- •1. Аналіз явища електромагнітної індукції. Вихрове електричне поле. Циркуляція вектора напруженості вихрового електричного поля
- •2. Струм зміщення. Закон повного струму. Друге рівняння Максвелла
- •3. Система рівнянь Максвелла для електромагнітного поля в інтегральній формі. Електромагнітне поле
- •4. Вихрові струми (струми Фуко). Скін-ефект
- •2. Диференціальне рівняння електромагнітної хвилі та його дослідження
- •3. Енергія електромагнітних хвиль (об'ємна густина, потік, вектор Умова-Пойнтінга)
- •4. Тиск електромагнітних хвиль. Імпульс електромагнітного поля
- •5. Шкала електромагнітних хвиль
- •Лекція 19 Інтерференція хвиль
- •3. Стоячі хвилі
- •Лекція 20 Дифракція хвиль
- •1. Закони геометричної оптики. Дифракція світла. Принцип Гюйгенса- Френеля
- •2. Дифракція в паралельних променях на щілині
- •Квантова теорія теплового випромінювання
- •1. Теплове випромінювання, його рівноважність, характеристики
- •По спектральній густині енергетичної світимості можна розрахувати інтегральну енергетичну світимість, підсумувавши по всіх частотах:
- •2. Абсолютно чорне тіло. Розподіл енергії в спектрі випромінювання абсолютно чорного тіла. Закони Кірхгофа і Стефана-Больцмана
- •3. Розподіл енергії в спектрі випромінювання абсолютно чорного тіла. Закон зміщення Віна
- •4. Квантова гіпотеза Планка. Формула Планка
- •Квантова теорія атома водню. Розвиток теорії Бора. Атоми із багатьма електронами
- •1. Спектр випромінювання атома водню. Серіальна формула
- •2. Постулати Бора. Борівська теорія атома водню
- •Набір можливих дискретних частот
- •3. Квантово-механічний опис атома водню
- •4. Квантові числа: головне, орбітальне і магнітне квантові числа. Правила відбору
- •5. Орбітальні механічний та магнітний моменти електрона
- •6. Спін електрона. Спінове квантове число
- •7. Принцип Паулі. Розподіл електронів в атомі за станами. Характерні квантові числа
- •Розподіл електронів в атомі підпорядковується принципу Паулі: в одному і тому ж самому атомі не може бути більше одного електрона з однаковим набором чотирьох квантових чисел n, l, ml I mz , тобто
- •Лекція 24 Хвильові властивості мікрочастинок
- •2. Деякі властивості хвиль де Бройля
- •Фазова швидкість фотона
- •3. Співвідношення невизначеностей Гейзенберга
- •4. Хвильова функція, її статистичний зміст та властивості. Статистичний (ймовірнісний) опис мікрочастинок за допомогою хвильової функції
- •Лекція 25 Рівняння Шредінгера та його застосування
- •1. Головне рівняння нерелятивістської квантової механіки
- •2. Стаціонарне рівняння Шредінгера
- •3. Рух вільної частинки
- •4. Мікрочастинка в одновимірній прямокутній "потенційній ямі" з нескінченно високими "стінками"
- •Власні функції:
- •Нормовані власні функції:
- •5. Проходження частинки через потенціальний бар'єр прямокутної форми. Тунельний ефект
- •Лекція 26 Зонна теорія твердих тіл
- •1. Кристалічні і аморфні тверді тіла. Кристалічна гратка
- •Характерною ознакою кристалічних тіл є кристалічні гратки.
- •3. Квантова теорія електропровідності металів
- •Напівпровідники
- •3. Зонна структура металів, діелектриків та напівпровідників
- •Валентна зона – це зона, повністю заповнена електронами. Утворюється з енергетичних рівнів внутрішніх електронів вільних атомів.
- •2. Функція розподілу Бозе – Ейнштейна
- •3. Функція розподілу Фермі – Дірака Ця функція визначається аналогічно функція розподілу Бозе – Ейнштейна і має такий вид:
- •4. Поняття про виродження систем частинок, що описуються квантовими статистиками
- •5. Поняття про виродження електронного газу в металах
- •Електропровідність металів
- •1. Класична теорія електропровідності металів
- •Виведення закону Ома
- •Закон Джоуля-Ленца
- •Закон Відемана-Франца
- •Труднощі класичної теорії
- •2. Квантова теорія електропровідності металів
- •Напівпровідники
- •Лекція 29 Власні напівпровідники
- •1. Власна провідність напівпровідників
- •2. Електронна домішкова провідність (провідність n-типу)
- •3. Діркова домішкова провідність (провідність р-типу)
- •4. Фотопровідність напівпровідників
- •Власна фотопровідність
- •Домішкова фотопровідність
- •Люмінесценція твердих тіл
- •Правило Стокса
- •2. Фізичні процеси, що відбуваються в р-п-переході
- •Провідність p-n-переходу
- •3. Напівпровідникові діоди
- •Точковий напівпровідниковий діод
- •Площинний напівпровідниковий діод
- •4. Напівпровідникові тріоди (транзистори)
- •1. Фотопровідність напівпровідників
- •Власна фотопровідність
- •Домішкова фотопровідність
- •Люмінесценція твердих тіл
- •Правило Стокса
- •2.2. Фізичні процеси, що відбуваються в р-п-переході
- •Провідність p-n-переходу
- •2.3. Напівпровідникові діоди
- •Точковий напівпровідниковий діод
- •Площинний напівпровідниковий діод
- •2.4. Напівпровідникові тріоди (транзистори)
- •Контактні явища в металах
- •1. Робота виходу електронів з металу у вакуум
- •2. Контакт двох металів по зонній теорії, контактна різниця потенціалів
- •3. Термоелектричні явища: Зеєбека, Пельтьє, Томсона та їх використання
- •Контакт електронного і діркового напівпровідників (р-п-перехід)
- •1. Електронно-дірковий перехід (р-п-перехід)
- •2. Фізичні процеси, що відбуваються в р-п-переході
- •Провідність p-n-переходу
- •3. Напівпровідникові діоди
- •Точковий напівпровідниковий діод
- •Площинний напівпровідниковий діод
- •4. Напівпровідникові тріоди (транзистори)
4. Квантова гіпотеза Планка. Формула Планка
Недоліки формул Віна і Релея - Джінса вказують на те, що для одержання функції розподілу енергії в спектрі випромінювання треба враховувати додаткові дані, що стосуються механізму випромінювання.
У 1900 р. М. Планк спочатку за результатами
дослідних даних одержав емпіричний
вираз функції
![]() ,
а потім теоретично і формулу, відмовившись
від усталеного положення класичної
фізики, що енергія будь-якої системи
змінюєтьсянеперервно. При цьому
він основувався на таких припущеннях:
,
а потім теоретично і формулу, відмовившись
від усталеного положення класичної
фізики, що енергія будь-якої системи
змінюєтьсянеперервно. При цьому
він основувався на таких припущеннях:
випромінювання є результатом коливання атомних лінійних вібраторів, які збуджують електромагнітні хвилі будь-яких частот подібно до вібраторів Герца;
вібратор випромінює енергію не безперервно, а певними порціями – квантами;
енергія кванта, яка випромінюється вібратором, залежить від частоти випромінювання.
Згідно з гіпотезою Планка атомні осцилятори випромінюють енергію не безперервно, а певними порціями – квантами: енергія кванта
![]() ,
,
де
![]() = 6,625·10-34
Дж·с – стала Планка.
= 6,625·10-34
Дж·с – стала Планка.
При цьому енергія осцилятора
може приймати лише певні дискретні
значення, які кратні цілому числу
елементарних порцій енергії
![]() :
:
![]() ,
,
Формула Планка має такий вид:
 .
.
Враховуючи, що
![]() (
(![]() ;
;![]() ),
),
отримаємо
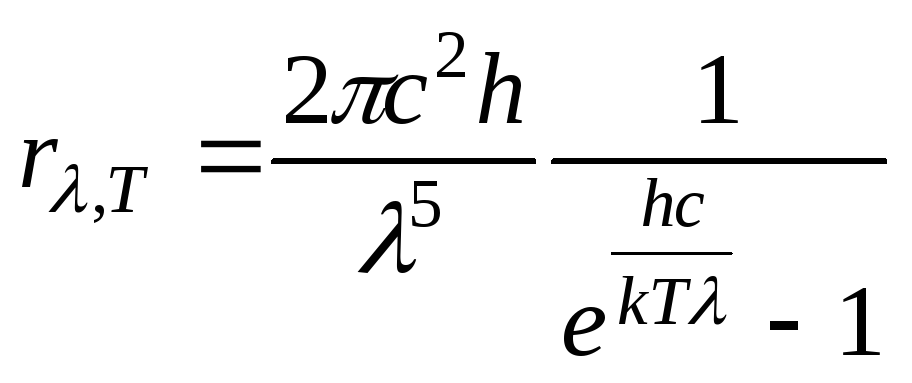 .
.
Зазначимо, що формула Планка блискуче узгоджується з дослідом.
Оскільки формула Планка справедлива для будь-яких частот і температур, то з неї можна вивести всі відомі закони випромінювання абсолютно чорного тіла (закон Стефана – Больцмана, закон зміщення Віна та ін.).
ЛЕКЦІЇ 22, 23
Квантова теорія атома водню. Розвиток теорії Бора. Атоми із багатьма електронами
1. Спектр випромінювання атома водню. Серіальна формула
Наведемо спочатку визначення понять атома таі іона.
Атом називається якнайменша частинка речовини, що має всіма хімічними властивості даного хімічного елемента. До складу атома входить позитивно заряджене ядро і електрони, що рухаються в електричному полі ядра. Заряд ядра Ze (Z – порядковий номер в системі Менделєєва; e – елементарний заряд) по абсолютній величині дорівнює сумарному заряду всіх електронів атома.
Іоном називається електрично заряджена частинка, яка утворюється при втраті або придбанні електронів атомом або молекулою.
Атом водню є найпростішим атомом. Він складається з одного протона в ядрі і одного електрона, що рухається в кулонівському електричному полі ядра. Воднеподібними іонами є іони Не+, Li++, Ве+++ і т. д., що мають ядро із зарядом Ze і один електрон.
Перша
спроба створення моделі атома на основі
накопичених експериментальних даних
належить Дж. Дж. Томсону (1903 р.). Згідно
з цією моделлю атом являє собою неперервно
заряджену позитивним зарядом кулю
радіусом порядка 10 –10
м, всередині якої навколо своїх положень
рівноваги коливаються електрони;
сумарний від'ємний заряд електронів
дорівнює позитивному заряду кулі, тому
атом в цілому нейтральний. Через декілька
років дослідами Резерфорда по розсіюванню
![]() -часток
в речовині було доведено, що уявлення
про те, що позитивний заряд неперервно
розподілений всередині атома, є
помилковим.
-часток
в речовині було доведено, що уявлення
про те, що позитивний заряд неперервно
розподілений всередині атома, є
помилковим.
На основі своїх досліджень Резерфорд в 1911 р. запропонував ядерну (планетарну) модель атома. Згідно з цією моделлю навколо позитивного ядра із зарядом Ze, розміром 10–15 – 10–14 і масою, яка практично дорівнює масі атома, в області з лінійними розмірами порядка 10–10 м по замкненим орбітам рухаються електрони, що утворюють електронну оболонку атома. Оскільки атоми нейтральні, то заряд ядра дорівнює заряду електронів, тобто навколо ядра обертається Z електронів (Z – порядковий номер в системі Менделєєва).
Для
простоти припустимо, що електрон
рухається навколо ядра по круговій
орбіті радіуса
![]() .
При цьому кулонівська сила взаємодії
між ядром і електроном надає електрону
доцентрове прискорення. На основі
другого закону Ньютона для електрона,
що рухається навколо ядра по круговій
орбіті під дією кулонівської сили,
матимемо
.
При цьому кулонівська сила взаємодії
між ядром і електроном надає електрону
доцентрове прискорення. На основі
другого закону Ньютона для електрона,
що рухається навколо ядра по круговій
орбіті під дією кулонівської сили,
матимемо
 ,
,
де
![]() і
і![]() – маса і швидкість електрона на орбіті
радіуса
– маса і швидкість електрона на орбіті
радіуса![]() ;
;![]() – електрична стала.
– електрична стала.
Ця умова
містить дві невідомі:
![]() і
і![]() .
Отже, величини
.
Отже, величини![]() і
і![]() (а також і енергія) можуть змінюватись
неперервно, тобто спектри атомів мають
бути суцільними. Протеатоми
мають лінійчасті спектри.
Тому модель атома Резерфорда протирічила
дослідним даним. Подолання труднощів,
що виникли, затребувало створення якісно
нової – квантової
– теорії атома.
(а також і енергія) можуть змінюватись
неперервно, тобто спектри атомів мають
бути суцільними. Протеатоми
мають лінійчасті спектри.
Тому модель атома Резерфорда протирічила
дослідним даним. Подолання труднощів,
що виникли, затребувало створення якісно
нової – квантової
– теорії атома.
Перейдемо до розгляду лінійчастого спектру атома водню.
Зазначимо, що дослідження спектрів випромінювання розріджених газів (тобто спектрів випромінювання окремих атомів) показали, що кожному газу притаманний свій лінійчастий спектр, який складається з окремих спектральних ліній чи груп близько розташованих ліній.
Спектр
випромінювання водню
є його найважливішою оптичною властивістю.
Частоти ліній
![]() в
дискретному лінійчатому спектрі атома
водню описуються емпіричною формулою
Бальмера — Рідберга:
в
дискретному лінійчатому спектрі атома
водню описуються емпіричною формулою
Бальмера — Рідберга:
![]() ,
,
де
![]() – постійна Рідберга. Цілі числа
– постійна Рідберга. Цілі числа![]() і
і![]() називаютьсяголовними
квантовими числами,
причому
називаютьсяголовними
квантовими числами,
причому
![]()
![]() і т.д.
і т.д.
Група
ліній з однаковими
![]() називається
серією.
Серії ліній водневого спектру:
називається
серією.
Серії ліній водневого спектру:
![]() –
серия Лаймана;
–
серия Лаймана;![]() –
серія Бальмера;
–
серія Бальмера;![]() – серія Пашена;
– серія Пашена;![]() –
серія Брекета;
–
серія Брекета;![]() –
серія Пфунда;
–
серія Пфунда;![]() – серія Хемфрі.
– серія Хемфрі.
Спектр водню (а також енергетичні рівні його атомів) вперше були пояснені за допомогою постулатів Бора.
