
- •3513 Практикум з мікробіології, вірусології та імунології
- •Частина 1 Загальна бактеріологія та імунологія
- •Передмова
- •Cписок скорочень
- •Правила роботи у бактеріологічній лабораторії. Морфологія бактерій. Світлова мікроскопія з використанням імерсійного об’єктива. Прості методи фарбування препаратів
- •Дeмонстрація
- •1. Бактеріологічний посуд: бактеріологічна петля (рис. 1д), чашка Петрі (рис. 1а), пробірки, градуйовані піпетки, колби
- •2. Предметні та покривні скельця (рис. 1б, в). Скельця з лунками. Спиртівка. Пісочний годинник, олівець “для скла”
- •3. Мікроскоп. Імерсійне масло
- •Правила роботи з імерсійною системою
- •Можливі помилки під час роботи з мікроскопом
- •Догляд за мікроскопом
- •Пояснення до самостійної роботи з теми:
- •Загальна будова навчального світлового мікроскопа
- •2. Будова бактеріальної клітини. Складні методи фарбування. Фарбування за методом Грама. Мікроскопічний метод діагностики збудників інфекційних захворювань
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми «будова бактеріальної клітини. Складні методи фарбування. Фарбування за методом Грама. Мікроскопічний метод діагностики інфекційних захворювань»
- •Спори та методи їх виявлення
- •Капсула
- •Класифікація бактерій за кількістю і розташуванням джгутиків
- •Методи виявлення джгутиків у бактерій
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми
- •«Особливості ультраструктури спірохет,
- •Рикетсій, хламідій, мікоплазм.
- •Сучасні методи мікроскопічного дослідження»
- •Звивисті форми бактерій
- •Загальна схема будови Treponema pallidum
- •4. Основи асептики та антисептики. Дезінфекція. Стерилізація
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •3. Автоклав
- •Пояснення до самостійної роботи з теми «основи асептики та антисептики. Дезінфекція. Стерилізація»
- •Види та завдання дезінфекції
- •Практична робота студентів
- •Пояснення до самостійної роботи з теми
- •«Фізіологія бактерій.
- •Перший етап бактеріологіного методу діагностики.
- •Біологічний метод діагностики»
- •Метаболізм
- •Конструктивний (анаболізм) Енергетичний (катаболізм)
- •6. Ріст та розмноження мікроорганізмів.
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми «ріст та розмноження мікроорганізмів.
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми «ііі – IV етап виділення чистої культури аеробних бактерій. Ферменти бактерій. Антибіотики»
- •8. Облігатні Анаероби. Виділення чистої культури
- •3. Метод Фортнера
- •4. Ріст Cl. Perfingens на середовищі Вільсон-Блера
- •Пояснення до самостійної роботи з теми «облігатні Анаероби. Виділення чистої культури облігатних анаеробних бактерій»
- •V етап Врахування та аналіз результатів дослідження. Відповідь
- •9. Бактеріофаги. Генетика бактерій
- •Теоретичні питання
- •Практична робота студентів
- •Демонстрація
- •5 . Дослід із виявлення множинної стійкості мікроорганізмів до антибіотиків
- •2 Мл культури реципієнта (f-)
- •1 Мл бульйонної культури реципієнта
- •Пояснення до самостійної роботи з теми «бактеріофаги та їх практичне використання. Генетика бактерій»
- •Бактеріофаги та їх практичне використання. Генетика бактерій
- •Перевага методу плр – полімеразної ланцюгової реакції для діагностики інфекційних захворювань
- •10. Нормальна мікрофлора тіла людини. Дисбактеріоз
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •3.1. Замалюйте мікроскопічні препарати.
- •3.2. Бакпечатка для вивчення мікрофлори тіла людини
- •3.3. Біологічні препарати (еубіотики): колібактерин, лактобактерин, біфідумбактерин, біфікол.
- •Пояснення до самостійної роботи з теми «нормальна мікрофлора тіла людини. Дисбактеріоз. Вчення про інфекцію»
- •Дисбактеріоз
- •11. Вчення про інфекцію
- •Теоретичні питання
- •Практична робота
- •1. Виявлення гемолітичної властивості бактерій
- •2. Виявлення плазмокоагулазної активності бактерій
- •4. Виявлення лецитовітелазної активності
- •Демонстрація
- •Пояснення до самостійної роботи з теми «нормальна мікрофлора тіла людини. Дисбактеріоз. Вчення про інфекцію»
- •12. Імунітет. Фактори і механізми вродженого захисту організму
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •2. Фагоцитоз у новонародженої і дорослої людини
- •3. Визначення бактерицидної активності сироватки крові
- •Пояснення до самостійної роботи з теми «імунітет. Фактори і механізми вродженого захисту організму»
- •Особливості імунної системи
- •13. Антигени
- •Теоретичні питання
- •Практична робота
- •Демонстрація Діагностичні препарати: Діагностикуми і антигени
- •Алергени для шкірноалергічних проб
- •Лікувально-профілактичні препарати
- •Пояснення до самостійної роботи з теми «антигени»
- •Класифікація антигенів
- •Антигени – сторонні макромолекули
- •Інфекційні
- •14. Адаптивна гуморальна імунна відповідь. Імуноглобуліни (антитіла). Серологічні реакції флокуляції, нейтралізації
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •1. Імунні сироватки (антитоксичні) та імуноглобуліни
- •2. Титрування антитоксичної сироватки методом флокуляції
- •Пояснення до самостійної роботи з теми «гуморальна імунна відповідь. Імуноглобуліни (антитіла). Серологічні реакції флокуляції, нейтралізації»
- •Набутий (адаптивний) імунітет
- •Практична робота
- •Демонстрація
- •1. Реакція непрямої гемаглютинації (рнга)
- •Пояснення до самостійної роботи з теми «серологічні реакції: реакція зв’язування комплементу (рзк), реакції з використанням мічених антитіл та антигенів – іфа, ріф, ріа»
- •16. Адаптивна клітинна імунна відповідь. Імунологічна толерантність. Регуляція імунної відповіді
- •Теоретичні питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «адаптивна клітинна імунна відповідь. Імунологічна толерантність. Регуляція імунної відповіді»
- •Механізм цитотоксичної дії т-кілера на клітину-мішень
- •17. Оцінка імунного статусу людини. Принципи функціонування імунної системи
- •Теоретичні питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «оцінка імунного статусу людини. Принципи функціонування імунної системи»
- •18. Протиінфекційний імунітет
- •Теоретичне питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «протиінфекційний імунітет»
- •Антигенспецифічна імунна відповідь
- •Зв’зок типу імунної відповіді з локалізацією інфекційних агентів
- •19. Патологія імунної системи
- •Теоретичні питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «патологія імунної системи»
- •Типи алергічних реакцій
- •20. Специфічна профілактика та терапія інфекційних захворювань. Лікувальні, профілактичні та діагностичні імунологічні препарати
- •Теоретичні питання
- •Практична робота
- •Діагностичні препарати
- •Пояснення до самостійної роботи з теми «специфічна профілактика і терапія інфекційних захворювань. Лікувальні, профілактичні та діагностичні імунологічні препарати»
- •Список рекомендованої літератури
- •Практикум з мікробіології, вірусології та імунології
- •Частина 1 Загальна бактеріологія та імунологія
Правила роботи з імерсійною системою
Підняти конденсор Аббе до рівня предметного столика, повністю відкрити ірис-діафрагму.
Користуючись об'єктивом х8 та дивлячись в окуляр, не виймаючи його, за допомогою плескатого дзеркала, досягти максимального освітлення поля зору.
На предметному столику розмістити пофарбований препарат стрептококів, нанести на нього кедрове масло і закріпити клемами.
Повертаючи револьвер, eстановити над препаратом імерсійний об'єктив х90, під контролем зору занурити його в краплю імерсійного (кедрового) масла.
Дивлячись в окуляр будь-яким оком (не закриваючи іншого), спочатку макрогвинтом знайти контури зображення, а потім мікрогвинтом досягти максимальної чіткості, вивчити й зарисувати препарат.
Після закінчення роботи підняти тубус, зняти предметне скло, обережно витерти серветкою імерсійний об'єктив від кедрового масла, повернути його в бік, опустити тубус.
Можливі помилки під час роботи з мікроскопом
Неправильний вибір дзеркальця.
Неправильнеустановленняконденсора та ірис-діафрагми, що призводить до недостатньої освітленості об’єкта.
Неправильний вибір об’єктива для роботи.
Неправильнеустановленняревольвера та інше.
Догляд за мікроскопом
Мікроскоп необхідно тримати в чистоті та запобігати механічним ушкодженням. При перенесенні його беруть за тубусотримач та підтримують іншою рукою знизу за основу. Перед початком роботи перевіряють справність мікроскопа. Особливу увагу слід звернути на чистоту оптики. Не слід торкатися руками до поверхні лінз – на них завжди залишаються відбитки пальців. Забруднення лінз окуляра можна виявити повертаючи його під контролем зору. Не слід самостійно розбирати об’єктиви та регулювати механічні частини.
Після завершення роботи мікроскоп слід привести у порядок. Спеціальною серветкою ретельно витирають масло з імерсійного об’єктива, переводять револьвер на малий сухий об’єктив 8х, повністю закривають діафрагму, опускають конденсор, на предметний столик кладуть серветку для прибирання мікроскопа та опускають тубус мікроскопа максимально вниз. Покривають мікроскоп поліетиленовим чохлом. Препарати замальовуйте кольоровою ручкою, умовно позначивши поле зору у вигляді кола.
Мікроскопічна картина
Зверніть увагу, що стрептококи
внаслідок поділу в одній площині формують
різної довжини ланцюжки, що нагадують
намисто. Морфологічні та
цитологічні особливості клітин
мікроорганізмів можна вивчати
використовуючи різноманітні методи
мікроскопії, а також використовуючи
різні способи забарвлення. Вибір методів
мікроскопічного дослідження і способів
забарвлення визначається конкретною
метою дослідження. Тобто якщо ми
хочемо виявити рухливість, то готуємо
препарат "роздавлена крапля" чи
"висяча крапля", якщо капсули, то
фарбуємо методом Буррі-Гінса.
Під часмікроскопії мазків вивчають морфологічні та тинкторіальні властивості бактерій: форму, структуру та розміри клітин, наявність спор, капсули, джгутиків, пілей, розташування клітин відносно одна одної, колір відповідно дометоду фарбування, що був використаний, наявність та характер рухливості.
Рисунок 3 – Strеptococcus spp., забарвлення генціан-віолетом
Робота 4. Виготовити мазки з культури кишкової палички, що вирощена в рідкому поживному середовищі (м’ясопептонний бульон). Пофарбувати фуксином Пфейфера, мікроскопіювати, зарисувати
Методика приготування мазка з культури, що вирощена на рідкому поживному середовищі
Для приготування мазка необхідно взяти чисте знежирене предметне скло. На предметному склі визначте склографом місце нанесення мазка.
Петлю прожарте в полум'ї спиртівки, тримаючи її як олівець вертикально у правій руці. Три рази проведіть через полум’я і нижню третину петлетримача. Не випускаючи петлі, лівою рукою візьміть пробірку з культурою кишкової палички, що вирощена на МПБ. Пробку пробірки притисніть до долоні 4-м та 5-м пальцями, пробірку повільно крутіть колоподібними рухами і витягніть з неї пробку. Вінця пробірки, не випускаючи пробки, проведіть через полум'я, петлю введіть та охолодіть об стінки пробірки. Бактеріальною петлею наберіть краплю культури з рідкого середовиша із дотриманням правил стерильності і обережно, не торкаючись стінок пробірки, вийміть її. Далі проведіть пробку і відкритий край пробірки через полум’я, після чого її закрийте і поставте у штатив.
Взяту культуру нанесіть на скло і, поступово розтираючи її, приготуйте тонкий, рівномірний мазок округлої чи овальної форми діаметром 1 – 1,5 см.
Після цього петлю прожарте у полум’ї спиртівки і поставте у штатив.
Висушування мазків.Після приготування мазок висушіть на повітрі при кімнатній температурі або в струменітеплого повітря над полум’ям спиртівки (виключаючи сильне нагрівання мазка). Потім висушений мазок зафіксуйте. Фіксований мазок називають препаратом.
Фіксація мазків.При фіксації мазків відбувається загибель мікроорганізмів, вони краще сприймають барвники, ніж живі, і при фарбуванні не змиваються. Використовують фізичний (над полум'ям спиртівки) та хімічний (фіксуючими рідинами) способи фіксації.
Фарбування препаратів. При простому методі фарбуваннявикористовують один барвник, наприклад, метиленовий синій, розчин фуксину Пфайфера та ін. Простий метод є орієнтовним і дозволяє виявити мікроорганізми в матеріалі, що мікроскопуються, визначити кількість, форму та взаєморозташування.
Отже,
на препарат, що приготовлений з культури
кишкової палички, нанесіть фуксин
Пфайфера та фарбуйте його 1 – 2 хвилини,
після чого барвник змийте водою.
Маркування препарату. На предметному склі (зліва) слідзазначити номер, дату, назву бактерій або матеріалу, що фарбується.


Рисунок 4 – Escherichia coli, фарбування фуксином
Мікроскопія пофарбованого препарату. Висушений препарат покладіть на предметний столик мікроскопата нанесіть на нього краплю імерсійного масла. Мікроскопіюйте пофарбований препарат, дотримуючись всіх правил мікроскопії з використанням імерсійного об’єктива (див. роботу3).
Мікроскопічна картина.
Зверніть увагу, що кишкова паличка в препараті розташовується поодинці і забарвлена в рожевий колір.
Робота 5. Виготовити мазки з культури стафілокока зі скошеного м’ясопептонного агару (МПА). Пофарбувати генціанвіолетом, мікроскопіювати, зарисувати
Методика виготовлення мазка з культури, що вирощена на щільному поживному середовищі
Для виготовлення мазка необхідно взяти чисте знежирене предметне скло. На предметному склі визначте склографом місце нанесення мазка.
Бактеріальну петлю прожарте у полум’ї, дотримуючись усіх правил. Не випускаючи петлі, лівою рукою візьміть пробірку із стерильним фізіологічним розчином, а 4-м і 5-м пальцями правої руки затисніть ватно-марлеву пробку, витягніть її і вінця пробірки пронесіть через полум’я спиртівки, не випускаючи пробки. Петлю введіть у пробірку і охолодіть її, торкаючись стінки. Занурюючи петлю в рідину, наберіть краплю фізіологічного розчину. Вийміть петлю, проведіть пробку та відкритий край пробірки через полум’я, після чого її закрийте і поставте у штатив. На центр скельця бактеріологічною петлею нанесіть краплю фізіологічного розчину.
Петлю зновупростерилізуйте, у ліву руку візьміть пробірку з культурою стафілокока, що вирощена на МПА. Відкрийте пробку з дотриманням усіх правил, охолодіть петлю і наберіть нею невелику кількість культури ковзними рухами. Петлю вийміть, а пробірку закрийте і поставте у штатив.
Взяту культуру стафілокока нанесіть на скло біля краплі фізрозчину, поступово розтираючи його та емульгуючи в краплі. Отриману завись рівномірно розподіліть на поверхні скла, діаметр мазка повинен бути в межах 1–1,5 см. Мазок висушіть на повітрі і зафіксуйте, для цього скло проведіть над полум'ям спиртівки тричі, так щоб мазок був зверху. Препарат пофарбуйте генціанвіолетом (1–2 хвилини). Після закінчення фарбування змийте барвник водою та висушіть препарат. Препарат мікроскопувати з використанням імерсійного об’єктива, дотримуючись усіх правил даної мікроскопії (див. роботу 3).
Мікроскопічна картина.
Зверніть увагу, що стафілокок
у препараті розміщується у вигляді
скупчень і зафарбований у фіолетовий
колір.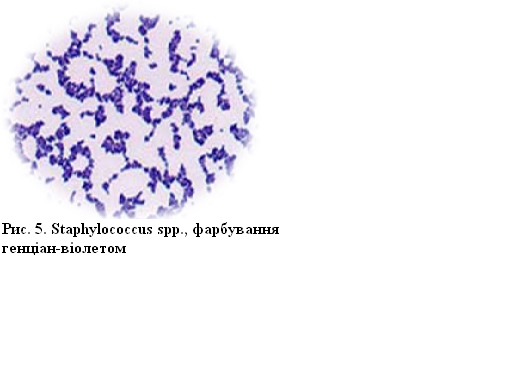
Рисунок 5 – Staphylococcus spp., фарбування генціан-віолетом
Після закінчення роботи необхідно прибрати робоче місце.
Приведіть у належний вигляд мікроскоп. Для цього підніміть тубус, зніміть препарат, витріть масло з об'єктива чистою марлевою серветкою, опустіть конденсор, закрийте діафрагму, переведіть револьвер у нейтральне положення і опустіть тубус.
Вилийте воду з ванночки для промивання препаратів.
Поставте пробірки з культурою у загальний штатив.
Наведіть загальний порядок на столі.
Використані скельця з препаратами опустіть в посудину з дезрозчином.
Проведіть дезінфекцію робочого столу (протріть стіл дезрозчином).
Вимийте руки з милом і за необхідності обробіть дезрозчином.
Оформіть протокол практичного заняття. Протокол подайте на підпис викладачу після прибирання робочого місця.
Протокол практичної роботислід оформляти за такою схемою:
Запишіть поставлене завдання дослідження (воно зазначене у кожній роботі в розділі "Практична робота").
Опишіть хід роботи.
Зробіть висновок про кожне проведене дослідження.
Під часмікроскопічноговивченняпрепарату результати занесіть до протоколу у вигляді рисунка з повною назвою об’єкта (латиною).
