
- •3513 Практикум з мікробіології, вірусології та імунології
- •Частина 1 Загальна бактеріологія та імунологія
- •Передмова
- •Cписок скорочень
- •Правила роботи у бактеріологічній лабораторії. Морфологія бактерій. Світлова мікроскопія з використанням імерсійного об’єктива. Прості методи фарбування препаратів
- •Дeмонстрація
- •1. Бактеріологічний посуд: бактеріологічна петля (рис. 1д), чашка Петрі (рис. 1а), пробірки, градуйовані піпетки, колби
- •2. Предметні та покривні скельця (рис. 1б, в). Скельця з лунками. Спиртівка. Пісочний годинник, олівець “для скла”
- •3. Мікроскоп. Імерсійне масло
- •Правила роботи з імерсійною системою
- •Можливі помилки під час роботи з мікроскопом
- •Догляд за мікроскопом
- •Пояснення до самостійної роботи з теми:
- •Загальна будова навчального світлового мікроскопа
- •2. Будова бактеріальної клітини. Складні методи фарбування. Фарбування за методом Грама. Мікроскопічний метод діагностики збудників інфекційних захворювань
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми «будова бактеріальної клітини. Складні методи фарбування. Фарбування за методом Грама. Мікроскопічний метод діагностики інфекційних захворювань»
- •Спори та методи їх виявлення
- •Капсула
- •Класифікація бактерій за кількістю і розташуванням джгутиків
- •Методи виявлення джгутиків у бактерій
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми
- •«Особливості ультраструктури спірохет,
- •Рикетсій, хламідій, мікоплазм.
- •Сучасні методи мікроскопічного дослідження»
- •Звивисті форми бактерій
- •Загальна схема будови Treponema pallidum
- •4. Основи асептики та антисептики. Дезінфекція. Стерилізація
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •3. Автоклав
- •Пояснення до самостійної роботи з теми «основи асептики та антисептики. Дезінфекція. Стерилізація»
- •Види та завдання дезінфекції
- •Практична робота студентів
- •Пояснення до самостійної роботи з теми
- •«Фізіологія бактерій.
- •Перший етап бактеріологіного методу діагностики.
- •Біологічний метод діагностики»
- •Метаболізм
- •Конструктивний (анаболізм) Енергетичний (катаболізм)
- •6. Ріст та розмноження мікроорганізмів.
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми «ріст та розмноження мікроорганізмів.
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •Пояснення до самостійної роботи з теми «ііі – IV етап виділення чистої культури аеробних бактерій. Ферменти бактерій. Антибіотики»
- •8. Облігатні Анаероби. Виділення чистої культури
- •3. Метод Фортнера
- •4. Ріст Cl. Perfingens на середовищі Вільсон-Блера
- •Пояснення до самостійної роботи з теми «облігатні Анаероби. Виділення чистої культури облігатних анаеробних бактерій»
- •V етап Врахування та аналіз результатів дослідження. Відповідь
- •9. Бактеріофаги. Генетика бактерій
- •Теоретичні питання
- •Практична робота студентів
- •Демонстрація
- •5 . Дослід із виявлення множинної стійкості мікроорганізмів до антибіотиків
- •2 Мл культури реципієнта (f-)
- •1 Мл бульйонної культури реципієнта
- •Пояснення до самостійної роботи з теми «бактеріофаги та їх практичне використання. Генетика бактерій»
- •Бактеріофаги та їх практичне використання. Генетика бактерій
- •Перевага методу плр – полімеразної ланцюгової реакції для діагностики інфекційних захворювань
- •10. Нормальна мікрофлора тіла людини. Дисбактеріоз
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •3.1. Замалюйте мікроскопічні препарати.
- •3.2. Бакпечатка для вивчення мікрофлори тіла людини
- •3.3. Біологічні препарати (еубіотики): колібактерин, лактобактерин, біфідумбактерин, біфікол.
- •Пояснення до самостійної роботи з теми «нормальна мікрофлора тіла людини. Дисбактеріоз. Вчення про інфекцію»
- •Дисбактеріоз
- •11. Вчення про інфекцію
- •Теоретичні питання
- •Практична робота
- •1. Виявлення гемолітичної властивості бактерій
- •2. Виявлення плазмокоагулазної активності бактерій
- •4. Виявлення лецитовітелазної активності
- •Демонстрація
- •Пояснення до самостійної роботи з теми «нормальна мікрофлора тіла людини. Дисбактеріоз. Вчення про інфекцію»
- •12. Імунітет. Фактори і механізми вродженого захисту організму
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •2. Фагоцитоз у новонародженої і дорослої людини
- •3. Визначення бактерицидної активності сироватки крові
- •Пояснення до самостійної роботи з теми «імунітет. Фактори і механізми вродженого захисту організму»
- •Особливості імунної системи
- •13. Антигени
- •Теоретичні питання
- •Практична робота
- •Демонстрація Діагностичні препарати: Діагностикуми і антигени
- •Алергени для шкірноалергічних проб
- •Лікувально-профілактичні препарати
- •Пояснення до самостійної роботи з теми «антигени»
- •Класифікація антигенів
- •Антигени – сторонні макромолекули
- •Інфекційні
- •14. Адаптивна гуморальна імунна відповідь. Імуноглобуліни (антитіла). Серологічні реакції флокуляції, нейтралізації
- •Теоретичні питання
- •Практична робота
- •Демонстрація
- •1. Імунні сироватки (антитоксичні) та імуноглобуліни
- •2. Титрування антитоксичної сироватки методом флокуляції
- •Пояснення до самостійної роботи з теми «гуморальна імунна відповідь. Імуноглобуліни (антитіла). Серологічні реакції флокуляції, нейтралізації»
- •Набутий (адаптивний) імунітет
- •Практична робота
- •Демонстрація
- •1. Реакція непрямої гемаглютинації (рнга)
- •Пояснення до самостійної роботи з теми «серологічні реакції: реакція зв’язування комплементу (рзк), реакції з використанням мічених антитіл та антигенів – іфа, ріф, ріа»
- •16. Адаптивна клітинна імунна відповідь. Імунологічна толерантність. Регуляція імунної відповіді
- •Теоретичні питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «адаптивна клітинна імунна відповідь. Імунологічна толерантність. Регуляція імунної відповіді»
- •Механізм цитотоксичної дії т-кілера на клітину-мішень
- •17. Оцінка імунного статусу людини. Принципи функціонування імунної системи
- •Теоретичні питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «оцінка імунного статусу людини. Принципи функціонування імунної системи»
- •18. Протиінфекційний імунітет
- •Теоретичне питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «протиінфекційний імунітет»
- •Антигенспецифічна імунна відповідь
- •Зв’зок типу імунної відповіді з локалізацією інфекційних агентів
- •19. Патологія імунної системи
- •Теоретичні питання
- •Практична робота
- •Пояснення до самостійної роботи з теми «патологія імунної системи»
- •Типи алергічних реакцій
- •20. Специфічна профілактика та терапія інфекційних захворювань. Лікувальні, профілактичні та діагностичні імунологічні препарати
- •Теоретичні питання
- •Практична робота
- •Діагностичні препарати
- •Пояснення до самостійної роботи з теми «специфічна профілактика і терапія інфекційних захворювань. Лікувальні, профілактичні та діагностичні імунологічні препарати»
- •Список рекомендованої літератури
- •Практикум з мікробіології, вірусології та імунології
- •Частина 1 Загальна бактеріологія та імунологія
Загальна будова навчального світлового мікроскопа
1
1 – окуляр
2 – тубус
3 – об'єктив
4 – предметний столик
5 – конденсор
6 – освітлювач
7 – основа мікроскопа
8 – рукоятка мікрогвинта
9 – рукоятка макрогвинта
10 – тубусотримач
11 – кронштейн конденсора
12 – ірісова діафрагма


2
 11
11

3
4
5
6
7
8
9
10



12
2. Будова бактеріальної клітини. Складні методи фарбування. Фарбування за методом Грама. Мікроскопічний метод діагностики збудників інфекційних захворювань
Актуальність теми: кожний мікроорганізм має певні морфологічні структури та тинкторіальні властивості, тому знання цих властивостей допомагає в ідентифікації збудника. З цією метою використовують складні методи фарбування, які дозволяють диференціювати одні бактерії від інших та вивчати структурні особливості бактеріальної клітини. Для ідентифікації необхідно вміти фарбувати препарати та розрізняти в них різні форми основних груп мікроорганізмів.
Мета –вміти диференціювати бактерії за тикторіальними властивостями, виявляти та розпізнавати різні структури мікроорганізмів при мікроскопіюванні фарбованих препаратів на склі.
Теоретичні питання
Структура бактеріальної клітини: нуклеоїд, мезосоми, рибосоми, спора, включення, цитоплазма, цитоплазматична мембрана, клітинна стінка, капсула, джгутики: будова, функції структур. Методи їх вивчення та виявлення.
Будова, хімічний склад клітинної стінки. L-форми бактерій, фактори, що зумовлюють їх утворення.
Капсули: різновиди (мікрокапсула, капсула та слизовий шар), будова, функціональне значення. Методи вивчення та виявлення капсул (метод Буррі-Гінса).
Складні методи фарбування мікроорганізмів: їх застосування, особливості.
Метод Грама: застосування, техніка, технологія.
Метод Циля-Нільсена для виявлення кислотостійких бактерій: принцип методу,його застосування.
Мікроскопічний метод діагностики збудників інфекційних захворювань, його застосування.
Практична робота
Робота 1. Вивчити і зарисувати демонстраційні препарати
Демонстрація
Препарати Сorynebacterium diphtheriae та Bordetella pertussis пофарбовані методом Грама. У демонстрації подані препарати, які відрізняються за тинкторіальними властивостями. Збудник дифтерії (Сorynebacterium diphtheriae) являє собою прямі або трохи зігнуті палички довжиною 1,0 – 0,8 мкм. Спор та капсул не утворює. Фарбується за Грамом позитивно. Характерною диференційною ознакою для збудника дифтерії є волютинові зерна. При характерному розміщенніС. diphtheriaeпід кутом один до одного зерна волютину при фарбуванні за Грамом виявляються у вигляді потовщень на кінці паличок.
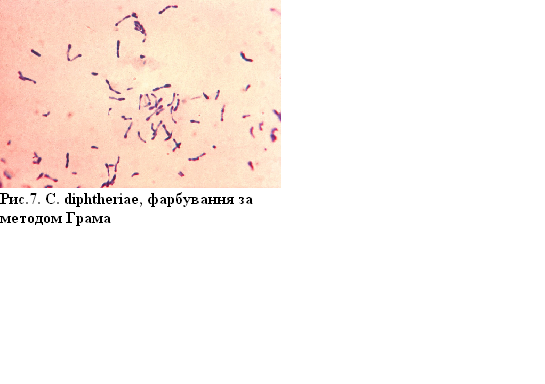
Збудник коклюшу (Bordetella pertussis) – дрібна із закругленими кінцями паличка за Грамом фарбується негативно. Здатність бактерій фарбуватися за Грамом залежить від властивостей і хімічного складу клітинної стінки та цитоплазматичної мембрани. Грампозитивні бактерії мають однорідну клітинну стінку, що містить 5–6 шарів пептидоглікану,відсутні ароматичні та сірковмісні кислоти, відзначається низький вміст ліпідів. У грамнегативних бактерій клітинна стінка двошарова, і ці речовини містяться у невеликій кількості.
Рисунок 7 – C.diphtheriae, фарбування за методом Грама
Крім того, у
клітинах грампозитивних бактерій
міститьсязначно більше
РНК – співвідношення РНК:ДНК у
грампозитивних бактерій (приблизно)
3:1, а у грамнегативних – 1:1. На поверхні
цитоплазми клітини у грампозитивних
мікроорганізмів розміщується комплексіз білка та рибонуклеїнату
магнію, який відсутній у грамнегативних
бактерій. При фарбуванні на поверхні
грампозитивних клітин утворюється
міцний комплекс рибонуклеату магнію,
генціанвіолету та йоду, який не руйнується
при обробленні спиртом.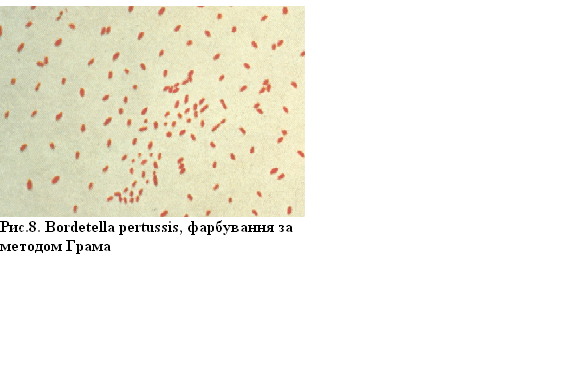
Рисунок 8 – Bordetella pertusis, фарбування за методом Грама
Має значення і різниця в кислотно-лужних властивостях цитоплазми, бо ізоелектрична точка грампозитивних мікроорганізмів близька до рН2, а у грамнегативних – рН5. Після оброблення йодом значення рН грампозитивних видів ще більше знижується, що створює умови для міцної фіксації барвника (генціанвіолет).
Препарати Bacillus anthracis та Neisseria meningitidis пофарбовані методом Грама
Збудники
сибірки (Bacillus
anthracis)
– дуже великі грампозитивні
палички з обрубаними кінцями, у мазках
із чистої культури розміщуються у
вигляді довгих ланцюжків.
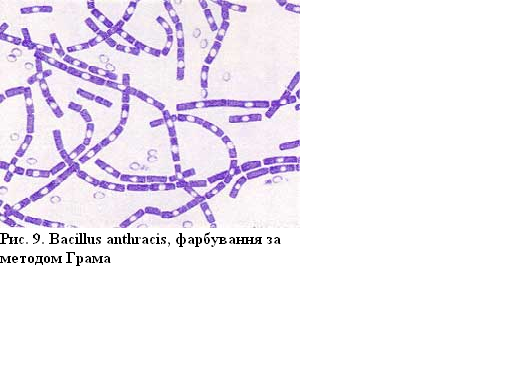
Мають центрально розташовану спору, яка за методом Грама не забарвлюється.
Рисунок 9 – Bacillus anthracis, фарбування за методом Грама
Збудники
менінгіту (Neisseria
meningitidis)
є диплококами, які внаслідок хімічної
будови клітинної стінки за методом
Грама забарвлюються у червоний колір
(грамнегативні). 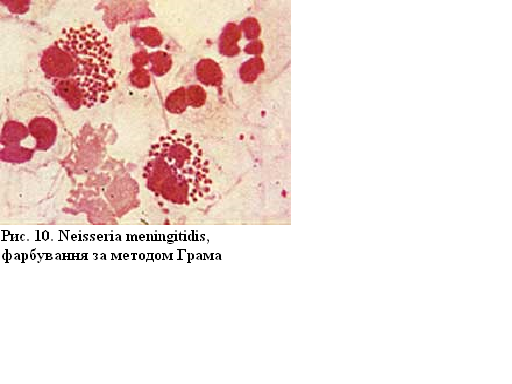
Рисунок 10 – Neisseria meningitidis, фарбування за методом Грама
Klebsiella pneumoniaе (фарбування за Буррі-Гінсом)
Техніка фарбування
бактерій, які мають капсулу, за Буррі-Гінсом
полягає в такому Змішують краплю зависі
мікробних клітин з краплею туші і за
допомогою скла з шліфувальним краєм
роблять мазок так само, як мазок крові,
який висушують та фіксують хімічним
способом. Потім на препарат наносять
водний розчин фуксину на 1 – 2 хвилини.
Промивають його водою, висушують на
повітрі і мікроскопують. При такому
фарбуванні на темному димчасто-сірому
фоні контрастно виділяються незабарвлені
капсули, всередині яких знаходяться
яскраво-червоні тіла бактерій, в даному
препараті клебсієл.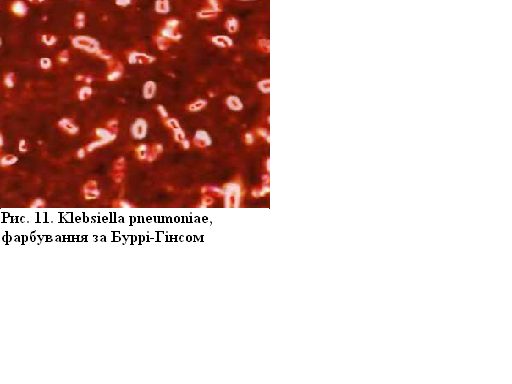
Рисунок 11 – Klebsiella pneumoniaе, фарбування за Буррі-Гінсом
Clostridium tetani (збудник правцю), фарбування за Цилем-Нільсеном. Збудник правця має вигляд барабанної палички (внаслідок термінального розміщення спори, діаметр якої перевищує поперечник клітини), цитоплазма клітин пофарбована у блакитний колір, спори – в рубіново-червоний (механізм фарбування спор за Цилем-Нільсеном див. у роботі 2). Метод Циля-Нільсена є складовою частиною фарбування за Ожешко.
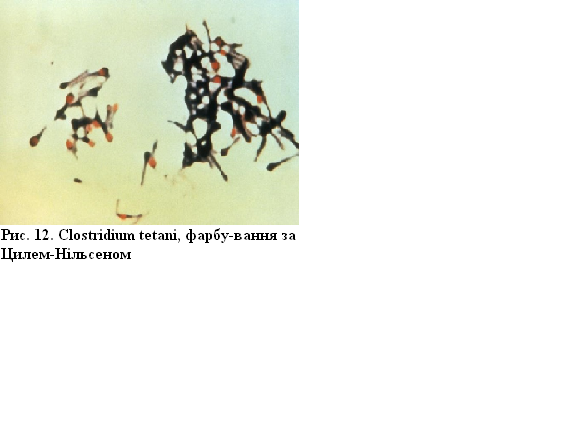
Рисунок 12 – Clostridium tetani, фарбування за Цилем-Нільсеном
Вacillus anthracis (збудник сибірки), фарбування за Цилем-Нільсеном
У мазку видно, що
вегетативні форми забарвлені в синій
колір, спори – у червоний, це пов’язано
з хімічним складом різних структур
бактерії.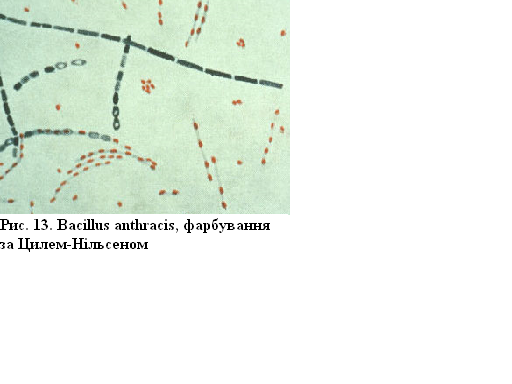
Рисунок 13 – Вacillus anthracis, фарбування за Цилем-Нільсеном
Робота 2. Приготувати препарат із суміші культур і пофарбувати його за Грамом. Мікроскопіювати, зарисувати
Методика виготовлення мазка із суміші мікроорганізмів
Для виготовлення мазка візьміть чисте знежирене предметне скло. На предметному склі позначте склографом місце нанесення мазка.
Бактеріальну петлю прожарте у полум'ї,дотримуючись усіх правил (див. зан. 1, роботу4). Не випускаючи петлі, лівою рукою візьміть пробірку із рідиною, що містить суміш мікроорганізмів (Staphylococcus aureus таEscherichia coli), а 4-м і 5-м пальцями правої руки затисніть ватно-марлеву пробку, витягніть її з пробірки,пронесіть через полум׳я спиртівки, не випускаючи пробки. Петлю введіть у пробірку і охолодіть її, торкаючись стінки пробірки. Занурюючи петлю в рідину, наберіть краплю суміші мікроорганізмів. Вийміть петлю, проведіть пробку та відкритий край пробірки через полум׳я спиртівки, після чого її закрийте і поставте у штатив. На центр скельця бактеріологічною петлею нанесіть краплю рідини, що містить суміш мікроорганізмів, розітріть і рівномірнорозподілітьна поверхні скла діаметром у межах 1 – 1,5 см.
Мазок висушіть на повітрі тазафіксуйте над полум’ям спиртівки.
Готовий препарат пофарбуйте методом Грама (методикуфарбування за Грамом див. нижче).
Далі, використовуючи імерсійну мікроскопію, промікроскопуйте пофарбований препарат та вивчіть його (див. зан. 1, роботу3).
Техніка фарбування за Грамом (модифікація Синьова)
На фіксований мазок покладіть суху смужку фільтрувального паперу, просоченого розчином генціанвіолету. Нанесіть на папір 2 – 3 краплі води. Час фарбування – 2 хвилини.
Зніміть папір.
Обробіть розчином Люголя впродовж1 хвилини.
Для знебарвлювання нанесіть на препарат спирт на 30 секунд.
Промийте препарат водою.
Для додаткового фарбування налийте на препарат фуксин Пфайфера (водний розчин) на 1 хвилину.
Промийте препарат водою та просушіть фільтрувальним папером.
Мікроскопічна картина: при правильному забарвленні грампозитивні Staphylococcus aureus фарбуються в темно-фіолетовий колір, грамнегативні бактерії – Escherichia coli – у рожевий.
Фарбування
за Грамом є важливим методом для
диференціації мікроорганізмів за
тинкторіальними властивостями.
Грампозитивні мікроорганізми (наприклад,
Staphylococcus aureus,
Streptococcus pyogenes)
фарбуються у фіолетовий колір
(генціанвіолетом), грамнегативні
(наприклад,Escherichiа
сoli, Salmonella
typhi)
– у червоний (фуксином). Для отримання
правильних результатів необхідно чітко
виконувати правила виготовленняння
мазка, дотримуватися точного часу
фарбування та знебарвлення спиртом.
Товсті, густі мазки будуть фарбуватися
нерівномірно, так грамнегативні бактерії
можуть пофарбуватися грампозитивно.
Крім того, маютьзначення
вік культури та мінливість мікроорганізмів.
Грамнегативні бактерії у старих культурах
можуть пофарбуватися грампозитивно.
Рисунок 14 – Суміш S.aureus та E. сoli, фарбування за методом Грама
Робота 3. Приготувати препарати із кислотостійких мікроорганізмів та пофарбувати їх за Цилем-Нільсеном. Мікроскопіювати, зарисувати у протоколі
Техніка виготовленняння препарату з кислотостійких чи спороутворювальних бактерій аналогічна попередній (дивись роботу 1).
Техніка фарбування за Цилем-Нільсеном
На фіксований препарат покладіть суху смужку фільтрувального паперу, нанесіть на папір 3–4 краплі карболового фуксину Циля. Утримуючи предметне скельце пінцетом або рукою, тричі нагрійте препарат над полум'ям спиртівки до появи пари. Час фарбування – 5 хвилин. Після охолодження скельця зніміть фільтрувальний папір з препарату та промийте його водою.
Для знебарвлення нанесіть на препарат 5% розчин сірчаної кислоти на 30 секунд.
Ретельно промийте препарат водою.
Нанесіть на мазок декілька крапель водного розчину метиленового синього на 3–4 хвилини.
Результат фарбування за Цилем-Нільсоном. Споротворні мікроорганізми фарбуються за Грамом позитивно. Але спора при цьому способі не фарбується внаслідок особливостей структури (щільна оболонка) і хімічного складу (високий вміст ліпідів) та визначається у вигляді безбарвного утворення на фоні фіолетової цитоплазми.
Мікроскопічна картина:
Фарбування
за Цилем-Нільсеном використовується
для диференціації кислотостійких та
некислотостійких мікроорганізмів.
Стійкість бактерій, наприклад,
Mуcobacterium
tuberculosis, до кислоти
зумовлена підвищеним вмістом у клітинній
стінці і цитоплазмі ліпідів, воску та
оксикислот. Принцип ґрунтується на
тому, що кислотостійкі бактерії за
рахунок названих речовин стійко зв'язують
карболовий фуксин при нагріванні (тобто
фарбуються у червоний колір) і не
знебарвлюються сірчаною кислотою, при
використанні додаткового барвника
– метиленового синього – загальний
фон фарбується в голубий колір.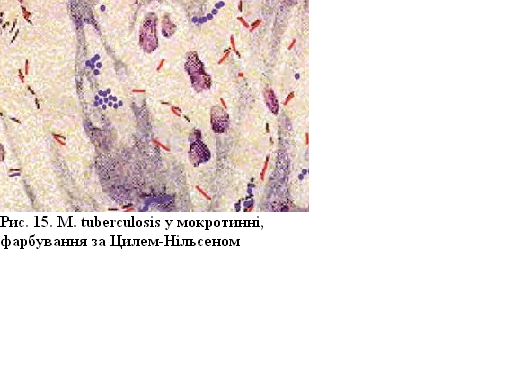
Рисунок 15 – Mycobacterium tuderculosis, фарбування за Цилем-Нільсеном
Робота 4. Виготовити препарат „роздавлена крапля”, мікроскопіювати, написати висновок у протоколі
Техніка виготовлення препарату „роздавлена крапля”
У центрі знежиреного предметного скла нанесіть краплю рідкої бульйонної культури або стерильного фізіологічного розчину та внесіть до неї за допомогою бактеріологічної петлі невелику кількість культури бактерій, що вирощена на щільному поживному середовищі, змішайте. На досліджуваний матеріал покладіть покривне скло так, щоб не було пухирців повітря. Краплю слід робити такої величини, щоб вона займала весь простір між покривним та предметним скельцями і не виступала за краї покривного. Якщо є надлишок рідини, то його необхідновидалити фільтрувальним папером, який слід відразу ж занурити у дезінфекційний розчин.
Препарат можна розглядати як із „сухими” системами,так і з імерсійною в темному колі. Тож мікроскопувати препарати слід використовуючи об׳єктиви із збільшенням у 40 або 90 разів.
Робота 5. Виготовити препарат „висяча крапля”, мікроскопіювати, написати висновок у протоколі
Техніка виготовлення препарату „висяча крапля”:
Препарат готують на покривному склі, у центр якого нанесіть одну краплю бактеріальної зависі. Потім предметне скло з лункою, краї якої попередньо змастіть вазеліном, притисніть до покривного скла, так щоб крапля знаходилася у центрі лунки, в результаті чого скельця склеюються. Швидким рухом переверніть препарат покривним склом догори. Таким чином, отримується герметично закрита камера, в якій крапля довго не висихає. У правильно виготовленому препараті крапля вільно висить над лункою, не торкаючись її дна або країв. Про мікроскопуйте препаратіз боку покривного скла, причому,спочатку знайдіть край на малому збільшенні та при прикритій діафрагмі, використовуючи об׳єктив 8х, потім на великому (об׳єктив 40x) та продовжуйте спостереження.
Препарати "роздавлена крапля” та „висяча крапля” промікроскопуйте та напишіть висновок у протокол.
Мікроскопічна картина:
Рухливість у більшості бактерій обумовлена наявністю джгутиків. Розташування та кількість їх у різних бактерій варіює і має діагностичне значення. За характером руху бактерій у препараті можна попередньо зробити висновок про наявність джгутиків. Якщо бактерія монотрих або лофотрих, то рух зазвичай дуже швидкий – що, гвинтується, без хитання з боку в бік; при латеральному або перитрихіальному розташуванні джгутиків клітини рухаються,різко відхиляючись від осі руху.
