
- •Растворы Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Электролитическая диссоциация Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Гидролиз солей Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 8
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 18
- •Вариант 20
- •Термодинамика
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Химическая кинетика и равновесие Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Окислительно-восстановительные реакции Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Химические свойства металлов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Коррозия металлов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Комплексные соединения Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Строение атома Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Химическая связь Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Приложение
- •Стандартные абсолютные энтропии s некоторых веществ
- •Константы диссоциации слабых электролитов
- •Растворимость солей и оснований в воде
- •Ряд стандартных электродных потенциалов металлов
- •Библиографический список
- •Содержание
Вариант 9
Что такое константа диссоциации? От каких факторов зависит численное выражение константы.
Составьте молекулярные и ионно-молекулярные уравнения следующих реакций:
Be(OH)2 + NaOH →;
FeCl3 + KOH →.
Степень диссоциации муравьиной кислоты HCОOН в 0,2 н. растворе равна 0,03. Определите константу диссоциации кислоты.
Исходя из произведения растворимости карбоната кальция, найдите его массу в 100 мл насыщенного раствора,
 =
5∙10–9.
=
5∙10–9.
Вариант 10
Что означает понятие «произведение растворимости» (ПР)? Каковы условия образования и растворения осадков?
Составьте молекулярные и ионно-молекулярные уравнения сле-дующих реакций:
Bа(OH)2 + H2SO4 →;
FeCl3 + NH4OH →.
Напишите уравнения электролитической диссоциации и выражение константы диссоциации для соединений: Pb(OH)2, HCN, HgCl2.
Используя значения ПР расположите вещества в порядке увеличения их растворимости в воде:
а) AgBr, AgCl, AgI;
б) Ag2CO3, Ag2SO4, Ag2CrO4.
Вариант 11
Какие значения рН отвечают сильно кислотным и сильно щелочным растворам? Как можно это проверить опытным путем?
Составьте молекулярные и ионно-молекулярные уравнения следую-щих реакций:
CH3COONa + H2SO4 →;
MgCO3 + HNO3 →.
В 0,1 н. растворе степень диссоциации уксусной кислоты 1,32∙10–2. При какой концентрации азотистой кислоты HNO2 ее степень диссоциации будет такой же?
В 300 мл насыщенного раствора PbI2 cодержится 81 мг ионов Pb2+. Вычислите произведение растворимости PbI2.
Вариант 12
Назовите основные отличия слабых и сильных электролитов.
Составьте молекулярные и ионно-молекулярные уравнения сле-дующих реакций:
Fe(NO3)3 + H2S →;
AgNO3 + H3PO4 →.
Напишите уравнения электролитической диссоциации и константы диссоциации для соединений: H3AsO3, CH3COOH, Fe(OH)2.
Сколько воды нужно прибавить к 300 мл 0,2 М раствора уксусной кислоты, чтобы степень диссоциации кислоты удвоилась?
Вариант 13
Как влияет на степень диссоциации добавление одноименного иона к раствору слабого электролита?
Составьте молекулярные и ионно-молекулярные уравнения сле-дующих реакций:
CuSO4 + NaOH →;
Zn(OH)2 + NaOH →
Вычислите степень диссоциации масляной кислоты C4Н7О2 в 0,04 н. ее растворе, КД = 1,5 10–5.
Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора Н2SO4? (
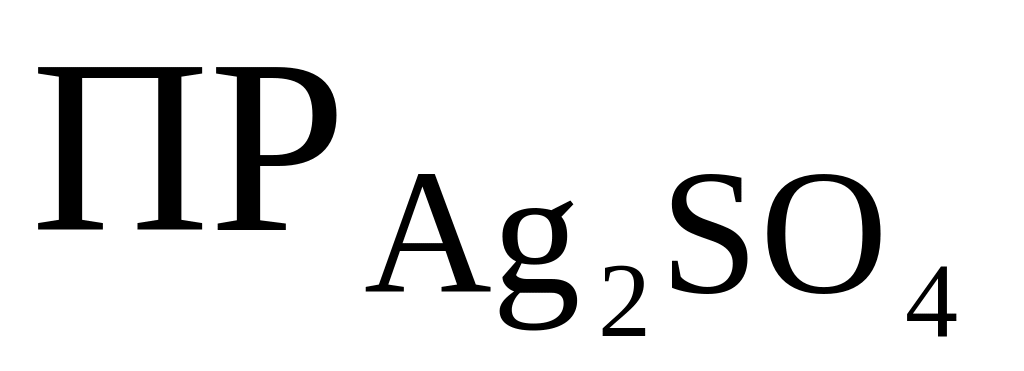 =
2∙10–5).
=
2∙10–5).
Вариант 14
В чем причина распада кристаллических веществ на ионы при растворении и плавлении? Как зависит способность веществ к диссоциации от вида химической связи?
Составьте молекулярные и ионно-молекулярные уравнения сле-дующих реакций:
NH4Cl + Ba(OH)2 →;
Pb(NO3)2 + KI →
Напишите уравнения электролитической диссоциации и выражения константы диссоциации для соединений: H3ВO3, Cr(OH)3, H2O.
Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl, считая степень электролитической диссоциации равной 1.
