
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
Этот вид замещения имеет место при взаимодействиях:
а) карбоновых кислот со спиртами (реакции этерификации),
б) практически всех функциональных производных карбоновых кислот – сложных эфиров, ангидридов, галогенангидридов, амидов и т.п. – с водой (реакции гидролиза производных карбоновых кислот),
в) галогенангидридов и ангидридов карбоновых кислот с аммиаком, фенолами, и т. п. (реакции ацилирования соответствующих классов соединений).
Все эти взаимодействия в общем виде описываются схемой (2). Например, уравнение ацилирования анилина с помощью уксусного ангидрида (см. основную реакцию синтеза ацетанилида по методу А, стр. 63) получается из схемы (2) при R = CH3, X = OCOCH3, Y = C6H5NH2.
Реакционная способность перечисленных соединений чрезвычайно сильно зависит от природы заместителя Х: чем выше электронодонорные свойства Х, тем ниже положительный заряд на карбонильном атоме углерода и тем медленнее протекает реакция. Например, хлорангидрид уксусной кислоты СН3СО-Cl с водой реагирует едва ли не со взрывом, тогда как диметилацетамид СН3CO-N(CH3)2 медленно гидролизуется лишь при кипячении с водными растворами кислот (серной, соляной и т.п.).
Карбоновые кислоты (RCO-OH), их сложные эфиры (RCO-OR) и амиды кислот (RCO-NH2, RCO-NHR, RCO-NHR2) характеризуются относительно низкой реакционной способностью, так как группы -OH, -OR, -NH2, -NHR и -NR2 сопряжены с соседней двойной связью С=О и проявляют электронодонорные свойства. Поэтому для этих соединений процессы нуклеофильного замещения у sp2-гибридизованного атома углерода осуществляют каталитически при содействии сильных кислот.
Роль кислоты и в этом случае заключается в протонировании карбонильного атома кислорода, имеющего следствием рост положительного заряда на соседнем углеродном атоме:
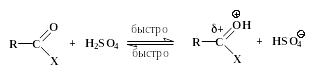
Далее происходит присоединение нуклеофила к карбонильному атому углерода с образованием промежуточного продукта (интермедиата):
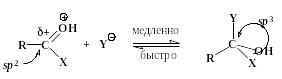
интермедиат
Это лимитирующая, самая медленная стадия процесса. Таким образом, реакция замещения в целом классифицируется как бимолекулярная. Атакуемый атом углерода в процессе образования интермедиата изменяет свое валентное состояние от sp2- до sp3-, следовательно углы между -связями, которые образует этот атом, уменьшаются от 120 до ~109 (заместителям вокруг этого атома становится “теснее”). Поэтому на скорость процессов нуклеофильного замещения у sp2-гибридизованного атома углерода значительное влияние оказывают величины объемов групп R, X и Y. Чем они больше, тем медленнее при прочих равных условиях лимитирующая стадия образования интермедиата и, следовательно, медленнее проходит весь процесс замещения.
Интермедиат неустойчив и быстро отщепляет либо HX, превращаясь таким образом в продукт замещения, либо HY, что возвращает его в начальное состояние.
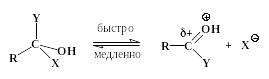
Процесс завершается отщеплением Н+ от карбонильной группы:
Реакции нуклеофильного замещения у карбонильного атома, катализируемые сильными кислотами, обратимы. Важно отметить, что прямая и обратная реакции имеют одни и те же промежуточные соединения. Этот частный пример иллюстрирует общий для всех обратимых реакций принцип микроскопической обратимости химических процессов. Ниже приведен пример, конкретизирующий данную схему и показывающий единый механизм обратимого процесса этерификации и гидролиза сложного эфира.
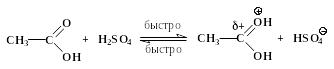

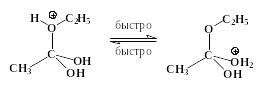
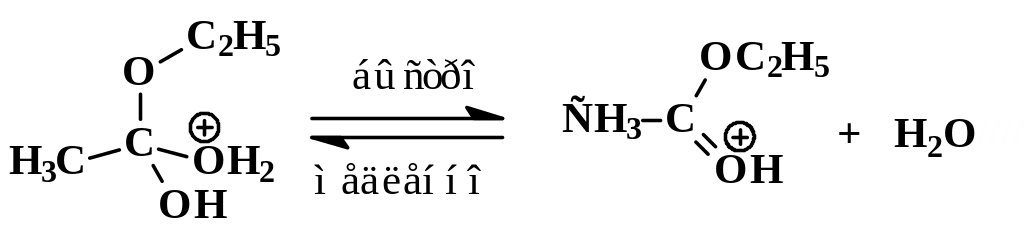
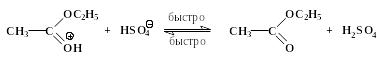
Гидролиз производных карбоновых кислот (сложных эфиров, амидов, ангидридов, галогенангидридов) проходит не только в кислой, но также и в щелочной среде при участии гидроксид-анионов. Естественно, карбоновые кислоты в щелочной среде образуются в виде карбоксилат-ионов RCOO-, которые превращают в недиссоциированную форму RCOOH действием сильных кислот. Примером щелочного гидролиза производных карбоновых кислот может служить реакция расщепления ацетанилида:
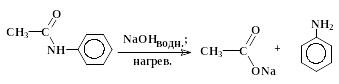
ацетанилид или фениламид уксусной кислоты |
ацетат натрия |
анилин |
Механизм щелочного гидролиза функциональных производных карбоновых кислот показан на следующей схеме:


Две первые реакции равновесны, однако третья в условиях избытка щелочи оказывается практически необратимой. Причиной этого является высокая устойчивость карбоксилатного иона, обусловленная делокализацией отрицательного заряда, в равной мере принадлежащего обоим атомам кислорода.
Более подробные сведения об особенностях протекания и механизмах нуклеофильных реакций замещения представлены в учебниках по органической химии, например, в [9].
