
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Контрольные вопросы
1. Какие реакции называются реакциями ацилирования? Укажите наиболее часто употребляемые ацилы и ацилирующие агенты.
2. С какой целью проводят ацилирование аминов?
3. Объясните, почему группа -NНСОСН3 является более слабым электронодонором, чем группа -NН2?
4. Почему при получении п-броманилина бромируют ацетанилид, а не анилин? Напишите уравнения реакций, по которым получают n-броманилин из ацетанилида.
5. Какое соединение является более сильным основанием: анилин или ацетанилид? Дайте объяснение с использованием электронных представлений.
6. Известно, что ангидриды кислот при растворении их в воде легко разлагаются с образованием кислот. Почему же реакцию получения ацетанилида по методу А проводят в водной среде? Как объяснить значительно меньшую растворимость в воде уксусного ангидрида по сравнению с уксусной кислотой?
7. Почему при получении ацетанилида по методу Б уксусная кислота берется с большим избытком по отношению к анилину?
8. Из каких веществ состоит реакционная смесь в конце реакции? Для удаления какой примеси осадок ацетанилида промывают водой на воронке Бюхнера при первом фильтровании? Почему для промывания рекомендуется применять холодную воду?
9. Какие правила техники безопасности должны выполняться при проведении синтеза ацетанилида?
2.1.5. Ацетилсалициловая кислота (аспирин)
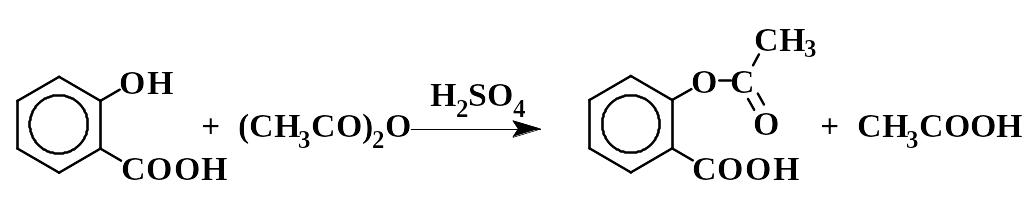
В небольшую коническую колбу помещают 2 г предварительно высушенной при 100 С салициловой кислоты и 2,8 мл уксусного ангидрида. Добавляют 2 – 3 капли концентрированной серной кислоты и хорошо перемешивают содержимое колбы. Не прекращая размешивания, нагревают смесь на водяной бане при 60 С в течение 15 мин, а затем дают ей охладиться до комнатной температуры.
Добавляют в колбу 30 мл воды, хорошо перемешивают и отфильтровывают осадок на воронке Бюхнера. Неочищенную ацетилсалициловую кислоту перекристаллизовывают из смеси равных объемов уксусной кислоты и воды, отфильтровывают, промывают на фильтре ледяной водой и затем толуолом. Полученный таким образом аспирин сушат при 40 – 60 С до исчезновения запаха уксусной кислоты. Выход 95 %. Тпл 144 С
Пояснения к синтезу
Ацилированию, т.е. замещению подвижных атомов водорода на остатки кислот – ацилы – могут подвергаться амины, фенолы, спирты и другие соединения. При синтезе аспирина водород фенольного гидроксила в салициловой кислоте замещается на остаток уксусной кислоты – ацетил (СН3СО-). Механизм реакции может быть представлен следующим образом:
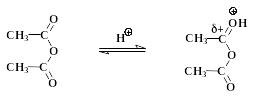
уксусный ангидрид I: протонированый уксусный ангидрид
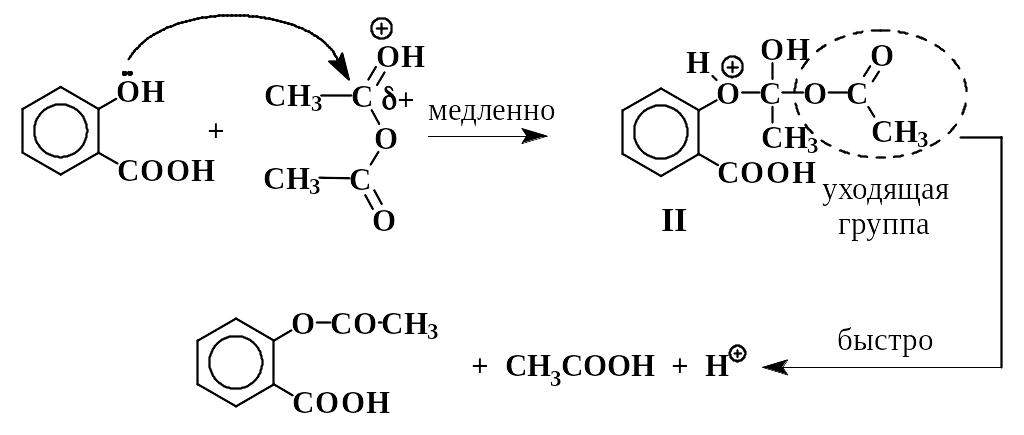
Это пример нуклеофильного замещения у карбонильного атома углерода в уксусном ангидриде. Из-за электроноакцепторного влияния орто-карбоксильной группы в салициловой кислоте основные (и нуклеофильные) свойства фенольного гидроксила ослаблены. Это вызывает необходимость добавлять в смесь кислотный катализатор (конц. Н2SО4). Сам фенол ацилируется уксусным ангидридом в отсутствии кислоты. Протонирование карбонильного кислорода приводит к катиону I, в котором электрофильность углерода сильно повышена. Это облегчает нуклеофильную атаку и образование промежуточного соединения II, в котором карбонильный углерод переходит из sр2- в sр3- состояние.
При перекристаллизации продукта из разбавленной уксусной кислоты не следует кипятить раствор дольше, чем требуется для растворения ацетилсалициловой кислоты во избежание ее гидролитического разложения. Перекристаллизованный продукт отфильтровывают и осадок промывают сначала небольшим количеством ледяной воды, а затем холодным толуолом.
Чистая ацетилсалициловая кислота имеет температуру плавления 144 С. Однако при нагревании она разлагается, поэтому ее истинную температуру плавления определить трудно. Обычно получается препарат, плавящийся в интервале 129 – 133 С.
