
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Контроль диазотирования
При диазотировании тщательно контролируют избыток азотистой кислоты и, как только будет обнаружено, что она присутствует в растворе и больше уже не расходуется, приливание водного раствора нитрита прекращают.
Наиболее совершенным способом определения содержания свободной азотистой кислоты в реакционной массе в лабораторных условиях и на производстве является измерение окислительно-восстановительного потенциала системы с помощью платинового индикаторного электрода в паре с каломельным или хлорсеребряным электродом сравнения.
Более простой способ контроля – проба по йодкрахмальной бумажке, которая представляет собой полоску фильтровальной бумаги, пропитанную йодистым калием и водорастворимым крахмалом. Если в растворе присутствует свободная азотистая кислота, она окисляет иодид калия, и выделяющийся молекулярный йод, взаимодействуя с крахмалом, окрашивает индикаторную бумагу в синий цвет:
2 KI + 2 HNO2 + H2SO4 = I2 + K2SO4 + 2 H2O + 2 NO
Реакция диазотирования проходит сравнительно медленно, поэтому пробу на присутствие избытка азотистой кислоты следует делать не тотчас же после прибавления последней порции нитрита, а спустя 5 – 10 мин после этого.
Если после диазотирования в реакционном растворе остается небольшой избыток азотистой кислоты, его уничтожают, вводя в раствор вещества, легко реагирующие с НNО2. Обычно используют мочевину (H2N-CO-NH2) или сульфаминовую кислоту (H2N-SO3H):
H2N-CO-NH2 + 2 HNO2 = 2 N2 + CO2 + 3 H2O
H2N-SO3H + HNO2 = H2SO4 + N2 + H2O
В процессе диазотирования необходимо проверять наличие минеральной кислоты в реакционной массе по индикаторной бумажке.
Как правило, соли диазония с такими анионами как Сl, НSО4, Вr и т.п. в свободном виде не выделяют, так как в сухом виде они являются взрывчатыми веществами (во влажном состоянии не опасны). Гораздо большей термической устойчивостью обладают тетрафторбораты диазония [ArN2]+[BF4]. Они могут быть получены в сухом состоянии и храниться продолжительное время. Значительной устойчивостью обладают также двойные соли диазония и ряда металлов. Например, практическое значение имеют двойные соли диазония с хлористым цинком ArN2+·ZnCl3, которые могут быть выделены в сухом состоянии. Диазосоединения иногда выделяют из реакционных смесей в виде их устойчивых форм – диазотатов Ar-N=N-ONa.
Формы диазосоединений
При добавлении щелочи к раствору соли диазония гидроксильный ион связывается с крайним атомом азота и образуется диазогидрат, обладающий слабыми кислотными свойствами. Диазогидрат нейтрализует еще один гидроксильный ион, превращаясь в диазотат:
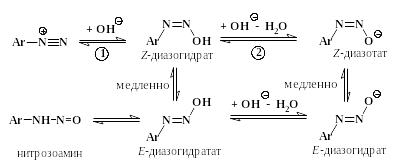
Константы равновесия реакций (1, 2) почти одинаковы и обычно имеют величину 10-9 10-10 л/моль. Поэтому диазогидрат ни при каких условиях не бывает доминирующей формой. В кислых растворах диазосоединения существуют в основном в виде катионов диазония, в щелочных при рН 10 – в форме диазотат-анионов. Максимальная доля диазогидрата (≤ 25 %) достигается в интервале рН от 9 до 10.
Если только что полученный раствор диазотата снова подкислить, то он быстро превратится в исходную соль диазония. Однако, когда этот раствор постоит или если его нагреть со щелочью, то диазотат превращается в более стабильную форму, которая при подкислении лишь очень медленно переходит в соль диазония. Это явление объясняется тем, что образующийся вначале анион диазотата имеет Z-конфигурацию, а более стабильный продукт его изомеризации представляет собой E-изомер. (обозначения Z и E рекомендованы ИЮПАК вместо устаревших цис-транс- и син-анти-).
Обратное превращение Е-изомера в Z- осуществляется лишь в специальных условиях при действии ультрафиолетового света. Превращение Е-диазотата в соль диазония при подкислении проходит через стадию образования нитрозоамина Ar-NH-NO.
Е-диазотаты – стабильные соединения, не способные вступать в реакцию азосочетания. Они используются в технике как удобный для хранения и транспортировки источник получения солей диазония.
