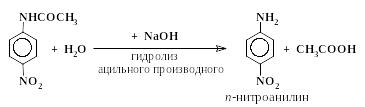- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
2.2.4. Cульфаниловая кислота
Работа выполняется под тягой. Для синтеза применяется прибор, используемый при получении м-динитробензола (рис. 20 на стр. 95).
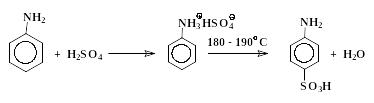
В колбу помещают 15 мл свежеперегнанного анилина и к нему небольшими порциями, чтобы смесь не перегревалась, добавляют 27 мл концентрированной серной кислоты (d = 1,84 г/см3). Раствор нагревают на сетке при 180 – 190 C до тех пор, пока проба, растворенная в горячем водном растворе щелочи, не перестанет выделять анилин (масляные капельки). Сульфирование идет 1,5 – 2 часа. Перегревание реакционной смеси выше 190 С ведет к ее обугливанию.
По окончании сульфирования охлажденную до 80 – 90 С реакционную массу выливают при размешивании в 200 мл холодной воды. При охлаждении сульфаниловая кислота выпадает в осадок. Кислоту отфильтровывают на воронке Бюхнера, дважды промывают небольшими порциями холодной воды и перекристаллизовывают из воды с добавлением активированного угля. Способ перекристаллизации описан в работе по получению ацетанилида (стр. 64). Выход дигидрата сульфаниловой кислоты п-H2N-C6H4-SO3H.2H2O 15 – 17 граммов.
Пояснения к синтезу
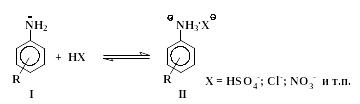
Реакции электрофильного замещения водорода в кольце ароматических аминов имеют ряд особенностей, обусловленных наличием у атома азота неподеленной электронной пары. С кислотами, которые используются в качестве электрофильных реагентов, амины реагируют, прежде всего, как основания с образованием солей:
|
(1) |
Из двух форм свободного амина I и его соли II первая содержит сильный электронодонорный заместитель -NH2, а вторая – сильнейший электроноакцептор группу -NH3+.
Электрофильное замещение в солях типа II происходит значительно медленнее, чем в молекулах свободных аминов I. Ориентирующее действие амино- и аммонийной группы также различно: группа NH2 – сильный орто-пара-ориентант, а группа -NH3+ направляет электрофильные частицы в мета-положение.
В сильнокислой среде (в концентрированных кислотах: серной, соляной и т.п.) равновесие (1) почти полностью сдвинуто вправо при условии, что ароматическое ядро не содержит сильных электроно-акцепторных заместителей R. Из-за дезактивирующего влияния группы -NH3+ сульфирование анилина до сульфаниловой кислоты при комнатной температуре не происходит. Для сравнения можно указать на то, что при действии концентрированной серной кислоты на фенол последний легко превращается в смесь орто-, пара-сульфокислот и 2,4-дисульфокислоты фенола.
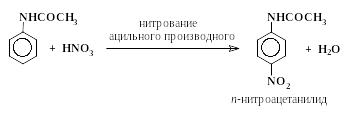
Следует, однако, отметить, что даже в сильнокислых растворах очень активные электрофильные реагенты и окислители способны взаимодействовать со свободным амином, присутствующим в этих условиях в ничтожной концентрации. Например, концентрированная азотная кислота энергично окисляет анилин (в форме I) и в то же время реагирует с его солью (форма II), образуя некоторое количество мета-нитроанилина. При действии концентрированной азотной кислоты на анилин образуется много продуктов осмоления и следы мета-нитроанилина. Для получения из анилина п-нитроанилина, п-броманилина и т.п. приходится прибегать к методу “защиты” аминогруппы, а точнее к ее временной дезактивации путем ацилирования.
Например, п-нитроанилин получают следующим образом:
|
(2) |
|
(3) |
|
(4) |
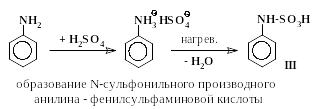
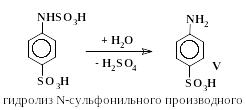
Превращения анилина в сульфаниловую кислоту включают в себя стадии (5 – 7), аналогичные превращениям (2 – 4) с тем отличием, что в случае сульфирования анилина все последовательные реакции проходят в одном сосуде и промежуточные вещества не выделяются.
|
(5) |
|
(6)
|
|
(7) |
Большинство сульфокислот очень хорошо растворяется в воде. В отличие от них сульфаниловая кислота, как и другие ароматические аминосульфокислоты, сравнительно малорастворима: в 100 мл воды при 20 С может раствориться только около 1 г кислоты. Аминосульфокислоты в кристаллическом состоянии существуют в форме биполярных ионов, которые также называют внутренними солями или цвиттер-ионами. Образование биполярного иона происходит в результате внутримолекулярного взаимодействия аминогруппы, обладающей слабо-основными свойствами, с сульфогруппой, кислотные свойства которой по силе сопоставимы с серной кислотой:
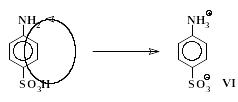
Органические соединения, образующие биполярные ионы, имеют очень прочные ионные кристаллические решетки. Энергии, выделяющейся при гидратации частиц VI, недостаточно для компенсации энергетических затрат, необходимых для разрушения кристаллической решетки сульфаниловой кислоты. Это и является причиной малой растворимости сульфаниловой кислоты в воде.