
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Пояснения к синтезу
Первая стадия реакции состоит в нуклеофильном присоединении азота гидразина по двойной связи С=О. Далее отщепляется молекула воды и образуется моногидразид ацетилацетона I, который за счет неподеленной электронной пары второго атома азота вступает в аналогичные внутримолекулярные превращения с образованием промежуточного продукта II. Атомы азота соединения II обладают сильными электроноакцепторными свойствами и ослабляют связи С-Н центрального метиленового звена. Миграция одного из атомов водорода группы СН2 к атому азота ведет к образованию стабильной ароматической системы π-связей, что является движущей силой реакции изомеризации:

Бензимидазол
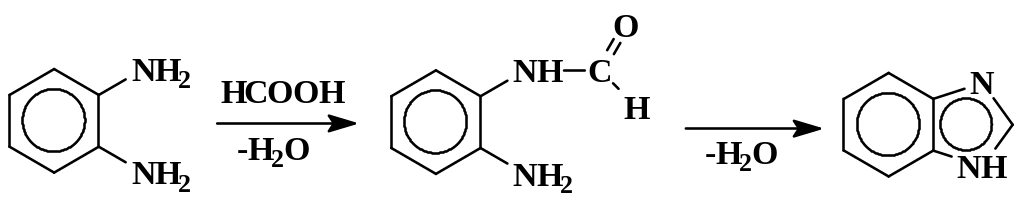
В 0,5 л колбу помещают 54,0 г (0,5 моль) орто-фенилендиамина и добавляют 32 мл (34,6 г, 0,75 моль) 90 %-ной муравьиной кислоты. Смесь нагревают на водяной бане в течение 2 час, после охлаждения к ней медленно приливают 10 %-ный раствор гидроксида натрия до щелочной реакции на лакмус. Сырой бензимидазол отсасывают на воронке Бюхнера и промывают холодной водой. Далее его растворяют в 750 мл кипящей воды, нагревают с 2 г активированного угля 15 мин и быстро фильтруют через обогреваемую воронку. Фильтрат охлаждают до 10 – 15 °С, продукт отфильтровывают, промывают холодной водой и высушивают при 100 °С. Выход 49,0 – 50,5 г (83 – 85 %). Тпл170 – 172 °С.
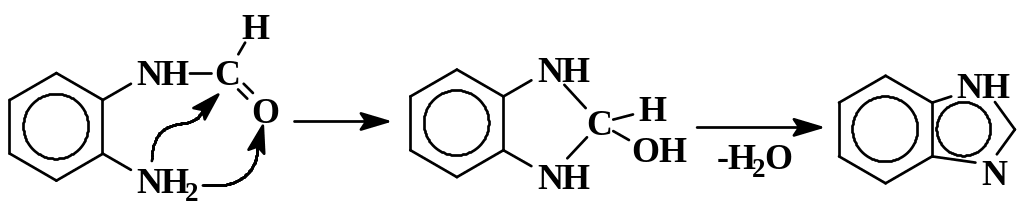
Пояснения к синтезу
Первая стадия – образование замещенного амида муравьиной кислоты. Вторая – разрыв двойной связи С=О с внутримолекулярным нуклеофильным присоединением аминогруппы и последующим отщеплением молекулы воды:
1,2,3,4-Тетрагидрокарбазол
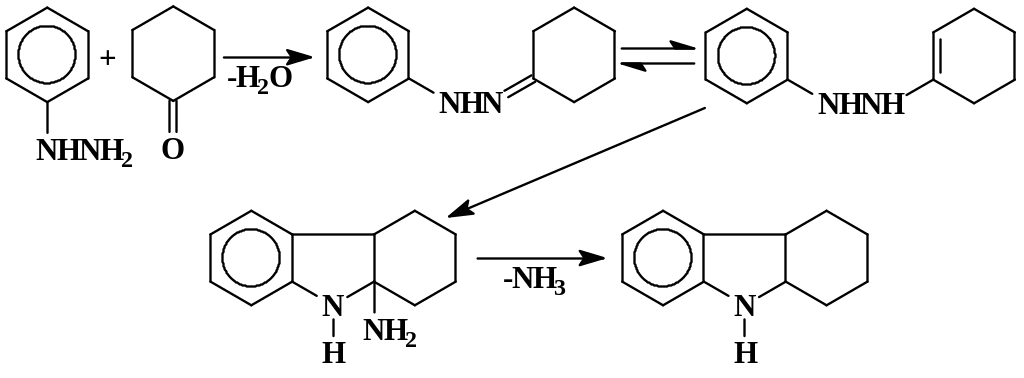
В 1 л трехгорлой колбе, снабженной обратным холодильником, мешалкой и капельной воронкой, смешивают 98 г (1,0 моль) циклогексанона и 360 г (6,0 моль) уксусной кислоты. Содержимое колбы нагревают до кипения и при перемешивании добавляют за 1 час 108 г (1,0 моль) фенилгидразина. Смесь кипятят еще 1 час и переливают в стакан при перемешивании до затвердевания. Смесь охлаждают до 5 °С, фильтруют, осадок промывают водой (100 мл), а затем 75 %-м спиртом (100 мл). Сырой препарат сушат на воздухе в течение ночи и перекристаллизовывают из 700 мл метанола с активированным углем. Выход 120 – 135 г (76 – 85 %). Тпл 115 – 116 °С.
Пояснения к синтезу
Реакция циклоконденсации при внутримолекулярной нуклеофильной атаке по эндо-положению активированной двойной связи орто-положением бензольного кольца с последующим элиминированием аммиака и образованием ароматической системы индола (синтез индолов по Фишеру).
Хинолин (синтез Скраупа)
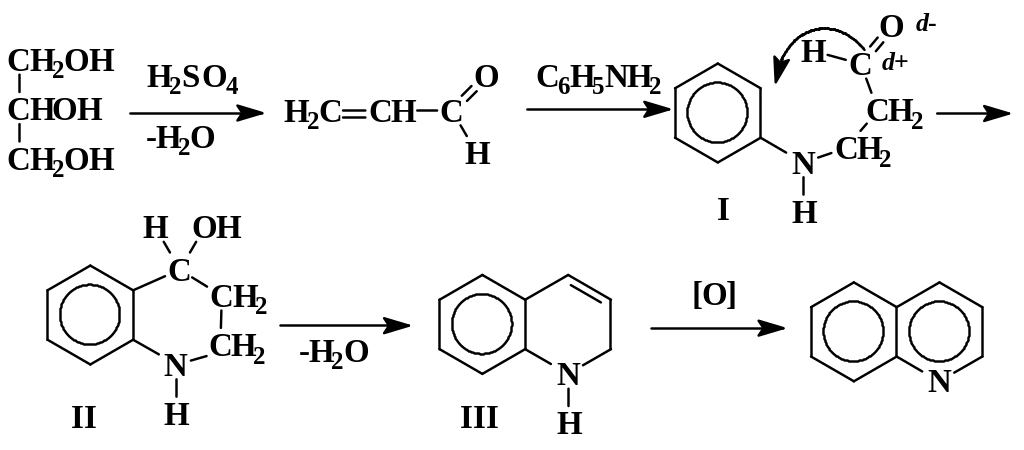
В 0,5 л колбу помещают 10,0 г нитробензола, 15,5 г анилина и 50,0 г глицерина. В смесь постепенно при сильном встряхивании вводят 12 мл серной кислоты (d = 1,84 г/мл). Затем колбу снабжают обратным холодильником и осторожно нагревают газовой горелкой до начала реакции. После этого через холодильник порциями по 0,5 – 1,0 мл вводят 12 мл серной кислоты, нагревая смесь после внесения каждой порции, и кипятят в течение 3 часов. К смеси добавляют небольшое количество воды и отгоняют непрореагировавший нитробензол с водяным паром. Содержимое колбы охлаждают и добавляют 40 %-й раствор гидроксида натрия до щелочной реакции по фенолфталеину. Суспензию хинолина и непрореагировавшего анилина подкисляют серной кислотой, охлаждают, и диазотируют концентрированным раствором нитрита натрия до положительной реакции на присутствие азотистой кислоты (около 2,5 г насыщенного раствора нитрита натрия). Реакционную смесь нагревают на водяной бане до прекращения выделения азота, доводят до щелочной реакции 40 %-м раствором гидроксида натрия и отгоняют хинолин с водяным паром. Дистиллят экстрагируют эфиром, эфирный раствор обезвоживают гидроксидом калия, отгоняют эфир на водяной бане и остаток перегоняют при пониженном давлении (10 мм рт. ст.)с дефлегматором, собирая фракцию с температурой кипения 105 – 110 °С. Выход 12,0 – 13,0 г (~55%).
