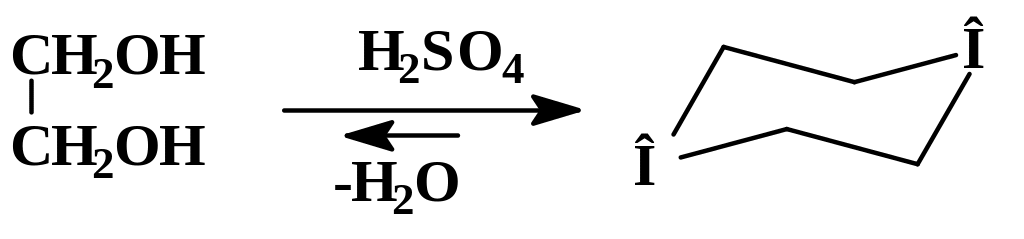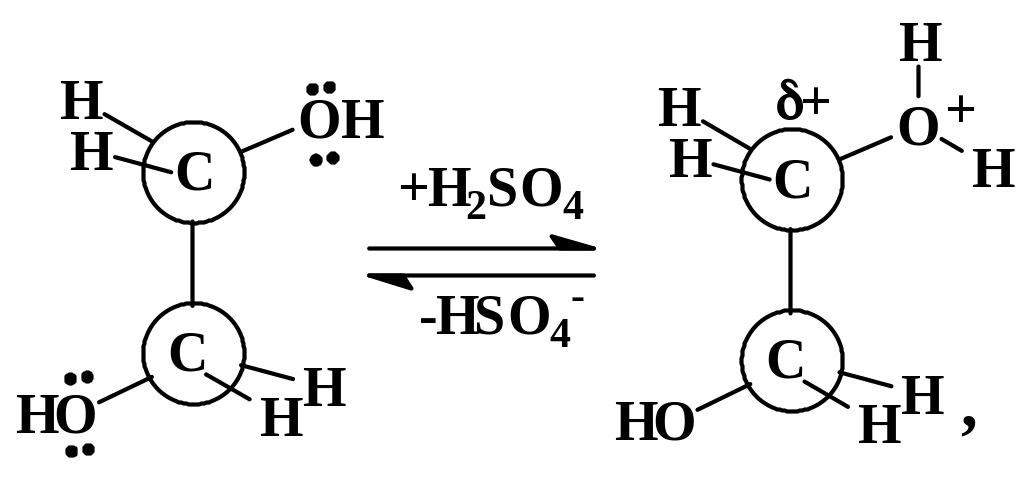- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Контрольные вопросы
1. Напишите уравнения побочных реакций, проходящих при окислении бензилового спирта бихроматом калия в нейтральном растворе.
2. Как влияет рН среды на протекание данной реакции?
3. Как действуют на бензиловый спирт другие окислители: перманганат калия, азотная кислота?
4. При проведении каких операций происходит очистка бензальдегида от бензойной кислоты и бензилового спирта?
5. Почему приходится очищать конечный продукт от бензилового спирта, хотя окислитель был взят в избытке?
6. Предложите другие, кроме действия окислителей на спирт, способы получения бензальдегида.
7. Напишите реакции, при помощи которых можно доказать наличие альдегидной группы в бензальдегиде.
8. Найдите характеристические полосы поглощения альдегидной группы в инфракрасном спектре бензальдегида (рис. 31).
9. Изобразите теоретический ЯМР-спектр бензальдегида. Сравните его с экспериментальным (рис. 32) и произведите отнесение сигналов [7].
3. Синтез гетероциклических соединений
3.1.
1,4-Диоксан
|
(1) |
В круглодонной колбе на 250 мл, снабженной дефлегматором и прямым холодильником, смешивают 22,5 мл (0,4 моль) этиленгликоля и 2,4 мл серной кислоты (d = 1,84 г/мл). Смесь осторожно нагревают до кипения и собирают фракцию 84 – 102 °С до тех пор пока содержимое колбы не начнет чернеть и пениться. Полученный дистиллят высаливают поташом, верхний органический слой отделяют и высушивают гидроксидом калия, а затем перегоняют с дефлегматором собирая фракцию с температурой кипения 100 – 103 °С. Выход с 15,5 г (88 %).
Пояснения к синтезу
В этом синтезе серная кислота играет двоякую роль – водоотнимающего и протонирующего агента. В качестве дегидратирующего реагента концентрированная серная кислота смещает равновесие реакции вправо. Реакция (1) обратима, в к присутствии концентрированной серной кислоты равновесие смещается вправо.
Связи С–О этиленгликоля полярны и атомы углерода заряжены положительно. Однако этого заряда недостаточно для осуществления реакции нуклеофильного замещения. Ей предшествует равновесное протонирование одного из атомов кислорода этиленгликоля:
|
(2) |
в результате которого дробный положительный заряд на соседнем атоме углерода резко возрастает. Этот атом далее подвергается нуклеофильной атаке второй молекулой этиленгиколя, его атомом кислорода, имеющего неподеленную электронную пару («атака с тыла», механизм реакции SN2):
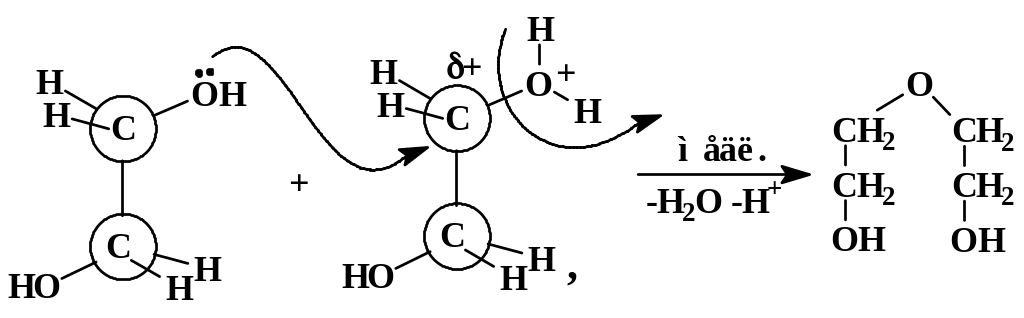
Затем указанная последовательность элементарных реакций повторяется уже внутримолекулярно с образованием 1,4-диоксана.
2,4,6-Трифенилпирилия перхлорат
Трифенилпирилия получают конденсацией 2 моль ацетофенона с 1 моль бензальдегида в присутствии хлорной кислоты:
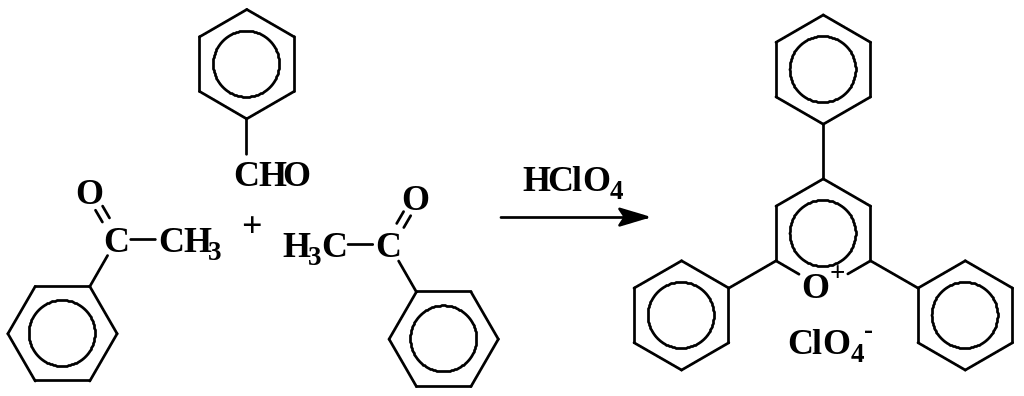
В круглодонную колбу емкостью 250 мл, снабженную обратным холодильником, помещают 4,7 мл (0,04 моль) ацетофенона, 2,1 мл (0,02 моль) бензальдегида, 5 – 6 мл толуола и 2 мл (0,02 моль) 70 %-ной НСO4 (см, прим. I к предыдущему синтезу). Смесь кипятят 3 час, охлаждают и разбавляют 150 мл эфира. Выпавший желтый осадок пирилиевой соли через 2 – 3 час отфильтровывают, промывают эфиром и высушивают сначала на воздухе, затем в вакуум-эксикаторе. Продукт перекристаллизовывают из хлороформа или ледяной уксусной кислоты. Выход 4 г (49 %). Тпл 275 – 276 °.