- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
Превращения диазосоединений Азосочетание
Реакция азосочетания приводит к образованию азокрасителей – очень важного класса соединений. В лабораторной практике часто восстановлением азокрасителей получают окси-амино- и диаминосоединения. Таким образом, здесь азокраситель выступает в качестве промежуточного продукта.
Из всех приведенных выше форм диазосоединений единственной, способной вступать в реакцию азосочетания, является катион диазония.
Азосочетание является типичной реакцией электрофильного замещения. Те соединения, у которых возможно замещение атома водорода, связанного с углеродным атомом, на группу -N=N-Аr, называются азосоставляющими. Первичные ароматические амины, из которых получают соли диазония, принято называть диазосоставляющими.
В тех условиях, в которых обычно проводится реакция азосочетания (водная среда, низкая температура) катионы диазония являются слабыми электрофилами. Они могут вступать в реакцию только с такими ароматическими соединениями, которые содержат в ароматическом ядре наиболее сильные электронодонорные заместители, такие как -ОН, -NН2, -NНR, -NR2, где R - алкил. Реакции азосочетания могут быть записаны в виде следующих схем:
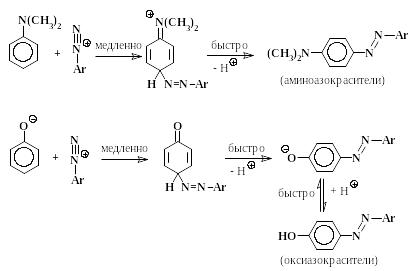
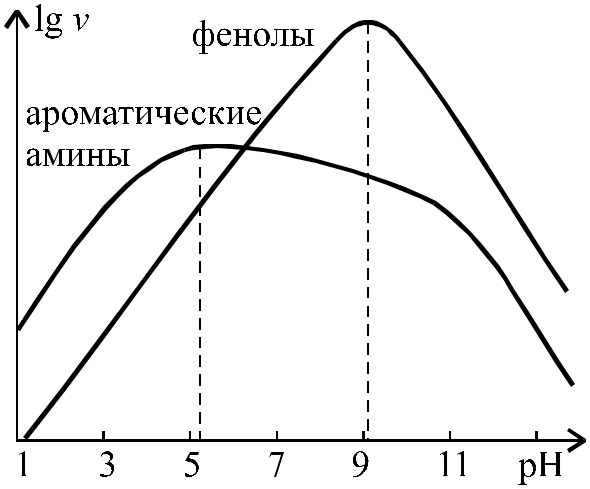
Азосочетание с аминами проводят в слабокислой среде, а с фенолами – в слабощелочной. В последнем случае образуются фенолят-ионы, которые являются гораздо более активными азосоставляющими, чем сами фенолы. Скорости сочетания фенолятов с катионом диазония в 1010 - 1012 раз больше, чем исходных неионизированных фенолов.
Хотя скорость азосочетания с аминами мало зависит от рН в пределах от 5 до 9, реакцию предпочитают вести в слабокислых растворах, так как амины в этих условиях лучше растворимы. Кислая среда необходима при использовании в качестве азосоставляющих первичных или вторичных аминов, которые в нейтральных и слабощелочных растворах превращаются в диазоаминосоединения. При азосочетании образуются почти исключительно продукты пара-замещения наряду с небольшим количеством орто-изомеров. |
Рис. 23. Изменение скорости (v) азосочетания диазоний-катиона с аминами и фенолами в зависимости от величины pH |
Реакции солей диазония с выделением азота
Соли диазония неустойчивы и способны распадаться гетеролитически в растворителях с высокой диэлектрической проницаемостью:
Ar - N+N X Ar+ + N2 + X
или гомолитически (как правило, под действием катализаторов):
Ar - N+N X Ar. + N2 + X.
Направление распада зависит от аниона соли диазония и растворителя. Гомолизу способствуют в основном анионы слабых кислот, но в неводных растворах таким образом распадаются даже хлориды. Растворители с высокой диэлектрической проницаемостью способствуют гетеролитическому распаду (общая закономерность).
Диазосоединения широко используются для замены диазогруппы в аренах на различные функциональные группы. Иногда это единственный метод получения нужного продукта.
Ниже приведены наиболее часто применяемые в лаборатории синтезы с применением диазосоединений. Около каждой реакции указывается, если это достоверно известно, по какому механизму она протекает: ГТЛ (гетеролитически) или ГМЛ (гомолитически).
Замещение диазониевой группы гидроксилом:
Ar-N+N
+ H2O
|
(ГТЛ) |
2. Замещение диазогруппы на Cl, Br, CN и CNS (реакция Зандмейера). Осуществляется путем разложения соли диазония в присутствии соответствующих координационных соединений меди(I) ([CuCl4]3, [CuBr4]3, [Cu(CN)4], [Cu(CNS)4]3):
Ar-N+N
+
X
|
(ГМЛ) |
Доказано, что этот процесс идет через промежуточное образование арильного радикала. Поставщиком электрона, необходимого для гомолитического разрыва связи С-N, является ион меди в степени окисления +1 (схематично):
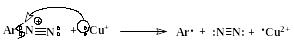
Далее ион Cu2+ вновь превращается в Сu+, забирая электрон у галогена, и радикал Х· образует ковалентную химическую связь с Ar·:
![]()
Таким образом, медь в реакции Зандмейера служит переносчиком электрона.
Образованием в промежуточной стадии арильных радикалов объясняется прохождение ряда побочных процессов при реакциях Зандмейера:
а) Образование диарилов:
Ar. + Ar. Ar-Ar
б) Образование производных азобензола:
![]()
3. Замещение диазогруппы на иод непосредственно действием йодистого калия на водный раствор соли диазония без катализатора:
Ar-N+N + I Ar-I + N2
В случае реакции с йодид-анионом катализатор не нужен, т.к. роль переносчика электрона способен выполнить сам иодид-ион.
4. Разложение сухого тетрафторбората диазония с образованием фторзамещенных:
[Ar-N+N] [BF4] Ar-F + BF3 + N2 |
(ГТЛ) |
5. В ряде случаев диазогруппа может быть замещена на сульфохлоридную группу и нитрогруппу:
Ar-N+N
Cl
+ SO2![]() Ar-SO2Cl
+ N2
Ar-SO2Cl
+ N2
Ar-N+N
SO4H
+ NaNO2
![]() ArNO2
+ N2
+ NaHSO4
ArNO2
+ N2
+ NaHSO4
6. Взаимодействие диазониев с полисульфидами щелочных металлов:
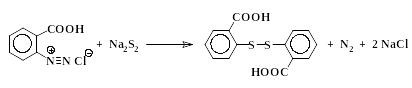
Запрещается применять эту реакцию к диазониям, не содержащим групп, сообщающих растворимость в щелочной среде (-ОН, -СООН, -SО3Н), так как в этом случае наблюдаются сильные взрывы.
Если при диазотировании ароматических аминов образуется нерастворимая в воде соль диазония (например, при диазотировании сульфаниловой кислоты), ее необходимо перерабатывать только во влажном виде из-за чрезвычайной взрывчатости высушенных диазосоединений. Воронку и фильтр, на которых производилось отсасывание диазония, следует немедленно обмыть водой.