
- •О. А. Голубчиков
- •Органический практикум
- •Санкт-Петербург
- •Нии химии сПбГу – 2012
- •Оглавление
- •Предисловие
- •1. Общие правила и методы работы
- •1.1. Планирование работ и ведение рабочего журнала
- •1.1.1. Форма ведения записей в лабораторном журнале
- •1.1.2. Пояснения к составлению таблиц
- •1.1.3. План экспериментальной работы. Отчет о выполнении работы
- •1.2. Правила техники безопасности в лаборатории органического синтеза
- •1.2.1. Общие правила работы
- •1.2.2. Правила обращения с ядовитыми и едкими веществами
- •1.2.3. Правила при работе с огнеопасными веществами
- •1.2.4. Правила при работах, которые могут сопровождаться взрывами или выбросами веществ
- •1.2.5. Правила обращения со стеклом
- •1.3. Основные методы выделения и очистки органических соединений
- •1.3.1 Перекристаллизация Принцип метода
- •Подбор растворителя
- •Практика проведения перекристаллизации
- •Обесцвечивание горячих насыщенных растворов
- •Фильтрование с отсасыванием
- •Сушка органических веществ
- •Определение температуры плавления вещества
- •Контрольные вопросы
- •1.3.2. Перегонка органических жидкостей
- •1.3.2. Простая перегонка при атмосферном давлении
- •Перегонка при уменьшенном давлении (под вакуумом)
- •Перегонка с водяным паром
- •Фракционная перегонка и перегонка с дефлегматором
- •Контрольные вопросы
- •1.3.3. Хроматография
- •Газо-жидкостная хроматография
- •Тонкослойная и бумажная хроматография
- •Нуклеофильное замещение у sp3-гибридизованного атома углерода
- •Нуклеофильное замещение у sp2-гибридизованного карбонильного углерода
- •Контрольные вопросы
- •2.1.2. Бромистый изопропил
- •Примечания:
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.3. Ацетанилид (метод а)
- •2.1.4. Ацетанилид (метод б)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.1.5. Ацетилсалициловая кислота (аспирин)
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •2.2. Электрофильное замещение в ароматическом ряду
- •2.2.1. Основные теоретические положения
- •2.2.2. Нитротолуолы (смесь изомеров)
- •Хроматографическое определение изомерного состава нитротолуолов
- •Пояснения к синтезу
- •Контрольные вопросы
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.2.4. Cульфаниловая кислота
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.3. Восстановление нитросоединений
- •2.3.1. Основные теоретические положения
- •Восстановление металлами в присутствии растворов электролитов
- •Восстановление в кислой среде металлами
- •Пути восстановления нитросоединений в зависимости от pH среды Восстановление в кислой среде
- •Восстановление в щелочной среде
- •Восстановление в щелочной среде растворами сульфидов. Селективное восстановление полинитросоединений
- •Определение конца реакции
- •Выделение продуктов реакции
- •Меры предосторожности при работе с ароматическими аминами
- •2.3.2. Анилин
- •Выделение анилина из реакционной смеси
- •2.3.3. Выделение и идентификация аминов
- •Пояснения к синтезу
- •Экстракция органических веществ из водных растворов
- •Контрольные вопросы
- •2.3.4. Мета-Нитроанилин
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4. Получение и превращения диазосоединений
- •2.4.1. Основные теоретические положения
- •Получение ароматических диазосоединений
- •Механизм диазотирования
- •Факторы, влияющие на скорость диазотирования
- •Контроль диазотирования
- •Формы диазосоединений
- •Превращения диазосоединений Азосочетание
- •Реакции солей диазония с выделением азота
- •2.4.2. Йодбензол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.4.5. Метилоранж
- •Примечания к синтезу
- •Метиловый оранжевый:
- •2.4.6. Кислотный оранжевый (-нафтолоранж)
- •Азосочетание
- •2.4.7. Резорциновый желтый (тропеолин)
- •Азосочетание
- •2.4.8. Спектрофотометрическое определение содержания красителя в растворе
- •2.4.9. Пояснения к синтезам азокрасителей
- •Контрольные вопросы
- •2.5. Окисление
- •2.5.1. Основные теоретические положения
- •2.5.2. Бензойная кислота (из толуола)
- •Примечание
- •2.5.3. Бензойная кислота (из бензилового спирта)
- •Пояснения к синтезам бензойной кислоты (2.5.2 и 2.5.3)
- •Контрольные вопросы
- •2.5.4. Масляный альдегид (бутаналь)
- •Пояснения к синтезу
- •Контрольные вопросы
- •2.5.5. Бензальдегид
- •Пояснения к синтезу
- •Контрольные вопросы
- •3. Синтез гетероциклических соединений
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Бензимидазол
- •Пояснения к синтезу
- •Пояснения к синтезу
- •Хинолин (синтез Скраупа)
- •Пояснения к синтезу
- •Фенилизоиндолизин
- •Пояснения к синтезу
- •Фенотиазин
- •Пояснения к синтезу
- •5,10,15,20-Тетрафенилпорфирины
- •5,10,15,20-Тетрафенилпорфирин
- •Пояснения к синтезу
- •Хроматографическая очистка тетрафенилпорфирина
- •5,10,15, 20-Тетракис(4-нитрофенил)порфирин
- •Пояснения к синтезу
- •5,10,15,20-Тетракис(4-бромфенил)порфирин
- •Приложение
- •Список рекомендуемой литературы
2.4.9. Пояснения к синтезам азокрасителей
Для получения азокрасителей используется реакция азосочетания, представляющая собой процесс электрофильного замещения атома водорода в кольце ароматических аминов или фенолов на группу Аr-N=N-. В качестве электрофила выступает диазоний-катион. Ароматические амины, из которых получаются соли диазония, называются диазосоставляющими. При синтезе водорастворимых азокрасителей в качестве диазосоставляющей часто применяется сульфаниловая кислота. С целью удобства проведения диазотирования используют хорошо растворимую в воде натриевую соль сульфаниловой кислоты. В результате диазотирования образуется п-диазобензолсульфонат, который представляет собой внутреннюю соль (“биполярный ион”, “цвиттер-ион”). Особенностью этой внутренней соли является малая растворимость в водных растворах кислот, поэтому в ходе диазотирования п-диазобензолсульфонат выпадает в виде осадка. Этим он отличается от большинства других солей диазония, которые очень хорошо растворимы в воде и водных растворах кислот. Малая растворимость в воде самой сульфаниловой кислоты также объясняется существованием ее в кристаллическом состоянии в виде биполярного иона (см. стр. 107, 108).
Ароматические соединения, в молекулах которых происходят замещения атомов водорода на арилазогруппы, называются азосоставляющими. При получении метилоранжа в качестве азосоставляющей применяется N,N-диметиланилин (амин), а в синтезе -нафтолоранжа и резорцинового желтого – соответственно -нафтол и резорцин (фенолы).
Соотношение реагентов (кислота и щелочь), а также порядок их смешивания подобраны таким образом, чтобы азосочетание с амином проходило в слабокислой, а с фенолами – в слабощелочной среде.
Азокрасители, содержащие сульфогруппы, обладают хорошей растворимостью в воде, особенно в форме натриевых солей. Метилоранж применяется в качестве индикатора при кислотно-основном титровании, так как способен изменять свой цвет в растворе при изменении рН в интервале 3,1– 4,4.
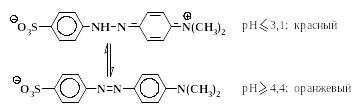
-Нафтолоранж и резорциновый желтый являются простейшими представителями так называемых кислотных красителей. Более сложные аналоги этих соединений используются для крашения шерсти, шелка, кожи и других материалов, в состав которых входят белки. Процесс крашения подобными красителями проводят в кислой среде, отсюда их название “кислотные красители”.
Выпадающие на заключительных стадиях синтеза осадки не могут быть абсолютно чистыми красителями. Добавки неорганических солей к водным растворам органических соединений уменьшают растворимость последних, и они выпадают в осадок. Такой способ выделения веществ из растворов называется “высаливанием”. При высаливании натриевых солей метилоранжа или -нафтолоранжа вместе с ними соосаждается часть хлористого натрия.
При необходимости кислотные красители могут быть очищены перекристаллизацией из воды. В некоторых случаях присутствие небольшого количества хлористого натрия в препарате не препятствует дальнейшему применению красителя. Но при этом необходимо знать, сколько чистого красителя или, как принято называть, “активного ингредиента”, содержится в полученном продукте. Для определения концентрации красителей в растворах используют спектрофотометрический метод (рис. 26). В его основе лежит уравнение Ламберта-Бугера-Бера:
A = lg (I0/I) = ·c·l.
Здесь A – оптическая плотность раствора; I0 – начальная интенсивность светового потока; I – то же после прохождения его через слой раствора толщиной l (см) с концентрацией c (моль/л); – молярный коэффициент погашения.
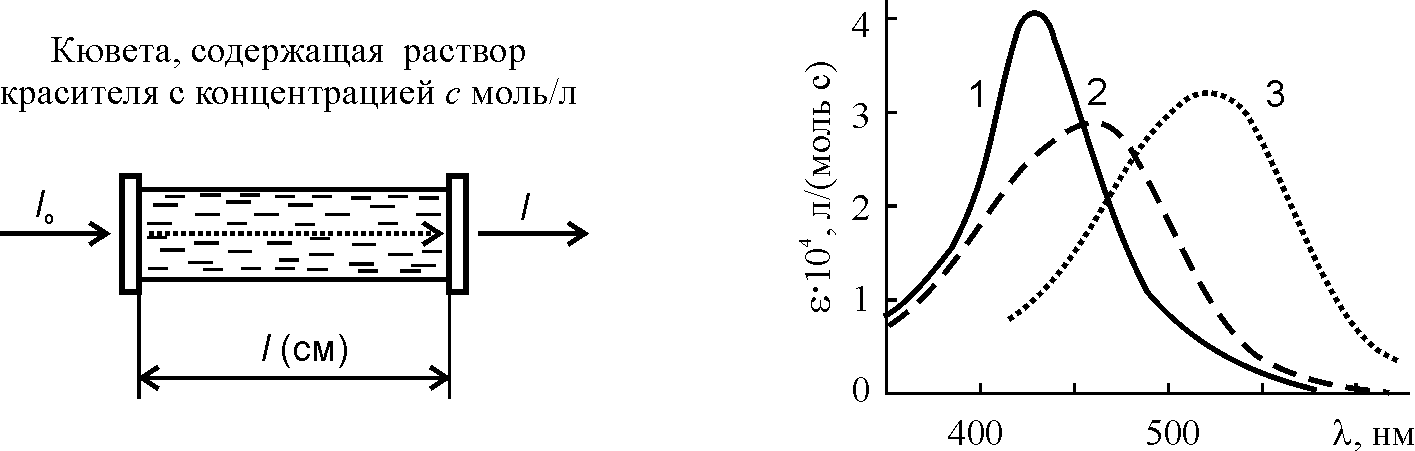
Рис. 26. К принципу фотометрирования
Рис. 27. Спектры поглощения в видимой области: 1 – резорцинового желтого в воде, 2 – метилоранжа в щелочной среде, 3 – метилоранжа в кислой среде
Величина зависит от длины волны света; эта зависимость называется электронным спектром поглощения. Примеры спектров красителей приведены на рис. 27, а величины – в таблице 6.
Из уравнения Ламберта-Бугера-Бера следует, что концентрация красителя в растворе Б равна:
cБ = A/(·l)
Вместе с тем, молярная концентрация красителя в растворе Б равна:
cБ = 0,01p·a·1000v/(M·vA·vБ)
Приравнивая два последних выражения, получаем уравнение, из которого следует расчетная формула (1).
